伏马菌素B1单克隆抗体的制备及免疫学检测方法初步应用
2016-07-16姚静静胡骁飞韩俊岭李青梅王方雨邓瑞广张改平
姚静静,胡骁飞,韩俊岭,李青梅,王方雨,邓瑞广,张改平,3*
伏马菌素B1单克隆抗体的制备及免疫学检测方法初步应用
姚静静1,胡骁飞1,韩俊岭2,李青梅1,王方雨1,邓瑞广1,张改平1,3*
(1.河南省农业科学院动物免疫学重点实验室农业部动物免疫学重点实验室,郑州450002;2.新乡医学院第一附属医院,新乡453100;3.河南农业大学,郑州450002)
摘 要:拟制备灵敏高、特异性强的抗伏马菌素B1(FB1)单克隆抗体,并初步应用于FB1的检测,以期为FB1的免疫学快速检测提供技术支持。采用碳二亚胺法(EDC)制备人工抗原FB1-BSA和FB1-OVA。以免疫原FB1-BSA免疫BALB/c小鼠,每四周免疫一次。四免后,小鼠脾B细胞与SP2/0骨髓瘤细胞融合后,采用ELISA筛选,建立分泌抗FB1抗体的单克隆杂交瘤细胞株;采用动物体内诱生腹水方法制备出抗FB1单抗,并鉴定单抗的各种性能;初步建立FB1免疫学检测方法。结果得到1株稳定分泌抗FB1单抗的杂交瘤细胞株2E11-H3,该细胞株分泌的mAbs的效价高达1∶1.02×106,亲和力常数平均值为7.98×1010L·mol-1,亚型为IgG3。FB1mAbs的工作浓度为1∶6.0×104,与FB1发生特异性反应,间接竞争ELISA测得IC50=43.65ng·mL-1;与FB1结构类似物FB2和FB3的交叉反应率分别为385%和72.4%,与其他霉菌毒素及载体蛋白BSA和OVA均无交叉反应。样品回收率在85.85%~114.07%,平均值为98.81%;变异系数为10.11%。本研究制备出了灵敏度高、特异性强、亲和力高的FB1单抗,并初步建立FB1免疫学检测方法。
关键词:伏马菌素B1;单克隆抗体;杂交瘤;ELISA
伏马菌素(fumonisin)主要是由串珠镰刀菌属产生的一类有毒害和致癌性的真菌毒素,包括FB1、FB2、FB3等11种(结构如图1),其中伏马菌素B1(FB1)是主要组分,也是毒性最强的组分,主要污染玉米、小麦、稻米等粮食作物及其制品[1-3]。采食含有FB1的饲料和食品,可导致人及动物中毒,如马的脑白质软化症、猪肺水肿症、大鼠肝癌、人类食管癌和肝癌等[4-7]。国际癌症研究中心(IARC)将FB1列为2B类致癌物质(即人类可能致癌物)[8],并对其在饲料及食品中含量做了限量(1~3mg·kg-1)规定[9]。
目前,检测FB1的方法主要有仪器分析(高效液相色谱法、质谱及液相色谱-质谱)[1011]和免疫学检测方法[12-13]。仪器分析检测方法尽管灵敏度高,准确性好,但仪器昂贵,检测成本比较高,且不能用于现场实时检测。免疫学检测方法具有样品处理简单、灵明度高、特异性强等优点,适用于现场快速检测大量样品,已成功运用于食品和饲料中霉菌毒素的检测[15,19-22]。2004年,江涛等制备出FB1单克隆抗体,IC50=138.95ng·mL-1[14];以此单克隆抗体研制的试剂盒,抑制曲线回归线方程:y=-0.582 0 x+1.793 0,R2=0.990 1,IC50=166.59 ng·mL-1[15]。2007至2012年间,学者们先后制备出IC50为90.88、3.89和1.43μg·mL-1的FB1mAbs[16-18]。受抗体灵敏度的限制,以上 FB1mAbs,制备快速检测试纸时,不能满足检测限量标准。因此,有必要制备出更高灵敏度的FB1mAbs,以便建立更为灵敏的FB1检测方法,并为FB1快速检测试纸的制备奠定基础。

图1 伏马菌素B1、B2、B3的结构式Fig.1 Structural formula of FB1,FB2,FB3
本研究以FB1-BSA为免疫原,结合杂交瘤技术和ELISA检测制备出针对伏马菌素B1的高亲和力、灵敏度和特异性的单克隆抗体,并初步建立了FB1免疫学检测方法。该单克隆抗体结合胶体金免疫层析技术,有望建立灵敏度更高的免疫学快速检测伏马菌素的方法。
1 材料与方法
1.1 试剂与仪器
伏马菌素B1、B2、B3(FB1、FB2、FB3),黄曲霉毒素B1和M1(AFB1、AFM1),T-2毒素,脱氧雪腐镰刀菌烯醇(DON),玉米赤霉烯酮(ZEN),赭曲霉毒素(OTA)牛血清白蛋白(BSA)、卵清白蛋白(OVA),1640培养基、HAT、HT、PEG、弗氏完全佐剂、弗氏不完全佐剂、羊抗鼠酶标二抗(GAM-IgGHRP)、抗体亚类测定试剂盒购自Sigma公司;胎牛血清(Gibico公司)。Bio-Rad-550型酶标仪,美国Bio-Rad公司;CO2培养箱(Themo公司),洁净台,生物倒置显微镜(Leica公司),U-3000紫外扫描仪(UV),日本岛津;3K-18高速冷冻离心机,德国Sigma公司;DK-8D电热恒温水槽,上海一恒科技有限公司,HPLC-MS购自Waters公司;BALB/c小鼠购自郑州大学医学院实验动物中心,SP2/0骨髓瘤购自中国农业大学动物实验室。其他试剂均为分析纯。
1.2 ELISA溶液体系
包被液:0.05mol·L-1、pH=9.6碳酸盐缓冲液(CBS);洗液(PBST):0.01mol·L-1、pH=7.4磷酸盐缓冲液(PBS),含0.05%Tween-20;封闭液:5%猪血清的PBST;显色液:TMB的磷酸-柠檬酸缓冲液;终止液:2mol·L-1硫酸溶液。
1.3 方法
1.3.1 人工抗原FB1-BSA的合成 称取2mg伏马菌素B1充分溶于1mL PBS,搅拌下加入1.7 mg碳二亚胺(EDC),4℃下搅拌0.5h,充分活化FB1。将3.6mg BSA溶于1mL PBS的溶液逐滴加入以上溶液中,4℃下避光反应3h。反应结束后,溶液澄清,用PBS为透析液,每6h更换一次,透析3d。然后,将透析袋中液体5 000r·min-1离心5min,收集上清,即得免疫抗原FB1-BSA,冻存备用。合成路线如图2。制备检测抗原FB1-OVA的方法同上。

图2 抗原FB1-BSA的合成路线Fig.2 The synthesis of the artificial antigen FB1-BSA
1.3.2 动物免疫 取8周龄雌性BALB/c小鼠4只,首免将免疫原FB1-BSA与弗氏佐剂乳化5 min,按20μg·200μL-1每只的剂量进行初免,颈部、皮下多点注射。免疫周期为4周,免疫剂量相同,共免4次,二、三、四免均用弗氏不完全佐剂。四免后1周采血ELISA测定,选择血清效价高与FB1抑制强的小鼠,融合前3d用完全抗原50μg·200 μL-1每只,不添加佐剂,加强免疫。
1.3.3 细胞融合 免疫脾细胞与SP2/0骨髓瘤细胞融合:融合前1d无菌条件下取BALB/c小鼠腹腔内细胞做饲养细胞,铺96孔板细胞培养板备用;取加强免疫过的小鼠眼睛血,作阳性对照,将小鼠脱颈致死,无菌条件下取脾制备脾细胞,与SP2/0骨髓瘤细胞按照10∶1的比例混合,用50%PEG-1500促融;将融合后的细胞悬液接种到已铺有饲养细胞的96孔细胞培养板中,先用HAT,再用HT培养液培养,10d后用1640完全培养基培养。
1.3.4 杂交瘤筛选及抗体检测 间接非竞争与间接竞争ELISA进行筛选。以FB1-OVA为包被原,以SP2/0细胞上清为空白对照,间接非竞争ELISA筛选分泌FB1抗体的细胞孔,间接竞争ELISA确认并检测敏感性。选择阳性较高、抑制率高、细胞生长旺盛的细胞孔进行有限稀释克隆化,之后扩大培养、液氮冻存。
1.3.5 抗FB1mAbs的大量制备 采用动物体内诱生腹水法制备FB1单抗:向8周左右BALB/c小鼠腹腔注射液体石蜡,0.5mL·只-1,10d后腹腔注射单克隆阳性细胞0.5mL·只-1(0.5~1× 106个),8~10d后抽取腹水,离心除去油脂沉淀后,即得FB1mAbs。
1.3.6 单克隆抗体的鉴定
1.3.6.1 单克隆抗体的纯化:采用辛酸-硫酸铵法[23]纯化mAbs蛋白。10%SDS-PAGE检测蛋白的纯度并估算蛋白的相对分子质量。
1.3.6.2 抗体亚类的测定:采用抗体亚类试剂盒测定。
1.3.6.3 抗体效价:采用间接ELISA测定抗体效价:以4μg·mL-1的包被原FB1-OVA包板;将mAbs稀释至1∶1 000,倍比稀释,37℃放置15 min,加入5%猪血清的PBST稀释1 000倍的GAM-IgG-HRP,37℃酶标30min,加入TMB底物显色8min,加入终止液(2mol·L-1H2SO4)10 min内测吸光值OD450nm。设阳性对照(PC,阳性小鼠血清),阴性对照(NC,SP2/0细胞上清液),空白对照(BC,抗体稀释液)各两孔,检测结果以(OD实验-OD空白)/(OD阴性-OD空白)≥2.1为阳性。
1.3.6.4 抗体亲和力测定:采用间接ELISA测定单克隆抗体的亲和力常数[24]:分别以1和2μg·mL-1的抗原FB1-BSA包板,每孔50μL,37℃温育2h后,PBST洗板;用5%猪血清的PBST封闭,每孔220μL,37℃温育1h,PBST洗板;将mAbs稀释至1∶10 000(7.2μg·mL-1),倍比稀释测OD450nm,方法参见“1.3.6.3”。亲和力常数的计算方法:以抗体稀释倍数-OD450nm值作图,计算不同抗原浓度时OD450nm对应的抗体浓度,代入公式K=(n-1)/2 (nAb′-Ab)计算亲和力常数kaff(L·mol-1)。Ab 和Ab′分别表示当抗原浓度为Ag和Ag′时,OD450nm对应的抗体浓度(mol·L-1),n=Ag/Ag′。
1.3.6.5 灵敏度:通常以50%抗原抗体结合抑制药物的浓度(IC50)表示。采用棋盘法,选择OD值在1.0左右时包被原浓度为最佳工作浓度。灵敏度取决于标准曲线的斜率和零浓度标准点(B0)变异的大小:斜率的绝对值越大,B0的变异越小,则灵敏度越高。零标准品的OD值代表100%的活性(B0),B/B0为药物的抑制率,即抑制率=系列药物组OD值/B0。以FB1浓度的对数值为横坐标,B/B0为纵坐标,制作mAbs的抑制曲线,可得出IC50。
间接竞争ELISA检测步骤如下:(1)以包被原最佳工作浓度包板,每孔50μL,37℃温育2h后,PBST洗板;(2)用5%猪血清的PBST封闭,每孔220μL,37℃温育1h,洗板;(3)FB1浓度设置为0、10、20、40、80、160、320ng·mL-1,每孔50μL,加入50μL抗FB1抗体,稀释液为PBS,设置阴性对照(NC)和空白对照(BC),37℃温育15min后洗板;(4)加入5%猪血清的PBST稀释1 000倍稀释的GAM-IgG-HRP,每孔50μL;(5)加酶底物TMB显色液,每孔50μL,室温反应10min;(6)终止显色反应,加入终止液2mol·L-1H2SO4,每孔50 μL,用酶标仪读OD450nm值。
1.3.6.6 抗FB1mAbs特异性:采用间接竞争ELISA测定,药物有伏马菌素B2和B3(FB2、FB3),黄曲霉毒素B1和M1(AFB1、AFM1),T-2毒素,脱氧雪腐镰刀菌烯醇(DON),玉米赤霉烯酮(ZEN),赭曲霉毒素(OTA)等真菌类毒素及载体蛋白BSA 和OVA,方法同“1.3.6.5”。
1.3.6.7 回收率的测定:用“1.3.6.5”中建立的抑制曲线,测定含有FB180ng·mL-1标准溶液20次,计算测定值、回收率和变异系数(Coefficient of variation,CV)。回收率=(新样品测定值-原样品测定值)/已知加标量×100%。
1.3.6.8 液相色谱-质谱串联(HPLC-MS)法验证:由河南省粮油饲料产品质量监督检验中心提供的2个霉变玉米样品,经粉碎处理,分别采用HPLC-MS和本研究建立的免疫学检测方法进行测定,每个样品每种方法测6次。检测结果以±s表示,采用SPSS13.0软件进行单因素独立t检验分析,P<0.05说明差异显著。
2 结 果
2.1 融合小鼠的选择
采用人工免疫抗原FB1-BSA免疫BALB/c小鼠,四免后一周,采免疫鼠血清。包被原FB1-OVA的工作浓度为4μg·mL-1,将编号为1~4小鼠的血清分别按照1∶200的比例用PBS稀释,采用间接ELISA测效价,结果见表1,说明四只小鼠均产生良好的免疫反应,血清效价高达1∶12 800。接着,将以上编号为1~4小鼠的血清分别按照1∶200、1∶200、1∶800、1∶400稀释,采用间接竞争ELISA测小鼠血清的敏感性,结果见表2。FB1标品对四只小鼠血清均产生较强的抑制,选择抑制效果最好的3号鼠进行细胞融合。

表1 间接ELISA测多抗血清效价Table 1 Titer of antiserum detected by indirect ELISA

表2 间接竞争ELISA测多抗血清抑制效价Table 2 Inhibitive titer of antiserum against FB1by indirect competitive ELISA
2.2 杂交瘤细胞株的筛选
细胞融合后7d,10块细胞培养板上960孔均形成杂交瘤细胞株,融合率达100%。间接ELISA检测均为阳性孔,间接竞争ELISA检测以上OD值较高的136阳性孔中有46孔为假阳性,其中2E11、4A9、6F8和7B11这四孔的细胞上清的效价较高且抑制效果较好,经过一次亚克隆后获得1株杂交瘤细胞(2E11-H3),经传代一个月,冻存与复苏后,杂交瘤细胞分泌抗体稳定。
2.3 抗体的纯度及其特性鉴定
2.3.1 抗体纯度的鉴定 经过辛酸-硫酸铵纯化前与纯化后的mAbs蛋白的10%SDS-PAGE电泳图见图3。结果表明,纯化后的抗FB1单克隆抗体蛋白具有较高的纯度,该蛋白的两条链分别约为50 和25ku,经Bio-Rad Qunitity ONE分析估算出该抗体的相对分子质量约为150ku。
2.3.2 抗体亚类的鉴定 2E11-H3杂交瘤细胞株分泌的单克隆抗体经过抗体亚类试剂盒测定,鉴定其为IgG3。
2.3.3 抗体效价 抗FB1单克隆抗体的大量制备参见方法“1.3.5”。杂交瘤细胞株2E11-H3的细胞上清和纯化后的mAbs采用间接非竞争ELISA测定效价。细胞上清效价达1∶100以上,纯化后的mAbs效价高达1.02×106,结果见表3。

表3 间接ELISA测纯化后抗FB1mAbs效价Table 3 Titer of purified mAbs against FB1detected by indirect ELISA
2.3.4 抗体亲和力测定 方法见“1.3.6.4”,得到系列OD450nm值见图4,代入公式,得到该mAbs的亲和力常数平均值为7.98×1010L·mol-1。
2.3.5 间接竞争ELISA方法的建立 采用ELISA方阵确定包被原FB1-OVA的最佳工作浓度为2.6μg·mL-1,抗FB1单抗的稀释倍数为1∶60 000,HRP标记羊抗鼠IgG的浓度为1 000倍稀释,抗体与抗原反应时间为15min,酶标时间为30min,TMB底物反应时间为8min,标准品FB1的浓度范围为0、10、20、40、80、160、320ng·mL-1,结果见表4,说明FB1标品对抗FB1单抗具有较高的抑制水平。

图3 抗FB1单克隆抗体的SDS-PAGEFig.3 SDS-PAGE for mAbs against FB1

图4 抗体亲和力测定曲线Fig.4 Affinity curve for mAbs against FB1

表4 间接竞争ELISA测抗FB1单克隆抗体抑制水平Table 4 Inhibitive titer of mAbs against FB1detected by indirect competitive ELISA
2.3.6 抗体灵敏度与特异性 采用间接竞争ELISA检测抗FB1单克隆抗体对伏马菌素B1的抑制。由表4中的试验数据按照“1.3.6.5”的方法作标准曲线,结果见图5。标准曲线的线性范围为5~320ng·mL-1,回归线方程:y=-0.478 3x+1.285 8(R2=0.990 1),IC50=43.65ng·mL-1,检出限为3.96ng·mL-1,完全抑制时的浓度为149.78ng·mL-1,说明以上制备的抗FB1mAbs 对FB1具有较高的灵敏度。该mAbs与伏马菌素B2和B3(FB2、FB3),黄曲霉毒素B1和M1(AFB1、AFM1),T-2毒素,脱氧雪腐镰刀菌烯醇(DON),玉米赤霉烯酮(ZEN),赭曲霉毒素(OTA)等真菌类毒素及载体蛋白BSA和OVA的交叉反应的测定方法参见“1.3.6.6”,结果见表5,说明该抗体与FB1的亲和力很强,具有较高的特异性。同时,可用于检测结构类似物FB2、FB3。
2.3.7 回收率的测定 为了评估本研究建立的对FB1的免疫学检测方法的准确性,对回收率及变异系数进行测定,方法参见“1.3.6.7”,结果见表6。结果表明:测定80ng·mL-1FB1的标准液20次,测定值在68.68~91.25ng·mL-1,平均值为79.05ng·mL-1;回收率在85.85%~114.07%,平均值为98.81%;变异系数为10.11%。说明已建立的检测方法具有较高的准确性。
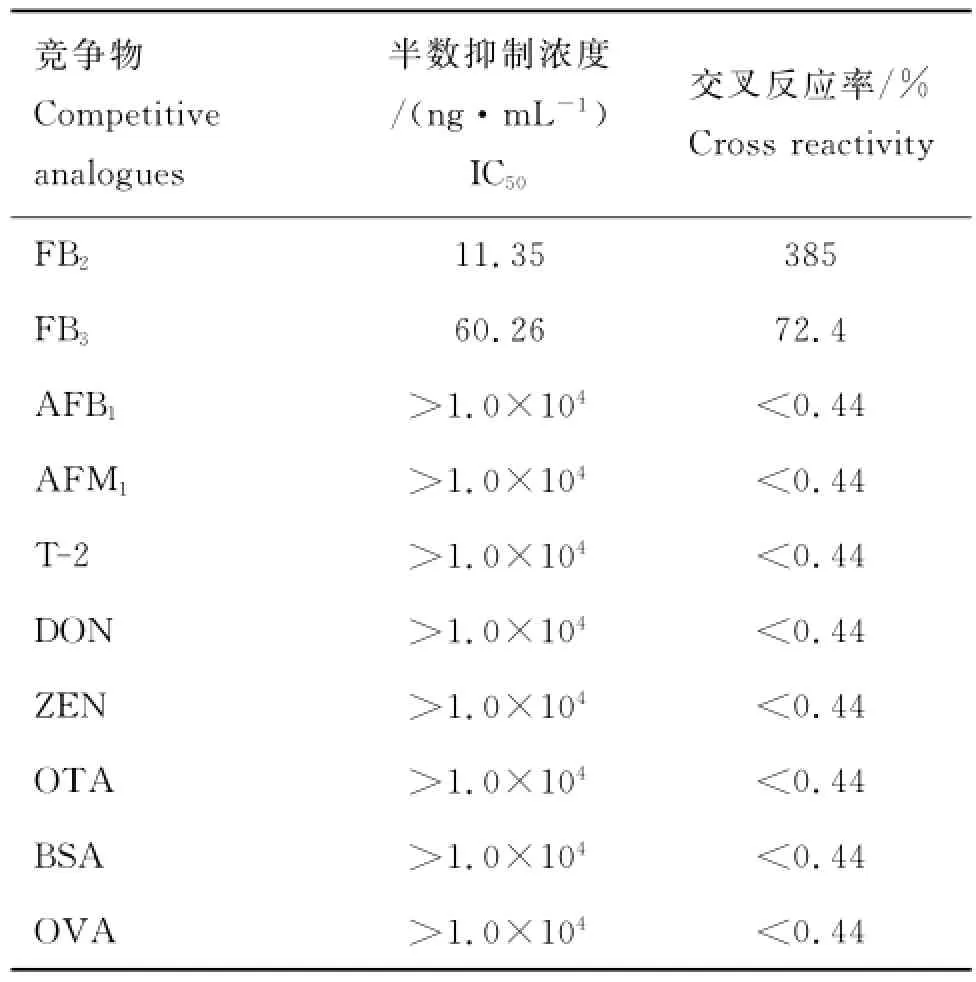
表5 抗FB1单克隆抗体与其他竞争物的交叉反应Table 5 The cross reaction of mAbs against FB1with other analogues
2.3.8 与HPLC-MS检测结果的对比 采用本研究建立的FB1检测方法与HPLC-MS法分别对2个霉变的玉米样品,测定结果见表7。将两种方法的检测结果进行单因素独立t检验分析,P>0.05说明差异不显著。说明该ELISA对FB1的测定结果具有较高可靠性。

图5 抗FB1单克隆抗体的抑制曲线Fig.5 The inhibitive curve for mAbs against FB1

表6 回收率测定结果Table 6 The results of recovery
表7 本检测方法与HPLC-MS测定结果对比(±s)Table 7 The comparation of the ELISA with HPLC-MS(±s) μg·g-1

表7 本检测方法与HPLC-MS测定结果对比(±s)Table 7 The comparation of the ELISA with HPLC-MS(±s) μg·g-1
每种方法测6次The assays were carried out in six replicates on the same time
样品编号Sample No.ELISA测定值Test of ELISA HPLC-MS测定值Test of HPLC-MS 1 1.86±0.21 1.71±0.12 2 1.17±0.26 1.06±0.15
3 讨 论
伏马菌素B1作为一种相对分子质量只有722.8的小分子真菌毒素,获得该毒素的抗体,合成FB1的人工抗原就显得尤为重要。FB1的分子结构式(图1)含有4个羧基,1个氨基和3个羟基,可采用EDC法[13,18]或戊二醛法[14-17,21]直接与载体蛋白BSA、OVA偶联,制备免疫原FB1-BSA和包被原FB1-OVA。鉴于戊二醛法是通过醛基与氨基形成亚胺键的偶联,而亚胺键在水溶液会发生水解,导致FB1从载体蛋白上脱离;同时,由于FB1分子中的氨基活性远高于载体蛋白中的氨基,极易发生FB1的自联。本研究采用EDC法,采取FB1、EDC、BSA (OVA)的物质的量之比为1∶3.3∶1/50进行偶联,以尽量避免FB1的自联,获得人工抗原FB1-BSA和包被原FB1-OVA,得到高特异性和亲和力的单克隆抗体证实了人工抗原合成上的成功。
关于该抗体的灵敏度,采用间接竞争ELISA检测抗FB1单克隆抗体的抑制效价,标准曲线的回归线方程为:y=-0.478 3x+1.285 8(R2=0.990 1),IC50=43.65ng·mL-1,检出限为3.96ng·mL-1,完全抑制时的浓度为149.78ng·mL-1。相比于早期报道的抗FB1单克隆抗体[14-18]而言,该抗体具有更高的灵敏度,结合胶体金层析技术,有望建立灵敏度更高的免疫学快速检测FB1的方法,更方便、快捷地检测玉米及其制品中伏马菌素的含量。
对抗体特异性的检测,本研究选择了几种常见的污染谷物的真菌毒素及伏马菌素B2、B3与抗FB1mAbs进行交叉反应,其中与其他种类的真菌毒素的交叉反应率均<0.44%,不干扰FB1的检测。与FB2、FB3的交叉反应率分别为385%和72.4%,可能由于伏马菌素是一类长链状的小分子,与FB1相比,FB2、FB3在结构上少了一个羟基(-OH)(图1),这样的微小差别对分子的结构和性质的影响较小,相应的动物产生的免疫应答的差别会较小。这是该抗FB1单克隆抗体与FB2、FB3交叉反应率较高的原因。考虑到FB1是伏马菌素的主要成分,也是毒性最强的组分,以上交叉反应的存在并不影响该单克隆抗体在检测FB1中的使用,同时可用于检测FB1、FB2、FB3的累计含量。
基于该单克隆抗体建立的FB1ELISA检测方法,样品回收率在85.85%~114.07%,平均值为98.81%;变异系数为10.11%,与HPLC-MS的检测结果对比,差异不显著(P>0.05),说明该方法具有较高的准确性和可靠性。
4 结 论
作者通过合成人工抗原,免疫小鼠,细胞融合及筛选,成功获得能够稳定分泌抗FB1单克隆抗体的杂交瘤细胞株,并制备灵敏度较高(IC50=43.65 ng·mL-1),亲和力和特异性均较好的抗FB1mAbs。基于该单克隆抗体建立的FB1ELISA检测方法具有较高的准确性和可靠性。希望该抗体可以结合胶体金免疫层析技术,建立灵敏度更高的快速检测FB1的方法。
参考文献(References):
[1] SYDENHAM E W,GELDERBLOM W C A,THIEL P G,et al.Evidence for the natural occurrence of fumonisin B1,a mycotoxin produced by Fusarium moniliforme,in corn[J].J Agric Food Chem,1990,38(1):285-290.
[2] SHIER W T,ABBAS H K,ABOU-KARAM M,et al.Fumonisins:abiogenic conversions of an environmental tumor promoter and common food contaminant [J].Toxicol Toxin Rev,2003,22(4):591-616.
[3] SHEPHARD G S,THIEL P G,STOCKENSTRÖM S,et al.Worldwide survey of fumonisin contamination of corn and corn-based products[J].J AOAC Int,1996,79(3):671-687.
[4] GIANNITTI F,DIAB S S,PACIN A M,et al.Equine leukoencephalomalacia(ELEM)due to fumonisins B1and B2in Argentina[J].Pesq Vet Bras,2011,31(5):407-412.
[5] ZOMBORSZKY-KOVÁCS M,KOVÁCS F,HORM P,et al.Investigations into the time-and dose-dependent effect of fumonisin B1in order to determine tolerable limit values in pigs[J].Livest Prod Sci,2002,76 (3):251-256.
[6] YAO Z G,ZHANG X H,HUA F,et al.Effects of fumonisin B1on HLA classⅠantigen presentation and processing pathway in GES-1cells in vitro[J].Hum Exp Toxicol,2011,30(5):379-390.
[7] WILD C P,GONG Y Y.Mycotoxins and human disease:a largely ignored global health issue[J].Carcinogenesis,2010,31(1):71-82.
[8] IARC(International Agency for Research on Cancer).Fumonisn B1[R].IARC,Lyon,France,2002,82:301-366.
[9] WANG Y,HE C H,ZHENG H,et al.Characterization and comparison of fumonisin B1-protein conjugates by six methods[J].Int J Mol Sci,2012,13(1):84-96.
[10] 王军淋,胡玲玲,蔡增轩,等.超高压液相色谱法同时检测玉米中的伏马毒素B1、B2、B3[J].食品安全质量检测学报,2013,4(1):215-223.WANG J L,HU L L,CAI Z X,et al.Simultaneous determination of fumonisin B1,B2and B3in maize by ultra pressure liquid chromatography[J].Journal of Food Safety and Quality,2013,4(1):215-223.(in Chinese)
[11] 李正翔,陈小龙,曹赵云,等.液相色谱-串联质谱法测定粮谷中的伏马毒素[J].分析测试学报,2014,33 (2):167-172.LI Z X,CHEN X L,CAO Z Y,et al.Determination of fumonisins in cereals using liquid chromatographytandem mass spectrometry[J].Journal of Instrumental Analysis,2014,33(2):167-172.(in Chinese)
[12] 王 君.伏马毒素B1免疫学检测方法的研究[D].上海:上海交通大学,2010.WANG J.Study on immunoassay for fumonisin B1[D].Shanghai:Shanghai Jiao Tong University,2010.(in Chinese)
[13] 王 耀.伏马菌素B1免疫学快速检测方法的研究[D].河南:河南科技大学,2012.WANG Y.Study of fumonisin B1immunoassay rapid detection method[D].Henan:Henan University of Science and Technology,2012.(in Chinese)
[14] 江 涛,王玉平,韩春卉,等.抗伏马菌素B1单克隆抗体的制备和特性[J].军事医学科学院院刊,2004,28 (6):558-561.JIANG T,WANG Y P,HAN C H,et al.Development of the monoclonal antibody against fumonisin B1[J].Bulletin of the Academy of Military(Medical Sciences),2004,28(6):558-561.(in Chinese)
[15] 江 涛,宫慧之,李凤琴,等.抗伏马菌素B1单克隆抗体的制备及试剂盒的研制[J].卫生研究,2006,35 (2):209-212.JIANG T,GONG H Z,LI F Q,et al.Development of the monoclonal antibody against fumonisin B1and ELISA-kit of quantitative analysis for fumonisin B1[J].Journal of Hygiene Rasearch,2006,35(2):209-212.(in Chinese)
[16] 许金俊,陈 飞,秦爱建,等.抗伏马菌素B1单克隆抗体的制备与特性鉴定[J].细胞与分子免疫学杂志,2007,23(10):956-958.XU J J,CHEN F,QIN A J,et al.Generation and identification of the monoclonal antibody against fumonisin B1[J].Chinese Journal of Cellular and Molecular Immunology,2007,23(10):956-958.(in Chinese)
[17] 王 莹,郑 浩,何成华,等.伏马菌素B1单克隆抗体的制备及鉴定[J].中国农业科学,2011,44(20):4302-4308.WANG Y,ZHENG H,HE C H,et al.Generation and identification of the monoclonal antibody against fumonisin B1[J].Scientia Agricultura Sinica,2011,44 (20):4302-4308.(in Chinese)
[18] 许 杨,邹 龙,刘师文,等.伏马菌素B1单克隆抗体制备及化学发光免疫检测方法的建立[J].分析化学,2012,40(11):1735-1739.XU Y,ZOU L,LIU S W,et al.Production of monoclonal antibodies for detection of fumonisin B1by chemiluminescence enzyme-linked immunosorbent assaay[J].Chinese Journal of Analytical Chemistry,2012,40(11):1735-1739.(in Chinese)
[19] 宫慧芝.抗伏马菌素B1单克隆抗体杂交瘤细胞株的建立及ELISA试剂盒的研制[D].沈阳:中国医科大学,2005.GONG H Z.Development of hybridoma cell lines excreting monoclonal antibodyies against fumonisin B1and study of ELISA-kit[D].Shenyang:China Medical University,2005.(in Chinese)
[20] 宫慧芝,计 融,杨 军,等.伏马菌素B1单抗ELISA检测试剂盒研制[J].中国公共卫生,2007,23(8):974-975.GONG H Z,JI R,YANG J,et al.Development ELISA-kit of quantitative analysis for fumonisin B1[J].Chinese Journal of Public Health,2007,23(8):974-975.(in Chinese)
[21] 樊海新,李寒松,李复辉,等.伏马菌素B1胶体金免疫层析试纸条的研制[J].南京农业大学学报,2015,38 (3):483-490.FAN H X,LI H S,LI F H,et al.Development of golden immunochromatographic strip for determination of fumonisin B1[J].Journal of Nanjing Agricultural University,2015,38(3):483-490.(in Chinese)
[22] YU Q,LI H,LI C L,et al.Gold nanoparticles-based lateral flow immunoassay with silver staining for simultaneous detection of fumonisin B1and deoxynivalenol[J].Food Control,2015,54:347-352.
[23] 刘晓波,蔡美英,王 霞,等.一种简单实用纯化腹水McAb方法—辛酸/硫酸铵法[J].华西医科大学学报,1999,30(4):455-456.LIU X B,CAI M Y,WANG X,et al.One simple and efficient method of purification of IgG McAb from mice ascites:caprylic acid/ammonium sulfate precipitation[J].Journal of West China University of Medical Sciences,1999,30(4):455-456.(in Chinese)
[24] 万文徽,董志伟.单克隆抗体亲和常数的测定[J].单克隆抗体通讯,1993,9(2):72-75.WAN W H,DONG Z W.Determination of the affinity constant for monoclonal antibody[J].Journal of Monoclonal Antibody,1993,9(2):72-75.(in Chinese)
(编辑 白永平)
Development and Preliminary Application of the Monoclonal Antibody against Fumonisin B1
YAO Jing-jing1,HU Xiao-fei1,HAN Jun-ling2,LI Qing-mei1,WANG Fang-yu1,DENG Rui-guang1,ZHANG Gai-ping1,3*
(1.Henan Academy of Agriculture Science/Key Laboratory of Animal Immunology,Ministry of Agriculture/Henan Key Laboratory of Animal Immunology,Zhengzhou450002,China;2.The First Affiliated Hospital of Xinxiang Medical University,Xinxiang453100,China;3.Henan Agricultural University,Zhengzhou450002,China)
Abstract:A monoclonal antibody against fumonisin B1(FB1)was developed and applied to establish rapid immunology detection method of FB1.FB1was successfully conjugated with BSA and OVA using EDC,respectively.Hybridoma cell line secreting monoclona antibodys(mAbs)against FB1was produced by fusing murine SP2/0cells with the spleen B cells of BALB/c mice which was immunized with FB1-BSA for four times,every four weeks at a time.The mAbs against FB1were obtained by inducing ascites in the mice body.The affinity,titer,substype and sensibility of the mAbs were assayed with ELISA.Furthermore,the mAbs were preliminarily applied in immunology detection of FB1.The mAbs against FB1whose substype was tested as IgG3were secreted byhybridoma cell line(2E11-H3).The working concentration of the mAbs was 1∶6.0×104,affinity constant was 7.98×1010L·mol-1,IC50was 43.65ng·mL-1.The cross reaction ratios with Fumonisin B2and B3were accordingly 385%and 72.4%,while none with other analogues and carrier protein.The recovery rate of sample was among 85.85%-114.07%,the average was 98.81%and the coefficient of variation was 10.11%.The monoclonal antibody against FB1with high affinity,specificity and sensibility was produced and preliminarily applied in immunology determination of FB1.
Key words:fumonisin B1;monoclonal antibody;hybridomas;ELISA
中图分类号:S859.8
文献标志码:A
文章编号:0366-6964(2016)05-1009-09
doi:10.11843/j.issn.0366-6964.2016.05.019
收稿日期:2015-10-22
基金项目:国家科技支撑计划课题(2014BAD13B05);河南省农业科学院优秀青年基金项目(2013YQ29);河南省基础与前沿项目(162300410135)
作者简介:姚静静(1988-),女,河南禹州人,助理研究员,硕士,主要从事食品安全检测研究,E-mail:yaojinglucky8023@163.com
*通信作者:张改平(1960-),男,河南内黄人,中国工程院院士,E-mail:zhanggaiping2003@163.com
