细胞表面荧光免疫吸附法在猪流行性腹泻病毒N 蛋白单克隆抗体杂交瘤筛选中的应用
2020-07-01罗素贤郭楠楠宋德平黄冬艳唐玉新
罗素贤,陈 君,郭楠楠,宋德平,吴 琼,丁 珍,黄冬艳,甘 平,叶 昱*,唐玉新*
(1.江西农业大学动物与科学技术学院,江西 南昌 330045;2.江西省畜禽疫病诊断与防控重点实验室,江西 南昌 330045;3. 江西省动物疫病预防控制中心,江西 南昌 330006)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于冠状病毒科,α冠状病毒属的成员,是一种单股正链RNA病毒,基因组全长约为28 kb,分别由5'非编码区(Untranslated region,UTR)、开放阅读框1a和1b(ORF1a/1b)、纤突(Spike,S)、ORF3、囊膜蛋白(Envelope,E)、膜蛋白(Membrane,M)、核衣壳(Nucleocapsid,N)和3'UTR 组成[1],该病毒感染哺乳仔猪后可引起其大量死亡,尤其以7 日龄以下的新生仔猪最易感,造成水样腹泻和脱水,死亡率高达80%~100%[2]。PEDV N 蛋白在病毒RNA 合成中发挥重要作用,促进病毒转录和组装。该蛋白相对保守,是病毒自身的优势抗原,常作为感染早期精准诊断的最佳靶标。因此,快速制备针对N 蛋白的单克隆抗体(Monoclonal antibody,MAb),对PEDV 感染的及早确诊与疾病预警具有重大意义,有助于在疾病暴发前期开展干预和防控[3]。
杂交瘤细胞的筛选技术是制备良好MAb 的关键。因此,国内外研究人员对MAb 的制备技术和工艺不断地完善和发展[4-5]。任瑞敏等采用半固体培养基,高通量筛选分泌目的MAb 的杂交瘤细胞,极大缩短其筛选的时间,但该方法存在无差别性选择,后续MAb 验证的工作量大[6]。Dippong 等通过流式细胞分选技术,挑取单个抗原特异性标记的杂交瘤细胞,提高了阳性克隆的筛选效率,但最终MAb 效价的评估还需借助ELISA 等方法完成[7]。近日Li 等开发了细胞表面荧光免疫吸附技术(Cell surface-fluorescence immunosorbent assay,CSFIA),分泌的MAb特异性结合锚定于杂交瘤细胞表面的抗原,半固体培养基内的荧光标记二抗识别MAb 与抗原的复合物,直接通过观察荧光信号,快速鉴定阳性杂交瘤细胞株[8]。为缩短制备MAb 时间,获得高效价的针对PEDV N 蛋白的MAb,本研究构建了PEDV N 蛋白原核表达载体,转化大肠杆菌后纯化蛋白,以常规方式免疫BALB/c 小鼠,通过CSFIA 对融合的杂交瘤细胞进行一次筛选,并且与传统ELISA 方法比较,为将来应对突发疾病,快速筛选高活性杂交瘤细胞奠定基础。
1 材料与方法
1.1 细胞、病毒及实验动物 Vero 81 细胞和骨髓瘤细胞SP2/0 由本实验室保存;PEDV(CH/JX/01 株)由本实验室分离并保存;SPF级6周龄~8周龄BALB/c雌鼠购自湖南斯莱克景达实验动物有限公司。
1.2 主要试剂 大肠杆菌TOP10、BL21(DE3)感受态细胞和TMB 单组分显色液购自北京天根生化科技有限公司;核酸提取试剂盒RNAiso Plus、MMLV Reverse Transcriptase 和pCold I 表达载体均购自大连宝生物工程有限公司;Gel Extraction Kit 购自OMEGA公司;IPTG 购自生工生物工程(上海)股份有限公司;镍离子金属鳌合层析介质(Ni-NTA)重力预装柱购自北京博奥龙免疫技术有限公司;HRP 标记羊抗鼠IgG 购自北京全式金生物技术有限公司;极超敏ECL 化学发光试剂盒购自碧云天生物技术有限公司;HAT/HT 培养基、PEG1450(50%)、弗氏完全佐剂和弗氏不完全佐剂均购自Sigma 公司;RPMI-1640培养基和胎牛血清购自Thermo Fisher 公司。偶联剂Oleyl-PEG4000-NHS、FITC 标记羊抗鼠IgG 和半固体培养基均为暨南大学唐勇教授惠赠。
1.3 引物设计与合成 根据GenBank 中PEDV CH/JX/01 株基因序列(KX058032.1)设计针对N 基因的特异性引物,N-F:5'-GGGGTACCATGGCTTCTGTCA GTTTTCAGG-3'(下划线为KpnⅠ酶切位点)/N-R:5'-CGGGATCCTTAATTTCCTGTATCGAAGATCTCG-3'(下划线为BamHⅠ酶切位点),预期扩增目的片段为1 326 bp,由上海生工生物工程技术服务有限公司合成。
1.4 PEDV N 蛋白的克隆、表达及纯化 利用TRIzol 法提取PEDV 基因组RNA,反转录为cDNA,利用设计的引物N-F/N-R,扩增其N 基因,PCR 产物经0.5%琼脂糖凝胶电泳检测,回收目的片段。使用限制性内切酶KpnⅠ和BamHⅠ对纯化的目的产物与载体pCold I 分别双酶切,回收酶切产物后构建重组表达质粒pCold I-N,并由上海生工生物工程有限公司测序鉴定。测序正确的重组质粒pCold I-N 转化至大肠杆菌BL21(DE3),加入终浓度为1 mmol/L 的IPTG 在16 ℃诱导表达24 h,超声破碎菌液后SDSPAGE 检测重组蛋白的表达。参照镍离子金属鳌合层析介质(Ni-NTA)重力预装柱说明,将重组蛋白加入镍柱,依次用20 mmol/L、50 mmol/L 和300 mmol/L咪唑缓冲液处理,分管收集洗脱液,通过SDSPAGE 检测纯化效果。
1.5 抗PEDV N 蛋白MAb 的制备
1.5.1 动物免疫和细胞融合 取纯化的PEDV N 重组蛋白与等量弗氏完全佐剂乳化后,分点注射于6周龄~8 周龄BALB/c 雌鼠背部皮内,200 μg/只;间隔两周后将PEDV N 重组蛋白与等量弗氏不完全佐剂乳化后注射于小鼠背部皮下,100 μg/只,两周后加强免疫一次。用倍比稀释(1∶100~1∶409 600)的小鼠血清作为一抗,1∶2 000 稀释的羊抗鼠HRP-IgG作为二抗进行间接ELISA,测定3 免第7 d 小鼠血清,选择对应血清效价最高的小鼠,融合前3 d 经腹腔接种不加佐剂的重组N 蛋白(100 μg)。随后分离其脾细胞与对数生长期SP2/0 细胞以1∶10 比例混合,加入PEG1450(50%)诱导融合。
1.5.2 CSFIA筛选分泌抗PEDV N蛋白MAb的杂交瘤细胞株 稀释杂交瘤细胞至48 孔细胞板中培养4 d~6 d,即可开始筛选。将1 mg 偶联剂Oleyl-PEG4000-NHS 与0.58 mg PEDV N 重组蛋白混合,冰浴搅拌3 h~6 h,确保偶联剂与PEDV N 重组蛋白充分结合。使用10 k 规格超滤管超滤混合物,去除多余偶联剂,经0.22 μm 滤膜过滤除菌。取250 μL 滤过液和50 μL FITC 标记的羊抗鼠IgG 加入不完全培养基中,完全混匀。将培养杂交瘤细胞的48 孔细胞板的上清吸去,加入不完全培养基轻轻摇晃,吸净上清,再重复上述步骤2 次,去除细胞板孔内残余的血清。将上述滤过液和FITC 标记的羊抗鼠IgG 的混合液加入培养杂交瘤细胞的培养板底部,置37 ℃5%CO2培养1 h。吸净上清,加入150 μL 不完全培养基置于荧光显微镜下观察,吸净不完全培养基并加入200 μL 半固体培养基固定细胞,通过移液枪吸取阳性细胞团块加入至新细胞板中继续培养。
1.5.3 间接ELISA 法筛选分泌抗PEDV N 蛋白MAb的杂交瘤细胞 杂交瘤细胞培养10 d~12 d 即可开始检测阳性孔。根据常规方法建立间接ELISA 法[9]:用5 μg/mL 纯 化PEDV N 重 组 蛋 白 包 被ELISA 板,1∶400 稀释阴、阳性血清作为阴、阳性对照,1∶2 000 稀释的FITC 标记的羊抗鼠IgG 为二抗,同时设不加血清的空白对照。利用该间接ELISA 法测定杂交瘤细胞上清液的OD450nm。采用有限稀释法,挑选长势较好、OD450nm值较高、细胞团单一的杂交瘤细胞10 倍倍比稀释(101~104),每个稀释浓度的杂交瘤细胞铺半块96 孔板培养。按照上述步骤再连续进行两次亚克隆筛选阳性杂交瘤细胞。
1.5.4 两种方法筛选的MAb 的效价测定 选取10周龄左右的BALB/c 雌鼠将上述两种方法筛选获得的单克隆细胞株以相同的细胞数量通过常规方法制备腹水[10]。将杂交瘤细胞上清液与制备的小鼠腹水10倍倍比稀释(102~109),同时以阴性血清作为阴性对照,采用1.5.3 建立的间接ELISA 法测定两种方法筛选的MAb 上清液与小鼠腹水效价。
1.6 两种方法筛选的MAb 的反应原性检测 将PEDV 感染Vero 81 细胞后,收集上清,超速离心后获得纯化的PEDV。将纯化的PEDV N 重组蛋白与PEDV 全病毒进行SDS-PAGE 检测,同时以空载体pCold I 和Vero 81 细胞为阴性对照,转移至聚偏二氟乙烯(PVDF)膜,5%脱脂乳封闭2 h 后,分别以两种方法筛选的MAb(1∶200)为一抗,HRP 标记羊抗鼠IgG(1∶2 500)为二抗,检测两种方法筛选的MAb 的反应原性。
2 结 果
2.1 PEDV N 蛋白的克隆、表达和纯化 RT-PCR扩增获得PEDV N 基因片段,克隆于pCold I 中,构建重组质粒pCold I-N,转化至BL21/DE3,原核表达PEDV N 重组蛋白,SDS-PAGE 检测结果显示pCold IN/DE3 在58 ku 处有目的条带,与预期大小相符(图1),表明PEDV N重组蛋白正确表达,经Ni-NTA纯化后获得较高纯度的重组蛋白。
2.2 CSFIA 筛选分泌抗PEDV N 蛋白的杂交瘤细胞株 偶联剂Oleyl-PEG4000-NHS 和纯化的PEDV N 重组蛋白结合,形成新偶联产物Oleyl-PEG4000-NHSPEDV N,加入FITC 标记的羊抗鼠IgG 和不完全培养基,完全混合后铺满接种了杂交瘤细胞的48 孔板中,孵育1 h 后置于荧光显微镜下观察。基于CSFIA筛选的杂交瘤细胞分泌特异性抗体效价与荧光发光强度呈正相关的特点[11],根据细胞状态,选取荧光强度最强,细胞克隆单一,生长趋势最好的杂交瘤细胞进行标记。采用半固体培养基固定杂交瘤细胞,挑选标记好的阳性克隆扩大培养。结果显示阳性杂交瘤细胞发出明显的绿色荧光信号(图2),通过该方法获得一株杂交瘤细胞,其分泌的MAb 命名为1B1,完成筛选和扩大培养所需时间为15 d,无需常规亚克隆步骤。

图1 PEDV N 重组蛋白的SDS-PAGE 检测结果Fig.1 SDS-PAGE analysis of recombinant PEDV N proteins

图2 CSFIA 对杂交瘤细胞的筛选结果(200×)Fig.2 Result of cell surface-fluorescence immunosorbent assay(200×magnification)
2.3 间接ELISA 法筛选分泌抗PEDV N 蛋白的杂交瘤细胞株 采用常规间接ELISA 法连续3 轮亚克隆筛选,获得一株长势最好、效价最高且稳定分泌抗体的杂交瘤细胞株,其分泌的MAb 命名为3D3,亚克隆筛选耗费的时间为45 d。表明3 轮亚克隆筛选虽然能够得到杂交瘤细胞株,但筛选过程繁琐,耗时较长。
2.4 两种筛选方法获得的MAb 效价测定结果 将分泌MAb 1B1 和3D3 的杂交瘤细胞株分别注射入小鼠腹腔诱生腹水,采用间接ELISA 法检测杂交瘤细胞株制备的腹水以及细胞上清中的MAb 效价。结果显示分泌1B1 的细胞株产生的腹水效价大于106,细胞上清效价大于104;分泌3D3 细胞株产生的腹水效价大于105,细胞上清效价大于103(图3),表明经CSFIA 法筛选获得的MAb 1B1 的效价比常规间接ELISA 筛选获得的MAb 3D3 效价高,且高出10 倍。

图3 分泌1B1(A)和3D3(B)的杂交瘤细胞株产生腹水和细胞上清中MAb 效价测定结果Fig.3 Antibody titers of the ascitic fluid and supernatant of hybridoma clones secreting 1B1(A)and 3D3(B)
2.5 两种方法获得的MAb 反应原性的检测结果通过western blot 对制备的MAb 进行反应原性检测,结果显示MAb 1B1 和3D3 与PEDV 全病毒以及PEDV N 重组蛋白均能反应,与Vero 81 细胞和载体蛋白均不反应(图4),表明本研究中CSFIA 法和间接ELISA法筛选的杂交瘤细胞株分泌的MAb 1B1 和3D3 均具有良好的反应原性。
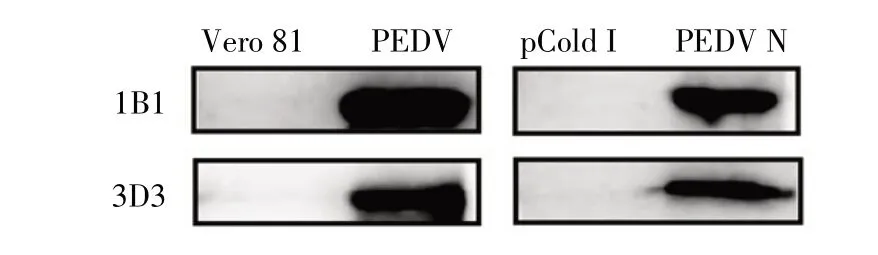
图4 两种方法筛选获得的MAb 反应原性的western blot 检测结果Fig.4 Reactivity analysis of the screened MAbs using two methods by western blot
3 讨 论
ELISA 方法与有限稀释法是迄今应用最广泛的杂交瘤细胞筛选方法[12]。其中,间接ELISA 用于阳性杂交瘤细胞的筛选,有限稀释法对获得的阳性杂交瘤细胞进行亚克隆,至少需要连续进行3 次上述过程才能获得稳定分泌MAb 的杂交瘤细胞株,操作步骤繁琐费时[13]。研究显示,利用流式细胞仪分选技术能够快速获得目的杂交瘤细胞,标记抗原与分泌于细胞表面的特异性抗体结合后,流式细胞仪分选携带标记抗原的阳性杂交瘤细胞,可在短时间内获取分泌特异性抗体的杂交瘤细胞[14]。此方法具有快速、通量高的特点,但前期需优化杂交瘤细胞分选条件,且所得细胞量较低,后续还要进行测序和表达等工作[15]。此外,半固体培养基方法替代有限稀释法筛选杂交瘤细胞,虽省去稀释等步骤,但其无法准确挑出阳性单克隆细胞团,工作量仍然很大[6]。
2004 年Kato 等发明了哺乳动物细胞膜锚定方法,可以将大分子蛋白质非特异性锚定在细胞膜表面,即利用油烯基衍生物与聚乙二醇90(PEG90)制备Oleyl-PEG90 锚定子,油烯基对细胞膜表面脂质具有亲和性,PEG则能够增加锚定子的亲水性及偶合目的蛋白,从而将目的蛋白锚定于细胞膜表面[16]。在上述研究的基础上,暨南大学唐勇团队研发了CSFIA技术,利用Oleyl-PEG4000 锚定子与抗原蛋白偶合后形成Oleyl-PEG4000-抗原,Oleyl 端非特异性亲和于细胞表面,当杂交瘤细胞分泌抗体时能够被细胞表面抗原捕获,而加入的荧光标记二抗则结合被捕获的抗体,最后通过半固体培养基固定并在荧光显微镜下挑取分泌特异性MAb 的杂交瘤细胞[8]。CSFIA法可以实现一步挑取目的细胞,基于荧光选择分泌MAb 的杂交瘤单细胞株,具有直观、简单、快速、高效的优点,无需流式细胞仪等昂贵的仪器辅助。
常规ELISA 检测杂交瘤细胞培养上清OD 值能够反映抗体效价,但操作步骤较为繁琐;并且强阳性杂交瘤可能在亚克隆过程中因细胞株间的相互竞争或有限稀释而导致丢失[8]。而采用CSFIA 法时,Oleyl-PEG4000-抗原与细胞膜之间距离仅38 nm,杂交瘤细胞新分泌的MAb 能够迅速被捕获,而置于杂交瘤细胞表面;灵敏度高,单个细胞分泌抗体的检测极限可达11.7 fg,可以在早期对杂交瘤株进行鉴定,极大缩短培养时间[11]。而且,阳性细胞表面荧光强度与抗体效价及特异性相关[11],因此,在荧光显微镜下直接观察并挑选出长势最好、效价最高的杂交瘤细胞能够作为制备MAb 杂交瘤细胞的候选株。但目前,CSFIA 法只能通过移液管获得标记目的细胞,尚未实现自动化操作,不利于MAb 高通量筛选[8]。
现阶段,应用CSFIA 法开展靶向动物病原MAb杂交瘤细胞株筛选的报道较少,本研究尝试将该新方法用于PEDV N 蛋白MAb 制备,快速筛选阳性杂交瘤单细胞株。从结果来看,间接ELISA 方法连续3 轮筛选单个杂交瘤细胞株需要45 d,而使用CSFIA筛选过程仅需15 d;将CSFIA 筛选的分泌1B1 的杂交瘤细胞扩大培养后,与间接ELISA 法筛选的分泌3D3 细胞株同时以相同细胞数量接种于小鼠腹腔,比较腹水中抗体效价发现,1B1 的效价明显高于3D3。因此,上述研究表明CSFIA 技术可以用于快速制备高效价MAb,尤其在高活性杂交瘤细胞筛选中的实用性优势更明显,未来对于动物疾病检测试剂甚至治疗药物研发等方面均具有较高的应用价值和广阔的市场前景。
