Ⅰ型胶原及骨膜蛋白在骨质疏松大鼠骨髓基质细胞膜片中的表达研究*
2022-12-05李丽生何梦娇骆凯何武兵
李丽生 何梦娇 骆凯 何武兵
当前,我国中老年人骨质疏松问题严重,其中以绝经后骨质疏松症(postmenopausal osteoporosis,PMO)最为常见[1]。PMO通常是由于绝经后卵巢功能衰退,雌激素水平下降,从而导致的一种低骨量性疾病,骨脆性增加,在没有创伤外力作用的情况下亦会发生严重骨折,严重危害中老年人的身体健康,同时也给社会带来了一定的经济负担。因此,PMO的防治至关重要。在骨质疏松症(osteoporosis,OP)研究中,细胞疗法作为一种全新的治疗方法近几年被广泛研究,当前的主要研究热点之一是以间充质干细胞(mesenchymal stem cells,MSCs)为主的细胞疗法。与传统的酶消化法相比,细胞膜片技术(cell sheet technology,CST)可以无创性获取种子细胞,同时还保留完整的细胞外基质(extracellular matrix,ECM)、细胞间连接及细胞表面相关蛋白[2]。因此,与传统的组织工程相比,骨髓基质细胞(bone marrow stromal cell,BMSC)膜片在骨和软骨组织工程中具有良好的应用前景[3]。本研究通过L-抗坏血酸诱导构建不同时间点的PMO大鼠BMSC膜片,并检测其ECM中的Ⅰ型胶原(collagen-Ⅰ,Col-Ⅰ)及骨膜蛋白(periostin,POSTN)的表达,为骨质疏松状态下骨组织再生寻找新的途径与技术,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 2017年1月-2018年12月,20只SPF级3月龄雌性未孕SD大鼠,体重250~280 g,由上海SLAC实验动物有限公司提供,实验动物生产许可证号:SCXK(沪)2017-0005,实验动物使用许可证号:SYXK(闽)2016-0006。
1.1.2 主要试剂与仪器 DMEM(美国Hyclone公司),胎牛血清(FBS;澳大利亚Wisent公司),苏木精、伊红、L-抗坏血酸、β-甘油磷酸钠、地塞米松(美国Sigma公司);成脂诱导分化试剂盒(中国 Cyagen 生物),Trizol Reagent(美国 Invitrogen公 司 );SYBR®Premix Ex Taq™(Tli RNaseH Plus)(日本Takara公司),兔抗大鼠Col-Ⅰ多克隆抗体、兔抗大鼠POSTN多克隆抗体(美国Abcam公司),Masson三色染色试剂盒、即用型免疫组化EliVisionTM plus试剂盒、DAB显色试剂盒(福州迈新生物技术开发有限公司),HRP标记的羊抗兔二抗IgG(中国Biosharp公司);倒置荧光显微镜(IX-71,日本Olympus公司);实时荧光定量PCR仪(LightCycler480,瑞士Roche公司)。
1.2 方法
1.2.1 PMO大鼠BMSCs的体外分离培养 采用去势法建立骨质疏松大鼠模型,术后12周体外分离培养PMO大鼠BMSCs。腹腔注射麻醉下取出大鼠下肢管状长骨,反复冲洗收集骨髓腔冲洗液,室温下 1 000 r/min 离心 5 min,DMEM 低糖培养液(含10% FBS、青霉素 100 U/ml、链霉素 100 μg/ml)重悬并吹打混匀、常规培养。
1.2.2 PMO大鼠BMSCs的鉴定 原代BMSCs细胞悬液接种于培养皿,12 d后进行结晶紫染色,并进行细胞克隆计数、拍照。第3代BMSCs按5×104/个孔接种于12孔板,待细胞融合至70%~80%时,分别更换为成骨诱导液及成脂诱导液。成骨诱导7 d后进行碱性磷酸酶(alkaline phosphatase,ALP)染色,21 d后采用茜素红染色(alizarin red,AR)观察矿化结节;成脂诱导21 d后成脂诱导组采用油红O染色观察脂滴。
1.2.3 PMO大鼠BMSC膜片的体外构建 第3代BMSCs按5×104/孔密度接种于12孔板,待细胞融合至 70%~80% 时,更换为含 50 μg/ml L- 抗坏血酸的培养液,每3天更换培养液,诱导10 d形成细胞膜片。
1.2.4 PMO大鼠BMSC膜片的组织学观察 L-抗坏血酸连续诱导培养5、10 d刮取细胞膜片。固定,常规脱水,透明,浸蜡,包埋,连续切片,备用。苏木素-伊红(hematoxylin-eosin,HE)染色及Masson染色观察5、10 d的细胞膜片结构,显微镜下观察并拍照。
1.2.5 PMO大鼠BMSC膜片Col-Ⅰ及POSTN基因表达检测 第3代BMSCs按5×104/孔密度接种于12孔板,待细胞融合至70%~80%时,更换为含50 μg/ml L-抗坏血酸的培养液,分别于诱导的第5、10天按试剂盒说明书提取两组细胞的总RNA,检测RNA浓度及纯度,按试剂盒说明书进行逆转录,实时荧光定量PCR法检测Col-Ⅰ和POSTN的表达,用2-ΔΔCT方法计算相对表达量。引物序列,见表1。

表1 qRT-PCR引物序列
1.2.6 PMO大鼠BMSC膜片Col-Ⅰ及POSTN蛋白表达检测 石蜡切片常规脱蜡和水化,滴加3%过氧化氢后,滴加兔抗鼠Col-Ⅰ(1∶500)、兔抗鼠POSTN(1∶900),阴性对照组加 PBS,4 ℃湿盒内孵育过夜,辣根酶标记抗兔IgG聚合物试剂37 ℃孵育20 min,DAB显色、苏木素复染、脱水,透明、中性树胶封固。
1.3 统计学处理
采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(±s)表示,两组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PMO大鼠BMSCs的体外分离培养
原代培养(P0)3 d,显微镜下可见光亮的圆形细胞下散在的少量梭形细胞贴壁,见图1A;P0培养7 d,梭形细胞快速生长,纤维集落样排列;P0培养12~14 d,相邻集落达到80%融合并进行传代,见图1B。传代培养后第三代(P3)细胞增殖加速,形状为多角形或梭形,见图1C。
2.2 PMO大鼠BMSCs的鉴定
第1代细胞接种培养12 d左右,结晶紫染色后,肉眼观察到紫色克隆集落,显微镜下见单细胞形成的克隆呈集落生长,见图2A、B。成骨诱导第7天,ALP染色后胞质内见深蓝色物质(不溶性),见图2C。成骨诱导第21天,AR染色可见红染的矿化结节大小不一,见图2D。成脂诱导第21天,空泡样脂滴采用油红O染色后被染成橘红色,见图2E。
2.3 PMO大鼠BMSC膜片的大体观察
经L-抗坏血酸连续诱导10 d左右,细胞膜片的边缘开始皱缩卷曲,孔板底部可见一乳白色半透明的膜状结构,见图3A;从卷曲处小心刮起,漂浮于PBS中,见图3B;完整刮起后细胞膜片明显收缩,色呈乳白色,微薄磨玻璃样半透明结构,见图3C,可塑性较强。
2.4 PMO大鼠BMSC膜片的组织学观察
细胞膜片HE染色结果显示,第10天形成的细胞膜片厚度增加,细胞层数增多,ECM厚度也由第5天的20 μm左右增厚至50 μm左右。Masson染色结果显示,随着诱导时间增加,细胞间蓝色胶原纤维明显增多,见图4。
2.5 PMO大鼠BMSC膜片Col-Ⅰ及POSTN基因表达检测
诱导第10天细胞膜片的ECM相关基因Col-Ⅰ及POSTN mRNA相对表达量均高于第5天,差异均有统计学意义(P<0.05),见表2。
表2 PMO大鼠BMSC膜片Col-Ⅰ、POSTN mRNA相对表达量比较(±s)
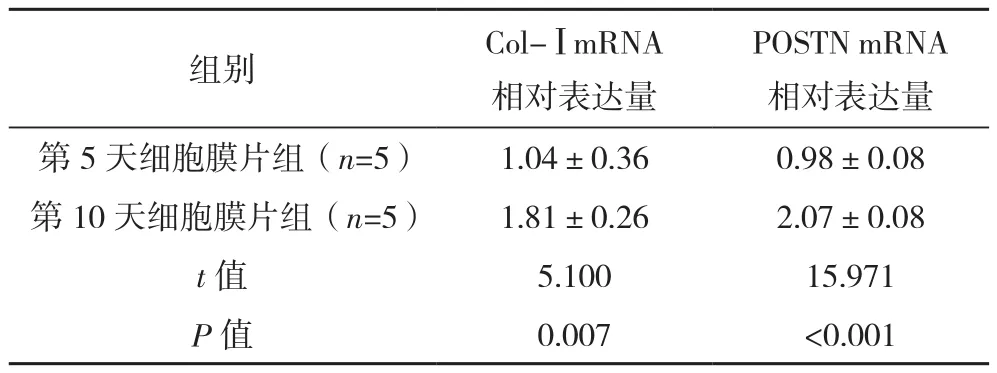
表2 PMO大鼠BMSC膜片Col-Ⅰ、POSTN mRNA相对表达量比较(±s)
注:qPCR实验中,采用5只骨质疏松大鼠,每只大鼠分离培养的BMSCs分别诱导形成5 d细胞膜片组、10 d细胞膜片组,两分组各得到5组数据进行分析。
组别 Col-ⅠmRNA相对表达量POSTN mRNA相对表达量第5天细胞膜片组(n=5) 1.04±0.36 0.98±0.08第10天细胞膜片组(n=5) 1.81±0.26 2.07±0.08 t值 5.100 15.971 P值 0.007 <0.001
2.6 PMO大鼠BMSC细胞膜片Col-Ⅰ及POSTN蛋白表达检测
免疫组织化学染色结果显示,第5天左右刮取的细胞膜片厚度较薄,但仍有表达Col-Ⅰ和POSTN。而诱导第10天刮取的细胞膜片,与第5天组相比,强表达ECM相关蛋白Col-Ⅰ和POSTN,并且厚度增厚,连续性较为完整,见图5。
3 讨论
OP是由诸多病因引起的以骨密度及骨量减少、骨小梁结构破坏为特征的骨代谢疾病,常引起桡骨远端、肱骨近端、脊椎体、股骨颈骨折,严重影响中老年人,特别是中老年绝经后女性的生活质量[4]。PMO主要是由绝经后雌激素缺乏引起的骨代谢失调,破骨细胞的骨吸收大于成骨细胞的骨形成作用。目前,PMO治疗多采用抗骨吸收药物(如双磷酸盐)和促进钙盐沉积(如鲑鱼降钙素)改善和缓解PMO的症状,但药物的不良反应(如胃肠道、心血管方面的副作用)和其本身并不能促进骨量再生的局限性限制了其在临床上的应用[5]。因此寻找PMO治疗的新方法,促进骨组织再生成为当前研究热点之一。
MSCs具有自我增殖、多向分化能力,已有相关研究证实其与OP的进展密切相关。近几十年来,MSCs广泛应用于再生医学研究中,为骨和关节疾病的治疗提供新的方法和思路。MSCs在OP治疗中应用前景广泛。伴随机体的衰老,人体中的BMSCs含量降低,成脂分化大于成骨分化,加速OP的进展[6]。多项研究表明,BMSCs移植可能是预防或治疗雌激素缺乏和老年性骨质疏松症的可行方法[7-9]。本研究获取的PMO大鼠BMSCs具有增殖、克隆形成及成骨、成脂分化能力,可作为种子细胞应用于后续的研究中。
细胞膜片是一种富含ECM的细胞片状聚集,保留了内源性ECM、受体和黏附蛋白,增强了细胞的活力和交流,允许自发地黏附到生物材料和生物表面[10]。当前,构建细胞膜片的方法有:温度反应系统、磁反应系统、机械系统、光反应系统等[2]。其中,温度反应系统和机械系统是骨和软骨再生中制备细胞膜片应用最广泛的方法。机械系统通过添加 L-抗坏血酸刺激细胞分泌大量的ECM,连续培养从而形成细胞膜片,是制备细胞膜片最简单的方法[11]。在骨和软骨组织工程中,BMSC细胞膜片被广泛研究,表现出良好的应用前景。Ma等[12]将机械法制备的兔BMSC细胞膜片移植到裸鼠皮下,结果显示BMSC细胞膜片无须支架材料也具有异位成骨的潜能。随着研究的深入,研究者发现机械法制备成骨诱导后的BMSC细胞膜片可促进骨缺损部位的骨再生[13]。骨折愈合包括最初的炎症反应,随后的骨痂形成以及最后的骨骼改建,最终恢复骨的结构与功能。然而,在某些情况下,由于复杂的因素,如生物或机械环境的破坏,可能会出现骨质生长缓慢乃至不生长的情况。一系列研究表明BMSC成骨诱导细胞膜片可增强骨折部位的骨形成,改善骨愈合延迟,并形成稳定的新生骨[14-15]。此外,由于细胞膜片可操作性不佳,无法起到骨支撑作用,因此,可以通过在支架材料上复合细胞膜片来修复骨缺损,发挥各自的优势。BMSC细胞膜片包裹多孔的磷酸三钙β-TCP/Col-Ⅰ复合支架,经过成骨诱导后植入裸鼠体内,表现出良好的成骨能力[16]。除了β-TCP支架外,聚(癸二酰基二甘油酯)(PSeD)及聚乳酸羟基乙酸共聚物(PLGA)复合细胞膜片亦可促进骨缺损部位的骨再生[17-18]。
目前细胞膜片技术在骨质疏松状态下骨组织修复与再生的相关研究较少,本研究采用机械系统制备PMO大鼠BMSC细胞膜片,无须特定的培养基质或技术,连续诱导10 d左右即可用细胞刮刀刮取完整的细胞膜片,所获得的细胞膜片可塑性良好。HE、Masson染色结果提示诱导时间延长,细胞膜片中细胞层数增加,ECM增多,膜片增厚。
ECM是一种动态变化的微环境,是由细胞分泌到细胞外间质中的大分子所构成的非细胞三维结构,在为细胞提供结构支持及附着位点和调节细胞的生物学功能中均有优势,参与组织的修复和再生。胶原蛋白是ECM的主要结构成分,其中最丰富的胶原蛋白类型是Ⅰ型,Col-Ⅰ是皮肤、骨骼运动系统相关组织完整性的主要构架成分,同时参与细胞增殖、分化、信号传递等功能[19]。POSTN是一种分泌型细胞外基质蛋白,通过胞膜受体调节细胞黏附、增殖及分化,参与ECM组装。POSTN调节ECM的交联和稳定,包括胶原蛋白的纤维化,为细胞外基质蛋白(Col-Ⅰ、纤维连接蛋白、腱糖蛋白-C和层粘连蛋白γ2)和辅助蛋白(骨形成蛋白-1和CCN3)的组装提供支架,是ECM复杂结构的基础[20]。POSTN可通过NF-κB信号通路调节Cbfa-1和RANKL表达,调节骨代谢平衡[21]。本研究从基因及蛋白水平检测PMO大鼠BMSC膜片不同时间点Col-Ⅰ、POSTN的分泌情况,结果提示骨质疏松状态下的BMSCs仍然具有较强的细胞功能,保留的分泌ECM能力使形成的细胞膜片可塑性较强,生物学功能稳定,自身分泌的ECM是骨组织再生和修复的结构基础和天然支架,为自体移植促进骨质疏松状态下骨组织再生提供实验依据。
综上所述,本研究构建的PMO大鼠BMSC细胞膜片可保留自身分泌的ECM,为后续自体移植细胞膜片实现骨质疏松状态下骨组织再生提供帮助,但是其物理性能、体内成骨能力及骨再生作用机制有待后续实验探讨。
