C端柔性区域对多糖降解菌来源的麦芽五糖生成酶冷适性的调控
2022-11-30李才明班宵逢顾正彪李兆丰
丁 宁, 李才明,2,3, 班宵逢,2,3, 顾正彪*,2,3, 李兆丰*,2,3
(1.江南大学 食品学院,江苏 无锡 214122;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;3.江南大学 食品安全与质量控制协同创新中心,江苏 无锡 214122)
地球的自然生态系统中存在诸多极端环境,能够在极端环境下正常生长代谢的微生物被称为极端微生物,其中,在海洋深处、极地和陆地高寒带等低温环境生长的微生物被称为低温微生物。低温微生物通常具有与常温微生物不同的生理机制,其中包括分泌的酶类具有较强的低温催化能力,这类酶被称为冷适酶[1-2]。对冷适酶进行研究,一方面能够拓宽酶的应用范围,一定程度上填补工业用酶的缺口;另一方面,冷适酶的分子结构通常具有特殊性,因此,发现并总结冷适酶的结构与功能关系,可以为生物学研究提供宝贵信息[3-4]。
麦芽五糖(maltopentaose,G5)是由5个葡萄糖单元以α-1,4糖苷键连接而成的低聚糖,因其甜度较低,在维持血糖平衡和改善肠道内环境中发挥重要作用,同时作为营养助剂和诊断试剂被广泛应用于食品和医药领域,因此G5的合成具有较高的研究和应用价值[5-8]。G5主要采用酶法生产,即利用麦芽 五 糖 生 成 酶 (maltopentaose-forming amylase,G5A,EC 3.2.1.X)选择性地水解淀粉中特定的α-1,4糖苷键,生成以G5为主的麦芽低聚糖混合物。目前,已报道的G5A的最适反应温度为60~93℃[9-11],在室温或低温下催化效率极低。然而,长时间加热可能引起G5的颜色等物理性质发生变化,并且降低G5的营养性[12];同时,高温生产会引起大量能源消耗和温室气体排放。因此,冷适G5A的开发对于高效、绿色生产高品质的G5起到至关重要的作用[6]。
前期研究表明,海洋微生物多糖降解菌Saccharophagus degradans能够分泌两种不同相对分子 质 量 的G5As(SdG5A和SdG5A-CD),位 于SdG5A C端的淀粉结合域(starch-binding domain,SBD)可能发生降解,形成SdG5A-CD。为了探究SdG5A和SdG5A-CD的冷适性,作者分别将其表达于枯草芽孢杆菌Bacillus subtilis WB600中,并对重组SdG5A和重组SdG5A-CD进行分离纯化。以水解活力和G5得率为指标,分析其在低温下的催化能力。随后,利用RoseTTAFold预测SdG5A的结构模型,并在此基础上通过结构分析和分子动力学模拟(molecular dynamics simulations,MD)等生物信息学手段,阐明SdG5A分子柔性与酶冷适性之间的关系。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒和菌株pST质粒、Escherichia coli JM109克隆菌株保存于作者所在实验室;B.subtilis WB600感受态细胞由江南大学粮食发酵与食品生物制造国家工程研究中心馈赠。
1.1.2 主要试剂与材料高保真DNA聚合酶Phanta Max、重组克隆试剂盒:南京诺唯赞生物科技股份有限公司产品;Phenyl Superose HR 10/10疏水柱:美国Amersham Biosciences公司产品;Superdex 75 10/300凝胶柱:瑞典GE Healthcare Biosciences公司产品;CarboPacTMPA200碳水化合物分析柱:美国Dionex公司产品;麦芽低聚糖标准品:日本Hayashibara生物化学研究所提供。
1.1.3 主要仪器AKTA Prime Plus蛋白质纯化系统:美国GE公司产品;高效阴离子交换色谱(highperformance anion-exchange chromatographic,HPAEC)仪、脉冲电流检测器(pulsed amperometrydetector,PAD):美国Thermo Scientific公司产品。
1.1.4 培养基LB培养基:胰蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L,pH 7.0;固体培养基再添加1.5 g/dL琼脂粉。发酵培养基:酵母粉36 g/L、麦芽糊精5 g/L,pH 6.0。
1.2 实验方法
1.2.1 表达载体sdg5a/pST和sdg5a-cd/pST的构建SdG5A编 码 基 因sdg5a(GenBank accession:AIV43244.1)和相关引物由苏州金唯智生物科技有限公司合成。利用聚合酶链式反应(polymerase chain reaction,PCR)扩增sdg5a、sdg5a-cd和pST质粒基因片段,引物序列见表1。

表1 构建sdg5a/pST和sdg5a-cd/pST表达载体的引物设计Table 1 Primers used for the construction of sdg5a/pST and sdg5a-cd/pST plasmid
PCR完成后,分别在两个基因片段中加入1 μL限制性内切酶Dpn I,于37℃酶切4 h,消化模板质粒,并进行切胶回收。参考重组克隆试剂盒说明书,完成片段的拼接,得到sdg5a/pST和sdg5a-cd/pST表达载体。
1.2.2 Bacillus subtilis WB600感受态细胞的转化取10 μL sdg5a/pST和sdg5a-cd/pST质粒,分别加入至B.subtilis WB600超级感受态细胞(100 μL)中,于37℃摇床(200 r/min)中培养2 h,涂布于含有终质量浓度10 μg/mL卡那霉素的LB固体培养基,37℃培养过夜。挑取单菌落即为基因工程菌sdg5a/pST/B.subtilis WB600和sdg5a-cd/pST/B.subtilis WB600。
1.2.3 SdG5A和SdG5A-CD的生产和纯化挑取单菌落加入到装有5 mL LB培养基的15 mL聚丙烯圆底试管中,于37℃摇床(200 r/min)过夜培养。取2 mL活化菌液接种至含有50 mL发酵培养基的250 mL锥形瓶中,在25℃摇床(200 r/min)培养72 h。发酵结束后,将发酵液在4℃、10 000 r/min的条件下离心20 min,收集上清液即为重组SdG5A和SdG5A-CD粗酶液。LB培养基和发酵培养基中均添加终质量浓度为10 μg/mL的卡那霉素。
重组SdG5A和SdG5A-CD的纯化均采用疏水柱与凝胶柱相结合的方法。在使用疏水柱纯化时,首先用含有体积分数为20%(NH4)2SO4的缓冲液A(20 mmol/L磷酸盐缓冲液,pH 7.0)平衡疏水柱,上样后,分别用体积分数0~100%的缓冲液A(与超纯水混合)进行梯度洗脱,并最终用超纯水洗脱活性组分用于凝胶柱二步纯化。在使用凝胶柱纯化时,同样用缓冲液A平衡凝胶柱,并在上样后用超纯水洗脱,收集洗脱液的活性部分即为纯化重组SdG5A和SdG5A-CD。将纯酶液置于10 mmol/L磷酸盐缓冲液(pH 6.5)中,于4℃下透析过夜,并将纯酶分装保存于-80℃中。
1.2.4 水解活力的测定将每分钟生成1 μmol还原糖(以葡萄糖计)所需的酶量定义为1个酶活力单位(U)。还原糖的含量利用3,5-二硝基水杨酸法测定[13]。具体方法为用C6H8O7-Na2HPO4缓冲液(50 mmol/L,pH 6.5)配制1 g/dL的可溶性淀粉溶液,加热糊化。取900 μL底物加入100 μL适当稀释的酶液,分别于0、25、45℃下反应15 min后,加入1 mL 3,5-二硝基水杨酸试剂。在沸水浴中显色5 min,冷却后加入3 mL蒸馏水,在540 nm下测定吸光度。
1.2.5 水解产物分析配置10 g/dL的蜡质玉米淀粉作为底物,分别加入2 U/g重组SdG5A和SdG5A-CD,在25℃下反应48 h,每隔12 h取样,沸水浴30 min终止反应,离心(10 000 r/min)5 min,取上清液过0.22 μm水系超滤膜待测。利用HPAEC-PAD分析产物中各组分含量[6]。采用三元梯度程序进行洗脱(见表2),其中洗脱液A为0.25 mol/L氢氧化钠,洗脱液B为1.0 mol/L醋酸钠,洗脱液C为超纯水。流量为0.5 mL/min,柱温为30℃,进样量为10 μL,以糖四电位波形检测。
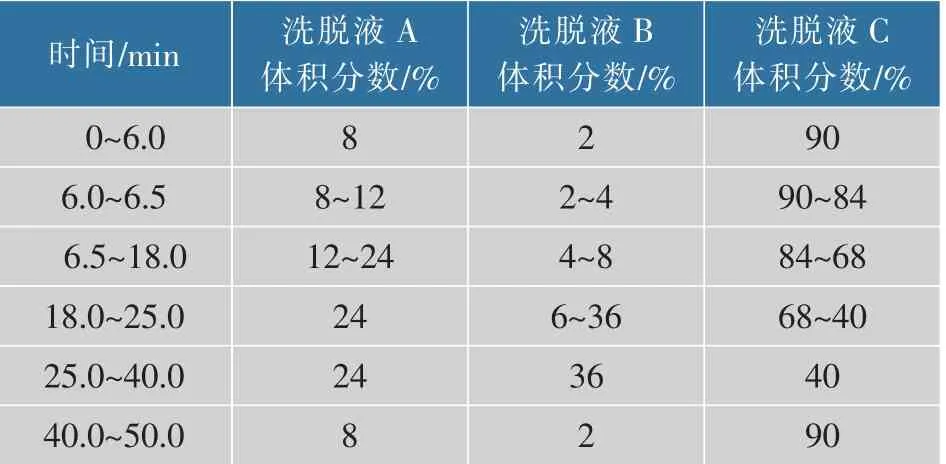
表2 HPAEC-PAD分离麦芽低聚糖的梯度洗脱程序Table 2 Gradient elution program for the separation of maltooligosaccharides using HPAEC-PAD
以葡萄糖、麦芽糖和麦芽低聚糖标准品为对照进行水解产物组分的定性和定量,淀粉转化率和G5比例的计算方法如下:

式中:Cs为淀粉转化率,%;m1为葡萄糖、麦芽糖、麦芽低聚糖总质量;m0为底物干基质量;RG5为G5比例,%;mG5为G5质量。
1.2.6 SdG5A的结构预测利用RoseTTAFold(https://robetta.bakerlab.org/)[14]和AlphaFold2[15]模拟SdG5A的空间结构。利用M-ZDock(https://zdock.umassmed.edu/m-zdock/)模拟SdG5A二聚体结构[16]。模拟结构的准确性和相似性利用ResQ(https://zhanglab.ccmb.med.umich.edu/ResQ/)计算TM-score进行评价[17]。蛋白质结构作图利用Pymol软件进行。
1.2.7 SdG5A的柔性分析利用ResQ在线分析工具(https://zhanggroup.org/ResQ/)分 析SdG5A的 温度因子(B-factor)和模型到自然态之间的距离(distance to native state,dn),并以此作为评价蛋白质静态柔性的依据[17]。利用MD计算SdG5A在不同温度下氨基酸残基的均方根涨落(root-mean-square fluctuation,RMSF)值,以此作为评价SdG5A动态柔性的指标。
利用Desmond软件进行MD,溶剂模型选择TIP3P,盒子为正交晶系,盒子大小设置为1 nm×1 nm×1 nm,角度α=90°、β=90°、χ=90°。添加Na+平衡电荷,选择OPLS4力场进行体系构建。选择NVT平衡,温度设置为0℃和45℃,每个体系的模拟时间为100 ns,收集1 000帧轨迹。
1.2.8 数据处理实验结果为3次平行实验的平均值,采用平均值±标准偏差表示。利用Prism 8 Student’s T-test分析两组间的显著性差异。当P<0.05时,认为组间差异具有统计学意义。
2 结果与讨论
2.1 Linker-SBD对SdG5A冷适性的影响
2.1.1 SdG5A和SdG5A-CD的 纯 化SdG5A与SdG5A-CD含有相同的催化域(Q1~A427),SdG5A在C端含有额外的SBD(V446~F542),位于N端的催化域与C端的SBD之间以linker(I428~K445)连接(见图1(a))。SdG5A和SdG5A-CD的理论相对分子质量分别为58 000和48 000。重组SdG5A和SdG5A-CD均采用疏水-凝胶两步法进行纯化,经十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)验证,所收集活性部分的相对分子质量与理论相对分子质量相同(见图1(b))。
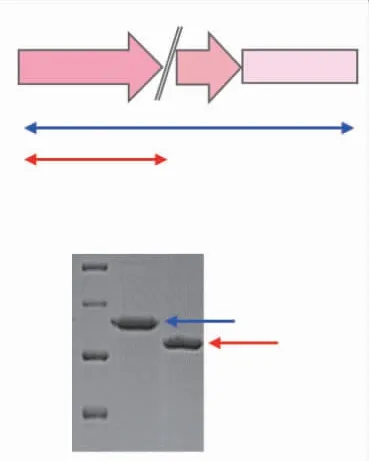
图1 SdG5A和SdG5A-CD的结构组成和SDS-PAGE分析Fig.1 Structural composition and SDS-PAGE analysis of SdG5A and SdG5A-CD
2.1.2 SdG5A和SdG5A-CD的冷适性为了评价SdG5A和SdG5A-CD的冷适性,分别测定了其在冰点(0℃)、室温(25℃)和最适反应温度(45℃)下的水解活力,结果如表3所示,SdG5A在0℃和25℃下可分别保持最高比活力27.8%和64.0%的水解活力,说明其具有较强的冷适性;而SdG5A-CD在0℃下的比活力仅为野生型的2.7%,在25℃下的比活力仅为45℃下的26.7%,说明linker-SBD结构的缺失导致SdG5A的冷适性大幅下降。来源于盐浮交替单胞菌(Alteromonas haloplanctis)A23的α-淀粉酶(AHA)是最早发现、目前研究最多的冷适α-淀粉酶,其最适温度为25℃,在0℃下的催化活力为最适温度下20%[18]。与AHA相比,SdG5A在0℃下的相对活力高于AHA,说明其具有良好的应用前景。
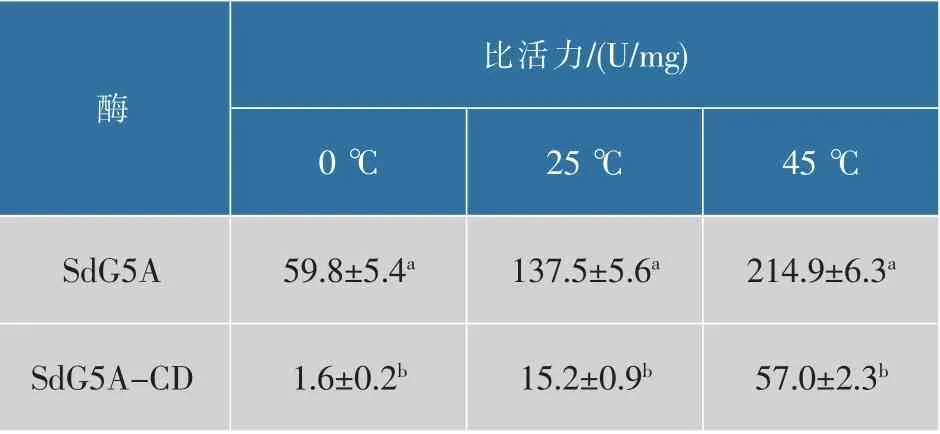
表3 SdG5A和SdG5A-CD在不同温度下的比活力Table 3 Specific activities of SdG5A and SdG5A-CD oct different temperature
为了探究SdG5A和SdG5A-CD在室温下制备G5的效率,评价其应用可行性,以10 g/dL的蜡质玉米淀粉为底物,在25℃下反应0~48 h,利用HPAEC-PAD分析水解产物,并计算淀粉转化率和G5比例,结果如图2所示。结果表明,当SdG5A与蜡质玉米淀粉反应24 h时,G5得率(G5比例与淀粉转化率的乘积)高达48.6%;然而当反应时间延长至48 h时,由于SdG5A发生了过度水解反应,产物中的G5被进一步降解为聚合度更低的小分子糖,导致G5得率降低(见图2(a))。相比之下,由于SdG5A-CD在25℃下的水解活力较低,并且产物特异性较差,其水解蜡质玉米淀粉生产G5的最高得率仅为SdG5A的9.5%,因此,SdG5A在室温下制备G5的效率更高。此前,韩煦利用巨大芽孢杆菌(B.megaterium)来源的G5A突变体水解20 g/dL的木薯淀粉,在40℃下反应36 h,可以获得的最高G5得率为39.0%[19]。相比而言,利用SdG5A制备G5不仅得率更高,同时反应在室温下进行,能够降低加热和冷却处理所引起的对产品和环境的不利影响,因此,SdG5A更适合用于G5的高效、绿色生产。
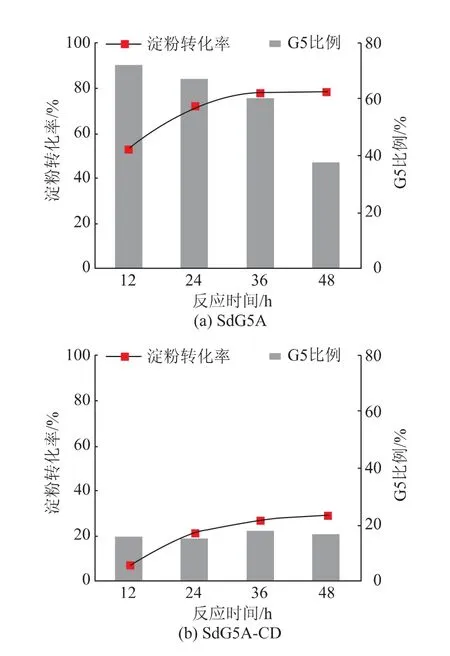
图2 SdG5A和SdG5A-CD在25℃下水解蜡质玉米淀粉生产G5的淀粉转化率和G5比例Fig.2 Conversion rate and ratio of G5 arising from the hydrolyzation of waxy corn starch at 25℃by SdG5A and SdG5A-CD
2.2 SdG5A的空间结构
相比于SdG5A-CD,SdG5A具有较强的冷适性,说明SdG5A的linker-SBD结构对调控其冷适性具有重要作用。为了加深对SdG5A冷适性机制的理解,需要进一步获取其结构信息。然而,目前对SdG5A晶体结构的获取难度较大。一方面,SdG5A与已报道的蛋白质的同源性均较低,这使其无法通过同源模型化的方法对结构进行解析和预测。在已报道序列的蛋白质中,SdG5A与来源于海洋微生物Marinagarivorans algicola的淀粉酶(GenBank accession WP_053982064)同源性最高,序列相似度为67%[6];在已报道晶体结构的蛋白质中,SdG5A与来源于Pseudoalteromonas haloplanktis的淀粉酶(PDB ID:1G9H)的同源性最高,序列相似度为51%,但该酶不存在SBD结构,因此无法为SdG5A完整结构的解析和预测提供依据。另一方面,由于SBD的柔性过大,在溶液中呈高度无序性,且结构不稳定,在蛋白质结晶过程中易发生降解,导致包括SdG5A在内的麦芽低聚糖生成酶均无法通过X射线衍射的方法获得含有SBD的完整结构信息[20-21]。2021年7月,谷歌Deepmind团队和华盛顿大学David Baker团队分别发布了新型蛋白质结构预测工具AlphaFold2和RoseTTAFold[14-15],该成果突破性地提高了蛋白质结构预测的准确性,同时也为本研究中获得SdG5A完整结构提供重要工具。
分 别 利 用RoseTTAFold和AlphaFold2对SdG5A的空间结构进行预测,结果如图3所示。利用ResQ计算单一结构的TM-score,可评价模拟结构的准确性,在0~1.00时,分值越高说明模拟结构越 准 确[17]。RoseTTAFold和AlphaFold2模 拟 的SdG5A结构的TM-score分别为0.71和0.65,说明RoseTTAFold模拟结构的准确性略高于AlphaFold2。利用ResQ同时计算两个结构的TMscore,可评价两个结构的相似性,若分值在0.50~1.00说明其具有相同的折叠方式[17]。RoseTTAFold与AlphaFold2模拟结构的TM-score为0.78,说明二者的相似度较高。尽管利用RoseTTAFold和AlphaFold2模拟得到的SdG5A结构中结构域内部的折叠基本相同,但SBD的空间位置却明显不同(见图3)。在RoseTTAFold模拟结构中,结构域的排列方式较为紧凑,SBD与催化位点相靠近;而在AlphaFold2模拟结构中,结构域的排列方式较为松散,SBD远离催化位点。
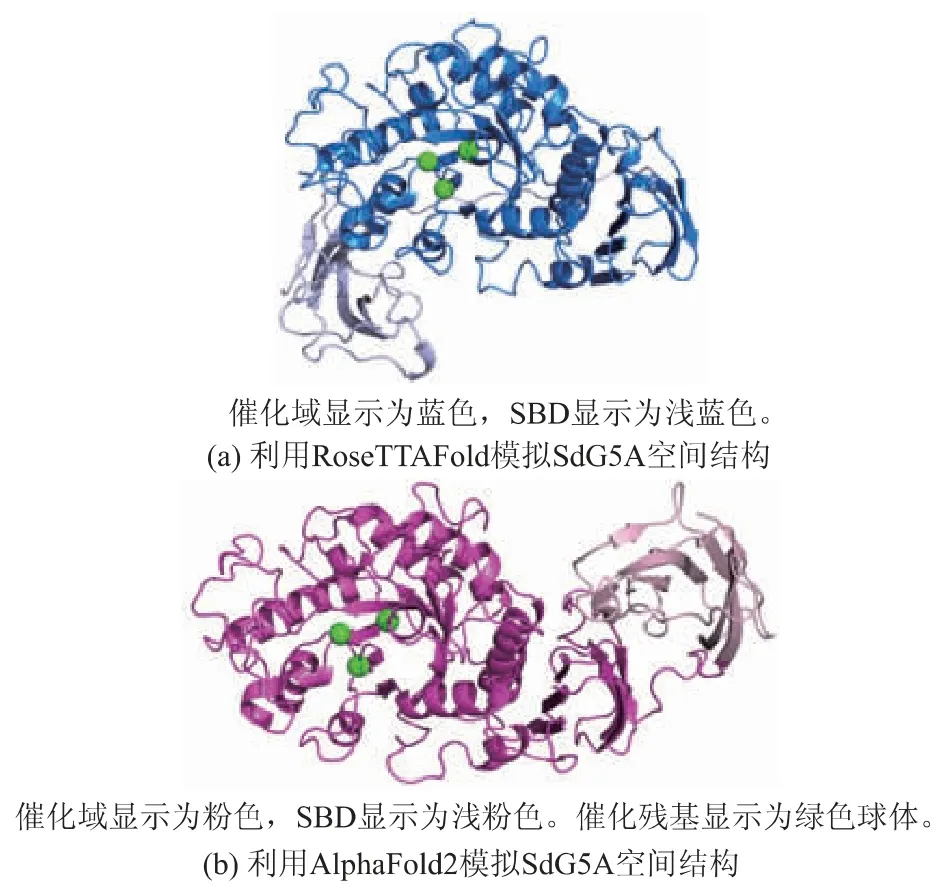
图3 SdG5A空间结构的预测Fig.3 Prediction of SdG5A spatial structures
为了明确SBD的位置,分析了两个模拟结构中结构域之间的相互作用(见图4)。结果表明,在AlphaFold2模拟结构中,SBD与催化域之间不存在相互作用;但在RoseTTAFold模拟结构中,催化域、linker和SBD之间存在大量氢键相互作用,这些作用力使得RoseTTAFold模拟结构的整体构象更加紧凑,有利于SBD发挥向催化域递送底物的作用[22]。
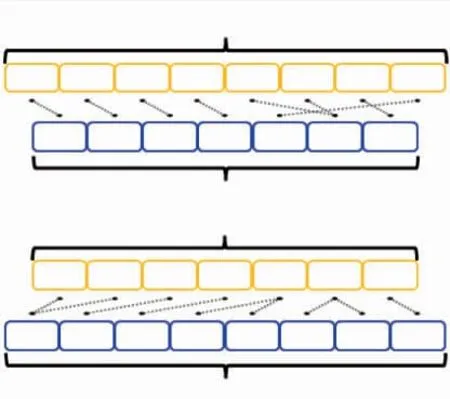
图4 RoseTTAFold模拟结构中催化域、SBD和linker之间的相互作用力Fig.4 Schematic diagram of the interactions within catalytic domain,SBD and linker in the structure predicted by RoseTTAFold
SdG5A的表面电荷分析结果表明,其催化域中的碱性氨基酸残基的比例高于酸性氨基酸残基,使其整体带正电荷,净电荷密度(碱性氨基酸残基数目与酸性氨基酸残基数目的差值占总氨基酸残基数目的比例)为+6.1%;而在SBD中,酸性氨基酸残基的比例高于碱性氨基酸残基,使其整体带负电荷,净电荷密度为-4.1%[6]。由于催化域和SBD带相反电荷,因此存在一定的静电引力,这可能是RoseTTAFold模拟结构中催化域与SBD互相靠近的另一个原因。但氢键具有方向性,而静电力不具有方向性,因此,产生这种构象的主要原因仍然是催化域与SBD之间的氢键相互作用。
Jorgensen等利用小角衍射观察到Aspergillus niger葡萄糖淀粉酶(glucoamylase,EC 3.2.1.3)可以在溶液中形成“头对尾”的二聚体结构,这种结构可以促使SBD向催化域靠近,而不必依赖于linker的运动调整催化域和SBD的相对位置[23]。相应地,对于整体构象较为松散的AlphaFold2模拟结构,也可能通过形成二聚体获得更加紧凑的构象,从而使SBD靠近催化位点。以AlphaFold2模拟的SdG5A结构(见图3(b))为模板,利用M-ZDock模拟SdG5A的二聚体结构。由图5(a)中可以看出,SdG5A的二聚体同样呈现出“头对尾”的结构,其中一个单体的SBD靠近于另一个单体的催化位点。将该二聚体结构与RoseTTAFold模拟结构叠加,发现后者的SBD与前者其中一个单体的SBD的位置接近 (见图5(b))。该结果说明,RoseTTAFold和AlphaFold2所模拟的SdG5A结构均可被认为是准确的,二者的区别在于RoseTTAFold所模拟的是SdG5A呈单体时的构象,而AlphaFold2所模拟的是SdG5A呈二聚体时的构象。
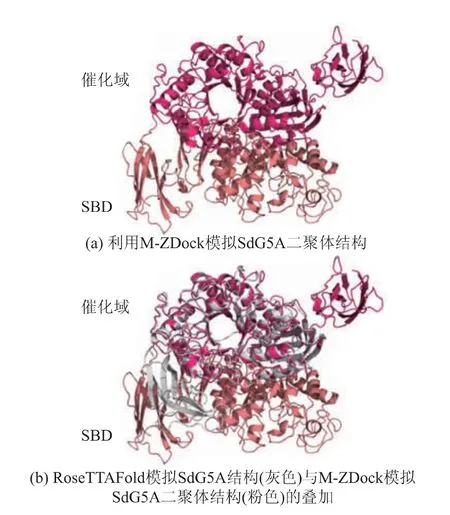
图5 SdG5A二聚体空间结构的预测Fig.5 Structure prediction of dimeric SdG5A
为了判断SdG5A形成二聚体的可能性,分别利用Native-PAGE和SDS-PAGE分析SdG5A在非变性和变性条件下的相对分子质量(见图6),结果表明,两种方法测得的SdG5A相对分子质量一致,说明SdG5A在溶液中以单体形式存在,因此,RoseTTAFold模拟的SdG5A结构更加准确。
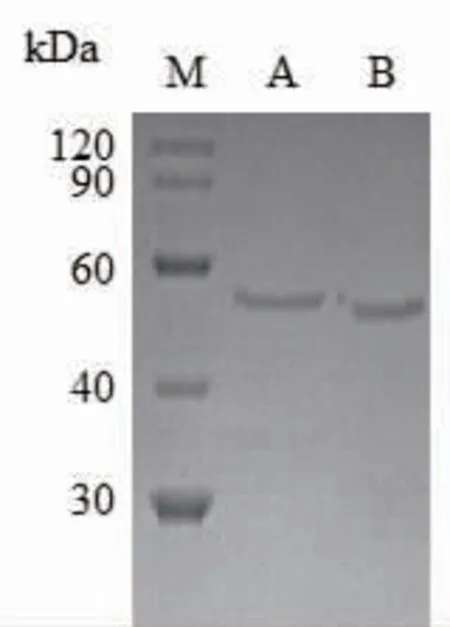
图6 SdG5A的变性电泳与非变性电泳分析Fig.6 SDS-PAGE and Native-PAGE analysis of SdG5A
为了进一步验证RoseTTAFold模拟结构的准确性,以来源于嗜热脂肪芽孢杆菌(B.stearothermophilus)的麦芽糖α-淀粉酶(maltogenic α-amylase,EC 3.2.1.133,BstA)的 晶 体 结 构(PDB ID:1QHP)为参考结构[24],与SdG5A模拟结构进行比对。一方面,BstA的功能与SdG5A相似,二者均能够水解淀粉的α-1,4糖苷键,特异性地生成某一种聚合度的产物;另一方面,BstA的结构组成与SdG5A相似,二者在C端均含有SBD。通过叠加SdG5A模拟结构与BstA晶体结构发现,两个结构中SBD的位置几乎完全相同 (见图7),说明RoseTTAFold模拟结构的可信度较高。

图7 SdG5A模拟结构与BstA晶体结构的比对Fig.7 Alignment of the predicted structure of SdG5A and the crystal structure BstA
2.3 SdG5A的柔性分析
在低温条件下,蛋白质的分子热运动较低,不利于酶对底物分子的获取。因此,通过提高蛋白质的整体或局部柔性来增强分子热运动,可以有效提高冷适酶在低温下的催化效率。蛋白质柔性可以通过B-factor、dn和RMSF进行评价,其中,B-factor是衡量原子位置不确定性的一种指标,反映了晶体中原子电子密度的模糊度[25];dn是衡量原子不稳定性的一种指标,当原子处于能量最低、最稳定的自然态时,dn数值为0[17];RMSF是衡量原子运动自由程度的指标,可以利用MD计算一定时间范围内每个原子相对于其平均位置的变化幅度而获得。B-factor和dn反映的是蛋白质结构的静态柔性,而RMSF反映的是动态柔性。B-factor、dn和RMSF的数值越大,说明相应区域的柔性越高。
2.3.1 SdG5A的静态柔性利用ResQ分析SdG5A的静态柔性,包括B-factor(见图8(a))和dn(见图8(b)),并利用Pymol将SdG5A的B-factor映射到其空间结构(见图8(c))。

图8 SdG5A的静态柔性分析Fig.8 Analysis of the static flexibility of SdG5A
由图8(a)和图8(c)可知,linker区域的Bfactor值明显高于催化域和SBD;从图8(b)可知,linker和SBD区域的dn值均高于催化域,说明linker中原子位置的不确定性导致了linker-SBD区域中原子位置的不稳定性,即高度灵活的linker可能带动了SBD的运动。
2.3.2 SdG5A的动态柔性在0℃和45℃下分别运行MD,当体系运行至100 ns后,蛋白质分子的均方根偏差介于0.5~0.6 nm,说明此时SdG5A结构趋于稳定。SdG5A的RMSF曲线如图9(a)所示。结果表明,在45℃下蛋白质整体结构柔性较高;当温度降低至0℃时,催化域中的氨基酸残基的RMSF发生不同程度的降低,而linker-SBD区域的RMSF未发生明显变化,说明linker-SBD区域的柔性受温度影响较小,且在0℃下仍然能够保持较高的柔性。比较0℃下不同时刻SdG5A的整体构象发现,催化域的中心结构域在100 ns内未发生明显位移,而SBD可以在较大的空间范围内摆动(见图9(b))。考虑到SBD具有捕获底物的能力[22],linker-SBD结构高柔性的分子特征有利于提高其在低温下捕获底物的效率,从而提高酶的催化活力。以上结果阐明了SdG5A和SdG5A-CD的冷适性存在差异的原因,并揭示了调控SdG5A冷适性的重要结构基础。
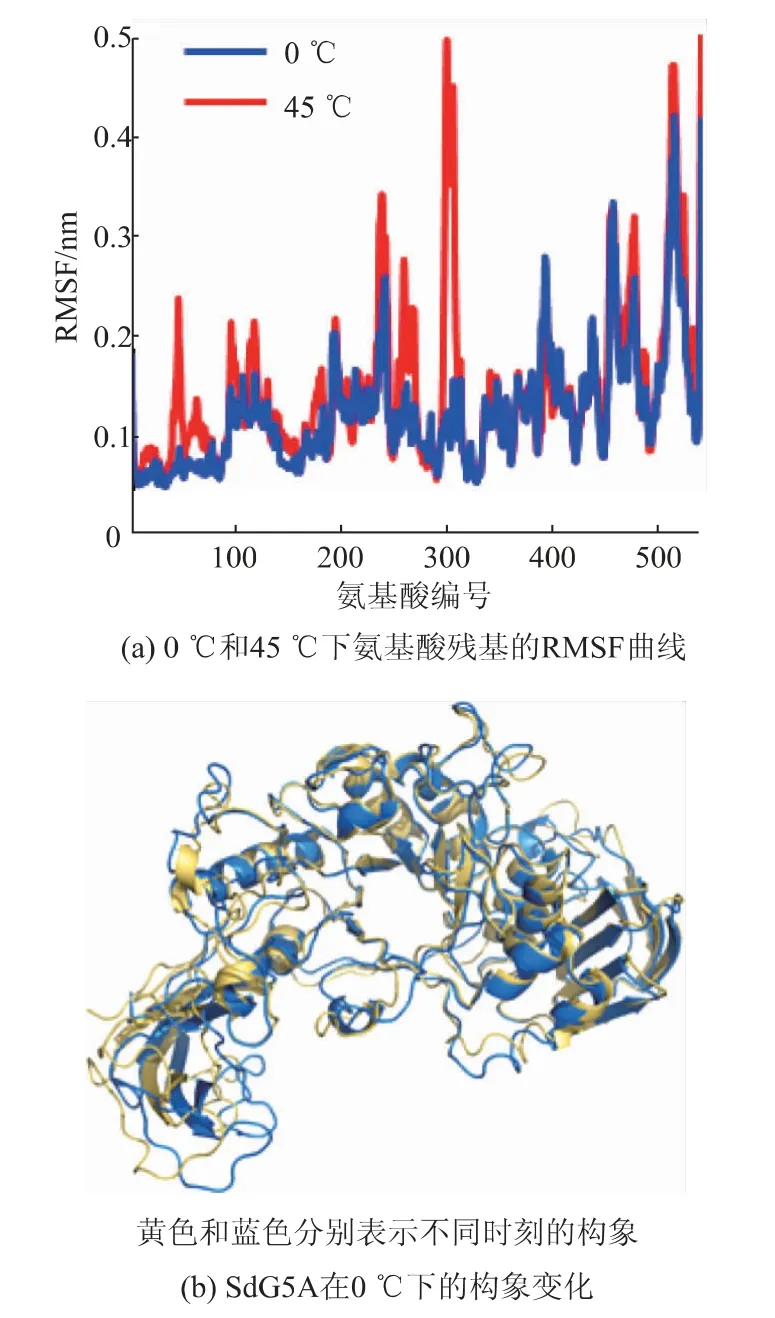
图9 MD分析SdG5A的动态柔性Fig.9 MD analysis of the dynamic flexibility of SdG5A
3 结语
目前已报道的G5A均为高温酶,为了维持其酶反应体系的温度,需要消耗大量的能源、排放大量的温室气体,并且产品的营养价值和感官品质会受到高温的影响而降低。为了解决上述问题,一方面可以加强对冷适G5A的开发和应用;另一方面可以挖掘和总结冷适G5A的结构特征,对非冷适G5A进行定向改造。为了实现上述目标,作者以SdG5A和SdG5A-CD为研究对象,通过异源表达体系的构建、冷适性的表征、空间结构的模拟和分子柔性的分析,证明了SdG5A在室温下生产G5的可行性,并揭示了linker-SBD结构高柔性的分子特征对调控酶冷适性的关键作用,可为其他淀粉酶分子改造的理性设计提供参考,为G5的高效、绿色合成提供理论基础。
