N-乙酰氨基葡萄糖苷酶的异源表达及甘油糖苷的酶法合成
2022-11-30高坤鹏毛相朝
高坤鹏, 毛相朝*,2
(1.中国海洋大学 食品科学与工程学院,山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237)
甘油糖苷是糖基与甘油脱水缩合形成的一类糖苷化合物,和原本的糖基相比,它对于酸、碱、高温都具有更好的稳定性,还可作为中间产物去合成甘油糖脂等其他具有生理活性的化合物[1]。甘油葡萄糖苷能作为细胞激活剂改善皮肤状态[2],还能够帮助抵御紫外线导致的氧化损伤[3]。甘油半乳糖苷表现出一定的抗炎效果[4],同时,其酰化产物半乳糖基甘油酯还能表现出较好的抗肿瘤活性[1]。天然来源的甘油糖苷多从植物或藻类中提取得到,但其含量和回收率通常比较低[5]。梁文辉等测定了蓝藻培养液中甘油葡萄糖苷的含量,其质量浓度仅为10~15 mg/L[6]。另一方面,天然来源的甘油糖苷种类有限,且多以混合物的形式存在,在一定程度上制约了其应用。针对这些问题,人工合成特定种类的甘油糖苷是最有效的解决办法。
N-乙酰氨基葡萄糖(N-acetyl-glucosamine,NAG)是生物细胞内许多重要多糖的基本组成单位[7],在临床上也可用于缓解炎症性关节疾病,促进软骨损伤的愈合[8-9],改善肠道消化吸收功能,促进生长[10],还可以调节胎儿心脏的生长发育[11]。最新的研究还表明,NAG对于新型冠状病毒肺炎具有一定的疗效,可以显著降低死亡率,缩短病人住院时间[12]。因此,合成甘油-N-乙酰氨基葡萄糖苷对于进一步增强其生理功能研究以及新型药物的开发具有重要意义。
和化学合成法相比,酶法合成甘油糖苷不需要多步保护和去保护步骤,且具有反应条件温和、副产物少的优点[1]。Kurakake等利用半乳糖苷酶催化对硝基苯基半乳糖苷和甘油发生转糖基反应合成了甘油半乳糖苷,转化率达到27.7%[13]。Zhang等构建了多酶体系通过磷酸解和转糖基作用,以蔗糖和甘油为底物合成了甘油葡萄糖苷,蔗糖转化率为89%[14]。段培枫等利用异源表达了蔗糖磷酸化酶的重组枯草芽孢杆菌作为全细胞催化剂,催化蔗糖和甘油生成甘油葡萄糖苷,蔗糖转化率达到75.1%[15]。和转糖基反应相比,逆水解反应直接以廉价易得的单糖为底物,仅催化一步反应就可以生成目的产物和水,没有多余的副产物,更有利于目的产物的分离纯化。有研究者使用半乳糖苷酶催化半乳糖和甘油发生逆水解反应合成了甘油半乳糖苷,转化率达到55.88%[16],经过活性炭吸附和G-15柱层析对目的产物进行纯化后,产物纯度达到97.80%[17]。然而,并非所有糖苷酶都能够催化逆水解反应,陈宝莉克隆了多个N-乙酰氨基葡萄糖苷酶 (N-acetylglucosaminidase,NAGase)并对其逆水解活性进行筛选,最终只有两个NAGase能够通过逆水解反应合成几丁寡糖[18]。
作者在前期克隆表达和催化特性筛选的基础上获得了一个能够催化NAG和甘油发生逆水解反应的NAGase。该酶的编码基因来自杆菌状链霉菌(Streptomyces bacillaris ATCC 15855T),异源表达宿主为大肠杆菌BL21(DE3)。利用镍离子亲和层析法获得纯酶后对其酶学性质进行了研究,并对该酶催化甘油和NAG合成甘油-N-乙酰氨基葡萄糖苷(glyceryl N-acetyl-glucosamine,GNAG)的反应条件进行了优化,为其功能研究和应用开发奠定了基础。
1 材料与方法
1.1 材料与试剂
杆菌状链霉菌:山东省海洋微生物菌种保藏与应用工程技术研究中心提供;Phanta Max Super-Fidelity DNA聚 合 酶、ClonExpress Ultra One Step Cloning Kit、2×Taq Master Mix(Dye Plus):南京诺唯赞生物科技股份有限公司产品;表达质粒pET-28a(+):作者所在实验室保存;快速质粒小提试剂盒:北京天根生化科技有限公司产品;胶回收试剂盒:Omega公司产品;大肠杆菌Trelief®5α感受态细胞、大肠杆菌BL21(DE3)感受态细胞:北京擎科生物科技有限公司产品;聚合酶链式反应引物sbnag2550-F:5′-agcaaatgggtcgcggatccatgtcgcccacgc--gaggtgc-3′,sbnag2550-R:5′-gtgcggccgcaagcttgccc gcgctgcccgtc-3′,28a-F:5′-aagcttgcggccgcactcgag-3′,28a-R:5′-ggatccgcgacccatttgctgtcc-3′:生工生物工程(上海)股份有限公司产品合成。
硫酸卡那霉素(kanamycin,Kana)、异丙基硫代半乳糖苷(isopropyl-1-thiogalactopyranoside,IPTG):生工生物工程(上海)股份有限公司产品;镍离子亲和层析柱填料:北京全式金生物科技有限公司产品;聚丙烯酰胺凝胶(polyacrylamide gel,PAGE)快速制备试剂盒:上海雅酶生物医药科技有限公司产品;彩虹180广谱蛋白质Marker、NAG:北京索莱宝科技有限公司产品;超滤离心管(相对分子质量30 000):美国密理博公司产品;对硝基苯基-N-乙酰氨基葡萄糖苷(p-nitrophenyl N-acetyl-glucosaminide,pNP-NAG)、对硝基苯酚(p-nitrophenol,pNP):上海阿拉丁生化科技股份有限公司产品;针式过滤器:天津市津腾实验设备有限公司产品;其余试剂均购自国药集团化学试剂有限公司产品。
1.2 仪器与设备
T960 PCR仪、超净工作台:力新仪器(上海)有限公司产品;DHP9051生化培养箱:上海一恒仪器科学仪器有限公司产品;超声破碎仪:宁波新芝生物科技股份有限公司产品;Multiskan FC全波长酶标仪:Thermo Scientific公司产品;水浴摇床:上海知楚仪器有限公司产品;LC-20A高效液相色谱仪(示差检测器):日本岛津公司产品。
1.3 实验方法
1.3.1 SbNag2550序列分析SbNag2550重组蛋白质的相对分子质量大小及等电点等性质预测使用在 线 服 务 器ExPASy ProtParam Server(https://web.expasy.org/protparam/),进 化 亲 缘 关 系 分 析 使 用MEGA 7.0。
1.3.2 重组表达菌株的构建实验前期从山东省海洋微生物菌种保藏与应用工程技术研究中心购买了杆菌状链霉菌,并对其进行了全基因组测序,通过氨基酸序列预测分析,从中找到了一个假定的N-乙酰氨基葡萄糖苷酶基因片段sbnag2550。利用添加了同源臂的引物对该片段进行扩增后与线性化的pET-28a(+)进行同源重组,经过阳性克隆验证和二代测序,将在大肠杆菌Trelief®5α细胞中构建成功的重组质粒提取并转化至大肠杆菌BL21(DE3)细胞。
1.3.3 目的蛋白质的诱导表达与纯化将该重组工程菌在试管中活化后按照1%的体积分数接种至LB培养基(添加质量浓度为50 mg/L的Kana),于37℃培养至OD600达到0.6,加入终浓度为0.1 mmol/L的IPTG后于20℃培养24 h。收集菌体后用20%培养液体积的超纯水重悬菌体,360 W超声破碎10 min。8 000 r/min离心20 min除去细胞碎片后将上清液过膜获得粗酶液。粗酶液经镍离子亲和层析柱吸附后用不同浓度的咪唑进行梯度洗脱,利用SDS-PAGE检测蛋白质的表达情况和纯化效果。
1.3.4 SbNag2550的酶活力测定方法以pNPNAG为反应底物,通过405 nm下测定SbNag2550水解底物产生pNP的量来计算其酶活力。反应时在470 μL缓冲液中加入10 μL酶液,混合均匀后于水浴锅中孵育2 min,加入20 μL底物溶液(10 mmol/L)并吹打均匀,计时5 min后加入500 μL的氢氧化钠溶液(50 mmol/L)终止反应。吸取200 μL反应液于96孔板中测定吸光度,计算反应体系中生成pNP的总量。1个酶活力单位(U)定义为每分钟产生1 μmol pNP所需要的酶量。
1.3.5 SbNag2550的酶学性质研究选择25~70℃对SbNag2550的最适温度进行测定,结果以最高酶活力的百分比(即相对酶活力)表示;在最适温度及其几个临近温度下测定酶活力随时间的变化曲线,定时取样直至60 h,评估其热稳定性,结果以各个时间节点所取样品占初始酶活力的百分比(即相对残余酶活力)表示;选择pH 4.0~6.0的柠檬酸-柠檬酸钠缓冲液和pH 6.0~8.0的磷酸二氢钠-磷酸氢二钠缓冲液(浓度均为100 mmol/L)测定SbNag2550的最适pH。pH稳定性同样在pH 4.0~8.0进行测定,取样周期为60 h,结果呈现方式与上文一致。选择不同金属离子的氯盐及EDTA二钠来探究金属离子对该糖苷酶活性的影响,作用浓度分别为1 mmol/L和10 mmol/L。以不添加金属离子条件下测定的酶活力为对照,其余样品按其占对照酶活力的百分比(即相对酶活力)表示。
1.3.6 SbNag2550催化合成GNAG甘油与NAG质量比为5∶1,SbNag2550用量为20 U/g(以对pNPNAG的水解活性计),体系含水量与NAG体积质量比为10 mL∶1 g,反应体系密封后于50℃、180 r/min反应24 h。反应结束后煮沸10 min灭酶,取样100 μL,加入900 μL去离子水进行稀释,利用0.45 μm针式过滤器除去不溶性杂质后用于高效液相色谱和质谱检测。液相色谱检测计算其转化率,色谱柱选择Shodex Sugar KS801(300 mm×8 mm,6 μm),柱温设定为75℃,上样体积为20 μL,以纯水作为流动相1 mL/min进行洗脱。质谱检测条件:正离子模式,扫描电压为100~500 eV。
1.3.7 GNAG合成反应条件优化称取不同质量的甘油和一定质量的NAG于反应瓶中,使甘油与NAG质 量 比 为2∶1、4∶1、6∶1、8∶1、10∶1、12∶1,SbNag2550用量(以NAG质量计)为20 U/g,体系中含水量(以NAG质量计)为10 mL/g。反应体系密封后于50℃、180 r/min反应24 h。通过液相色谱检测反应体系中NAG和GNAG的相对含量以计算其转化率,得到最适甘油添加量。在此基础上继续对反应体系含水量(4~10 mL/g,以NAG质量计)、反应体系pH(4.6~6.6)、反应温度(40~60℃)、加酶量(5~30 U/g,以NAG质量计)进行了优化,并测定了不同反应时间(12~144 h)下的转化率。
1.3.8 反应转化率的计算
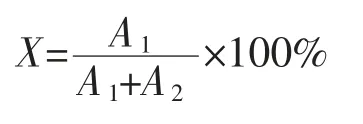
式中:X为反应转化率,%;A1为液相色谱检测GNAG的相对峰面积;A2为液相色谱检测NAG的相对峰面积。
2 结果与分析
2.1 SbNag2550的序列分析及克隆表达
SbNag2550的编码序列长度为1 611 bp,编码了536个氨基酸,该序列已上传NCBI数据库,Genbank登录号为BK059888。SbNag2550属于糖苷水解酶20家族,进化亲缘关系分析结果(见图1)表明其与来源于双歧杆菌和肺炎链球菌的糖苷水解酶序列最为相似,这暗示了SbNag2550也是典型的细菌来源的糖苷酶,与其实际来源相一致。
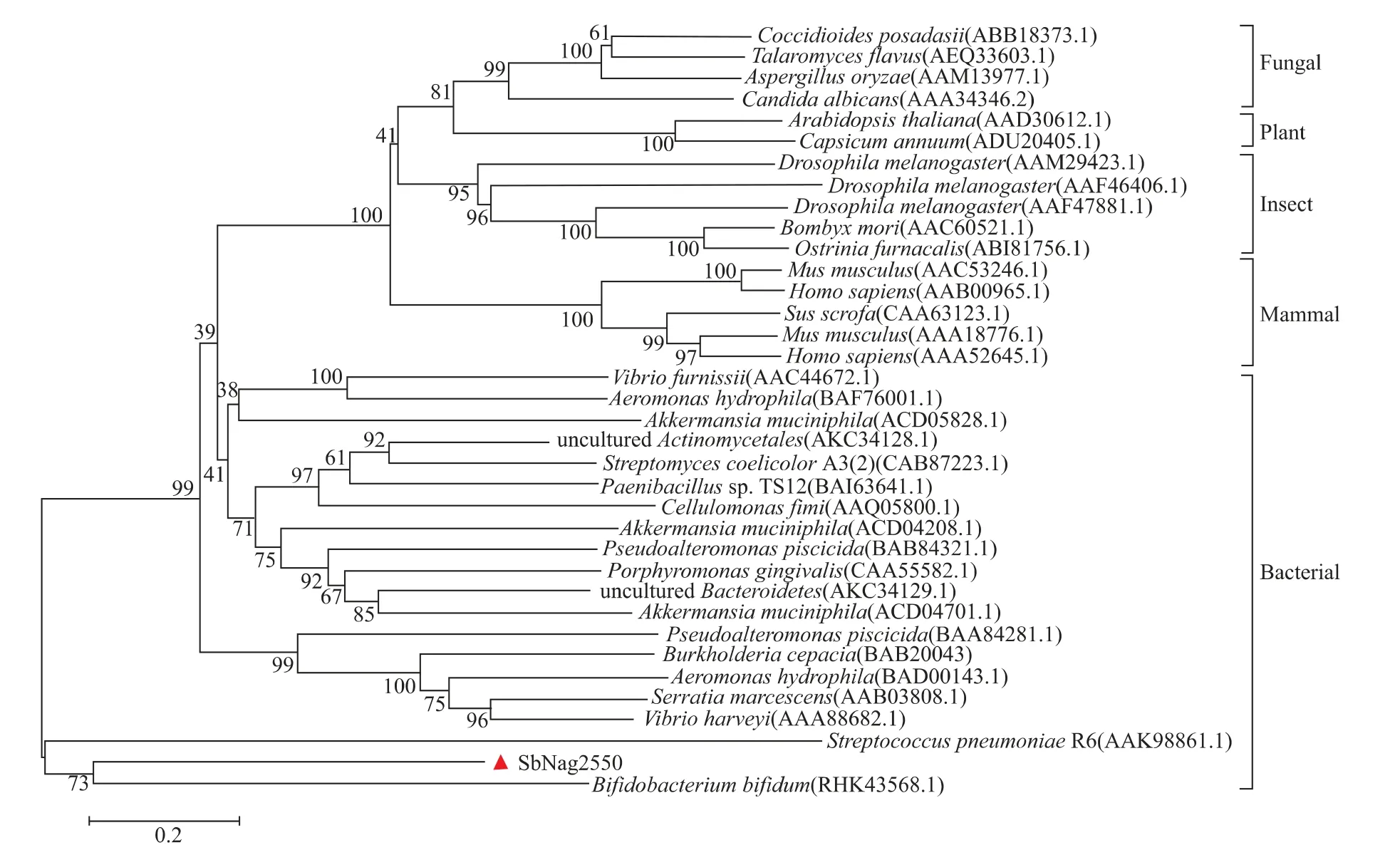
图1 SbNag2550的进化亲缘关系分析Fig.1 Phylogenetic analysis of SbNag2550
经预测,SbNag2550的等电点为5.35,相对分子质量为58 600。该酶可以在镍离子亲和层析柱吸附后由100 mmol/L咪唑洗脱下来,利用SDS-PAGE检测了SbNag2550的表达情况和纯化结果,结果(见图2)表明该酶的相对分子质量与预测结果一致。
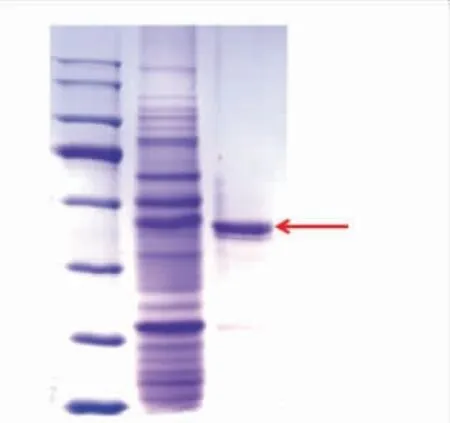
图2 SDS-PAGE检测SbNag2550的纯化结果Fig.2 SDS-PAGE analysis of purified SbNag2550
2.2 SbNag2550的酶学性质研究
2.2.1 SbNag2550的最适温度及热稳定性SbNag2550最适温度测定结果见图3(a),该酶催化pNP-NAG水解的最适温度为50℃。同时,该酶在25℃至70℃都表现出较好的活性(大于最适温度下催化活性的60%),在45~60℃相对酶活力均能达到90%。该酶还表现出了优良的热稳定性,相关结果见图3(b)。同样是链霉菌来源的SvNag2557在55℃孵育12 h后仅保留10%左右的酶活力[19],而SbNag2550在相同温度下孵育60 h后仍能保留将近90%的相对残余酶活力。
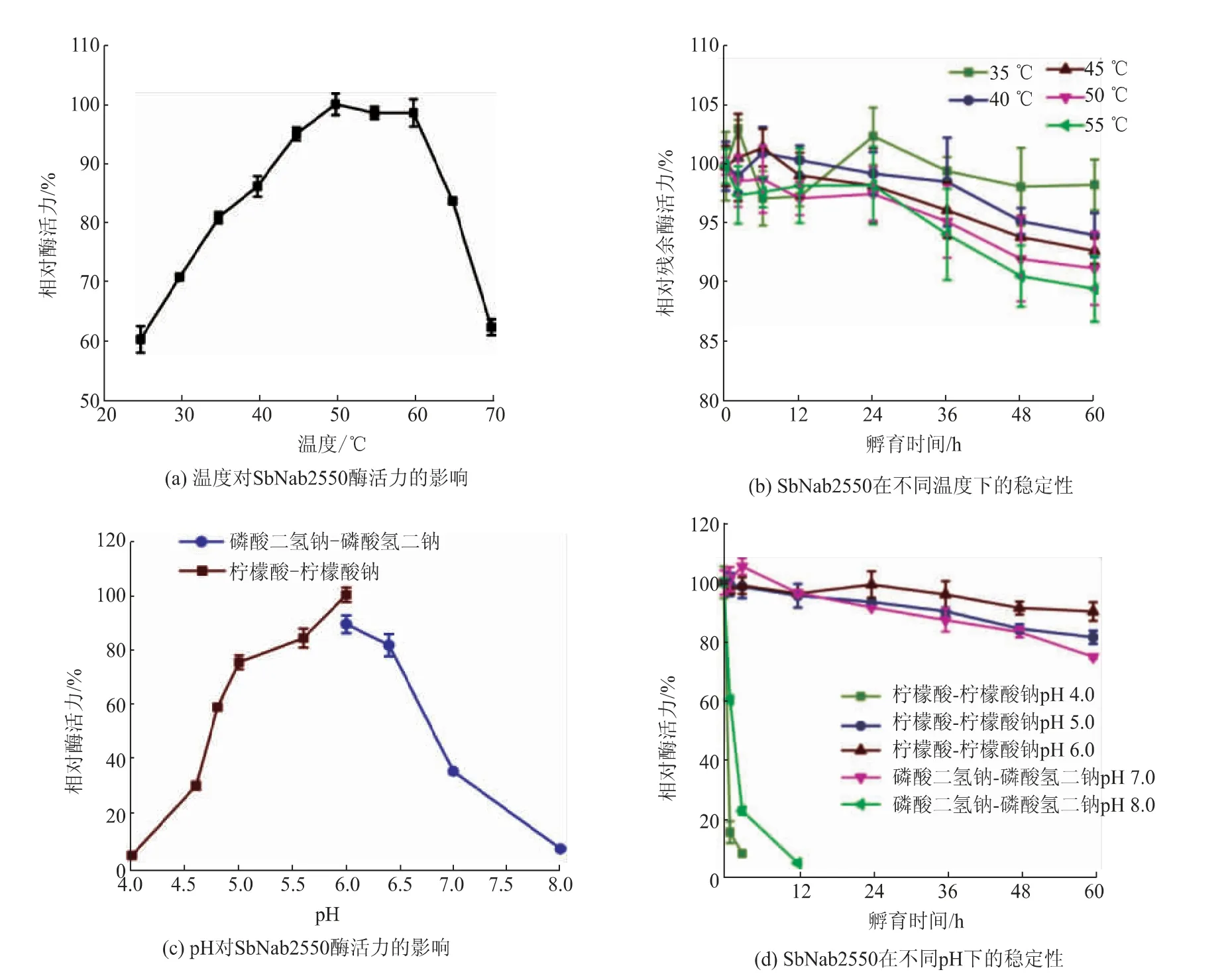
图3 SbNag2550的酶学性质Fig.3 Enzymatic properties of SbNag2550
2.2.2 SbNag2550的 最 适pH及pH稳 定 性SbNag2550的最适pH测定结果如图3(c)所示,该酶在pH 6.0的柠檬酸-柠檬酸钠缓冲液中催化活性最高,该酶还表现出比较强的pH依赖性,只有在弱酸性环境中才能较好地催化通用底物的水解,这也与大多已报道的NAGase一致[19-21]。pH稳定性的测定结果如图3(d)所示,该酶在pH 4.0和pH 8.0分别在孵育3 h和12 h时完全失活,而在pH 5.0、6.0和7.0则表现出较好的稳定性,尤其在pH 6.0孵育60 h后仍保留90%以上的酶活力。
2.2.3 金属离子对SbNag2550酶活力的影响如表1所示,Na2-EDTA在两种浓度下都没有表现出明显的抑制效果,表明该酶不是一个金属依赖型酶。大多数金属离子对SbNag2550的活性影响不大,高浓度的Zn2+对其表现出一定的抑制作用,这一点与来源于短小芽孢杆菌的BpNagZ比较相似[22]。Fe3+和Mn2+对该酶的酶活力表现出比较稳定的促进作用,尤其是高浓度的Mn2+,可以使酶活力达到对照组的两倍以上,高浓度的Ni2+和Co2+也表现出一定促进作用。来源于申氏杆菌的rJB10Nag同样属于糖苷水解酶20家族,低浓度(1 mmol/L)的Fe3+和Mn2+同样能促进其酶活力,但10 mmol/L的Fe3+和Mn2+却在一定程度上抑制了该酶的酶活性[23]。
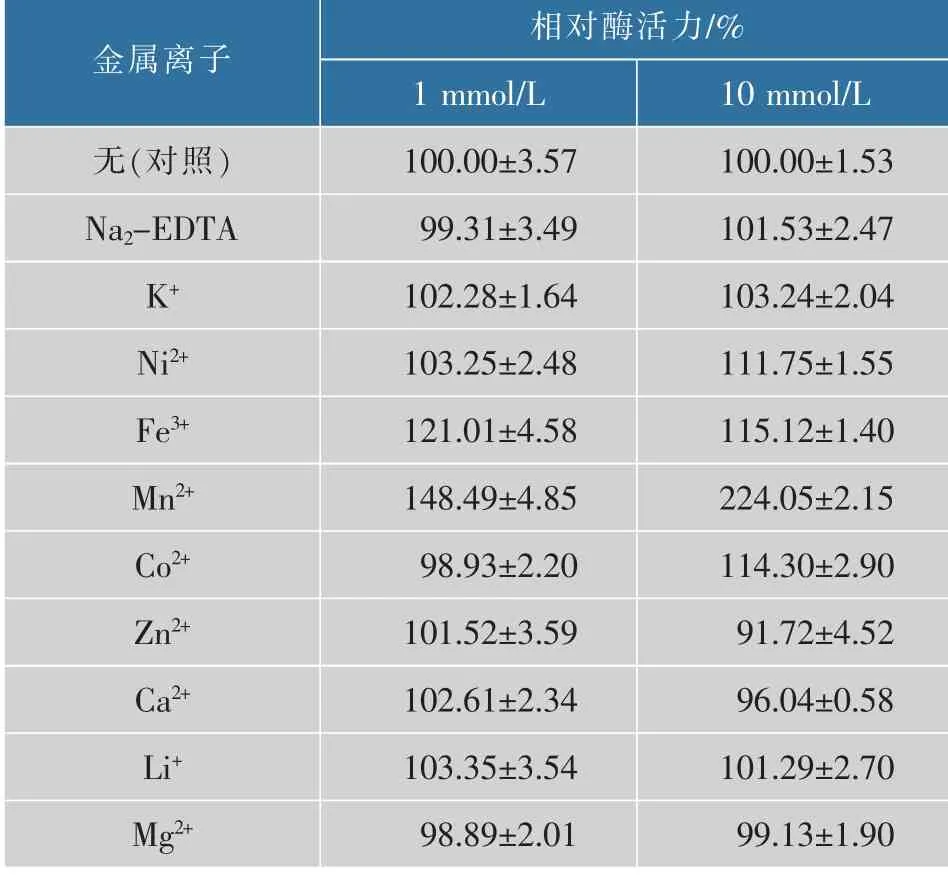
表1 金属离子对SbNag2550活性的影响Table 1 Effect of metal ions on activity of SbNag2550
2.3 SbNag2550催化逆水解合成甘油-N-乙酰氨基葡萄糖苷
2.3.1 甘油-N-乙酰氨基葡萄糖苷的鉴定用高效液相色谱法对合成反应产物进行了检测,检测结果如图4(a)所示,底物甘油和NAG的出峰时间分别为8.50 min和6.72 min,产物GNAG的出峰时间为6.27 min。从图中可以看出液相色谱能够较好地分离底物和产物,可以实现产物相对含量的检测,为后续反应条件的优化奠定了基础。质谱检测结果如图4(b)所示,图中318.1是目的产物[M+Na]+的分子峰,而244.1则是底物NAG[M+Na]+的分子峰。
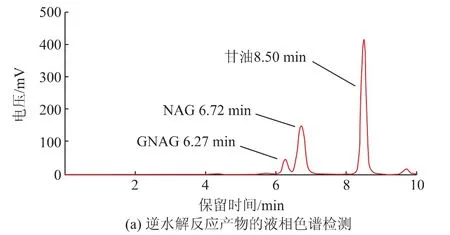
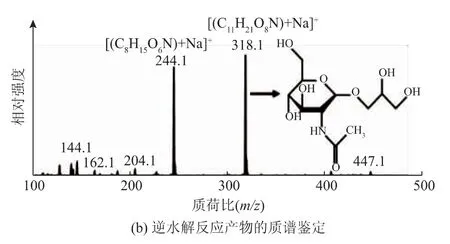
图4 甘油-N-乙酰氨基葡萄糖苷(GNAG)的检测Fig.4 Determination of glyceryl N-acetyl-glucosamine(GNAG)
2.3.2 甘油和含水量对反应转化率的影响通过调整甘油的添加量对两种底物的质量比进行了优化(见图5)。甘油添加量过少时,底物较少,不利于逆水解反应的进行,转化率较低;甘油添加量过大时,体系的流动性较差,不利于酶和两种底物的接触,也不利于反应的进行,当甘油与NAG质量比为10∶1时转化率最高。继续对含水量进行优化,含水量过大时,SbNag2550更倾向于催化水解反应,不利于GNAG的合成,而当含水量过小时,底物不能很好地溶解在体系中,不利于酶与底物的充分接触,逆水解转化率在含水量为7 mL/g(以NAG质量计)时达到最高,为24.69%(见图6)。
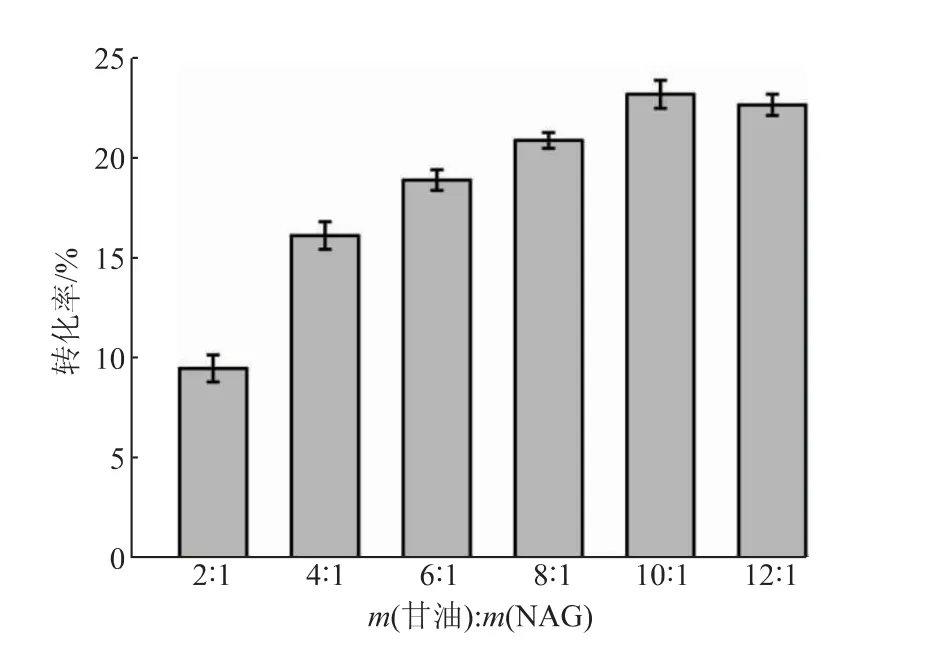
图5 甘油与N-乙酰氨基葡萄糖(NAG)质量比对反应转化率的影响Fig.5 Effect of mass ratio of glycerol to N-acetylglucosamine(NAG)on the conversion rate of reaction
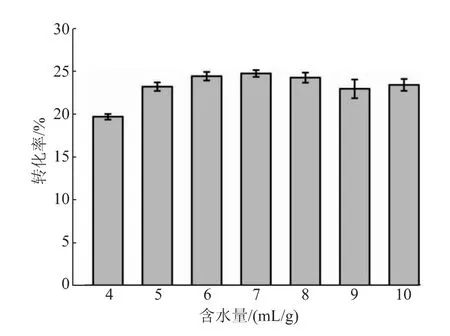
图6 含水量对反应转化率的影响Fig.6 Effect of water content on the conversion rate of reaction
2.3.3 pH、温度和加酶量对反应转化率的影响在以pNP-NAG为底物时,SbNag2550表现出了较强的pH依赖性,而在合成反应中,反应体系的pH对反应效率的影响同样很大(见图7)。当pH高于5.0时,反应转化率随着反应体系pH的降低而逐渐升高。转化率在pH 5.0时最高,达到30.55%。当反应体系过酸(pH 4.6)或者接近中性(pH 6.6)时,其转化率会大大降低。值得注意的是,SbNag2550在纯水中催化逆水解反应的转化率高于在pH 6.2和pH 6.6的环境中的转化率,这说明反应转化率不仅受到pH的影响,还受到缓冲盐种类的影响。另外,同样在柠檬酸-柠檬酸钠缓冲液中,SbNag2550在pH 5.0时更适合催化逆水解反应,在pH 6.0时则更有利于催化pNP-NAG的水解。这样的结果也证明了优化逆水解反应体系pH的必要性。反应温度的优化也呈现出比较明显的趋势(见图8)。从40℃到55℃,随着温度的升高,反应体系中的分子运动加快,转化率呈现出持续上升的趋势;而当温度继续提升至60℃时,反应转化率急剧下降,仅达到13.40%。由上文可知,SbNag2550催化水解反应时对于温度有很好的适应性,而当该酶催化逆水解反应时,温度对其转化率表现出了较大的影响。结合pH优化结果,SbNag2550催化水解反应和逆水解反应的调控机理一定存在某些差异,对这方面开展进一步的研究将有利于控制反应向逆水解的方向进行,进一步提高其转化率。由于55℃仅比50℃略有提升,为了节约能源,选择50℃对体系中SbNag2550的加酶量进行优化。结果表明,反应转化率随着加酶量的提高逐渐升高,且升高的趋势越来越平缓,考虑到酶的成本,最终选择25 U/g(以NAG质量计)作为最适加酶量(见图9)。
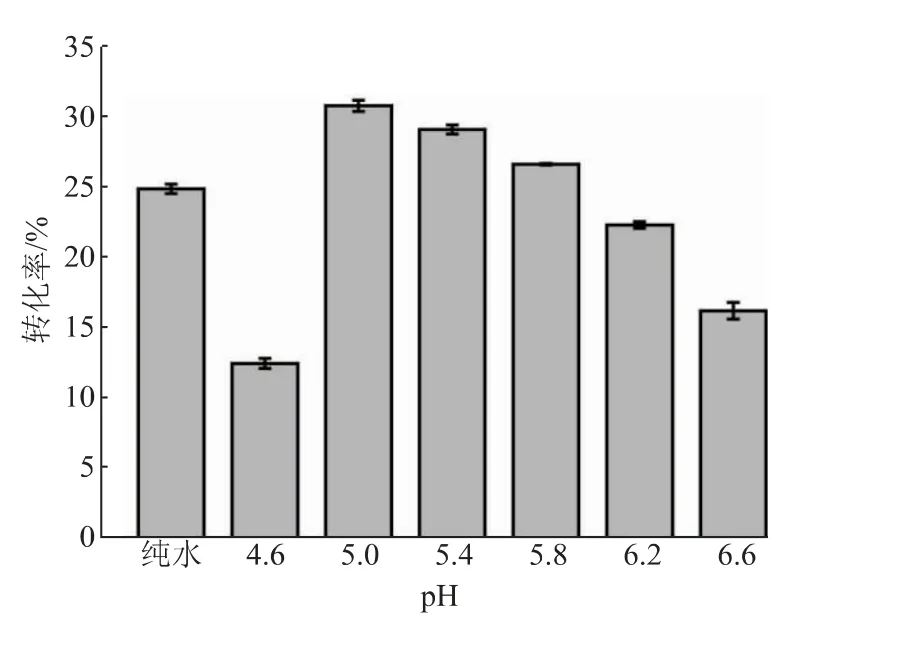
图7 反应体系pH对反应转化率的影响Fig.7 Effect of pH of reaction system on the conversion rate of reaction
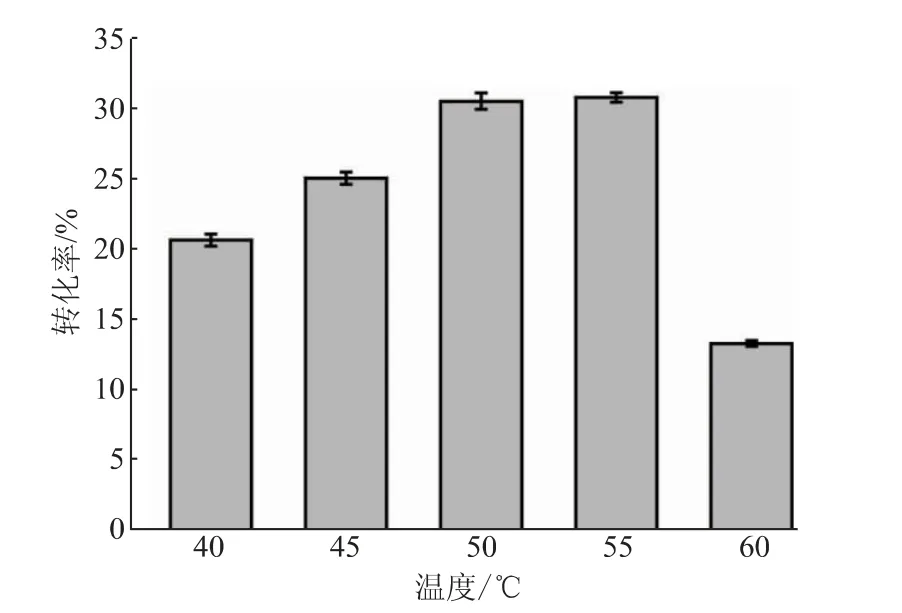
图8 反应温度对反应转化率的影响Fig.8 Effect of temperature on the conversion rate of reaction
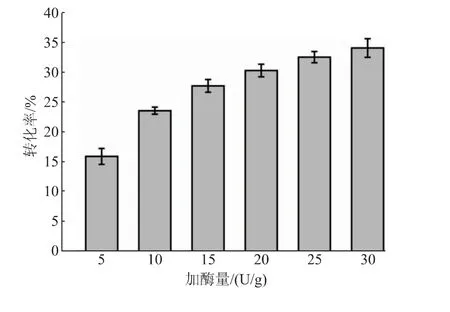
图9 加酶量对反应转化率的影响Fig.9 Effect of enzyme loading on the conversion rate of reaction
2.3.4 反应时间对反应转化率的影响及反应平衡的验证液相色谱测定了不同反应时间下NAG转化为GNAG的转化率。结果表明(见图10),反应转化率在初期增长很快,在24 h即可达到28.20%;随着反应的进行,产物不断积累,酶催化效率开始降低,在72 h时基本达到稳定,反应转化率达到34.82%。与同样具备逆水解活性的LcNAgase和EfNagase在催化合成几丁寡糖时的转化率(分别为4.86%和5.05%)相比[18],本研究中的转化率要高得多,但这可能是因为甘油作为糖基受体时,空间位阻较小,更容易与NAG脱水缩合。而与酶法合成其他类型甘油糖苷,如甘油葡萄糖苷[14-15]和甘油半乳糖苷[16]的相关研究相比,本研究中合成GNAG的转化率不是特别高,可能会对其后期研究造成一定的限制。为了进一步探究反应转化率后期不再增长的原因,在以上最适条件下进行反应,间隔取样100 μL作为样品,同时加入1 U酶液继续反应,另一组在取样后加入等体积的水,取样持续144 h。测定不同时间点补加酶液组和补加水组的转化率,与不做处理持续反应的对照组进行对比(见图10)。结果表明,补加酶液/水的反应体系在12 h和24 h的转化率与不做处理的对照组基本一致,而48 h时的转化率则明显低于对照组,反应后期的转化率更是出现了大幅度的下降。推测原因是因为在不断取样中反应体系中NAG和甘油等物料的浓度都有所下降,使得反应平衡向水解方向移动,从而导致转化率呈现下降的趋势。另外,补加酶液组和补加水组的转化率变化趋势基本一致,这表明SbNag2550直到144 h仍保留较高的酶活力,再次印证了其优良的稳定性。另外一方面,验证了反应转化率较低是因为反应达到了平衡,就可以针对性地采取不同策略来提高反应的转化率,例如在反应的同时移除产物以减弱产物的抑制作用,或者采用非水相反应体系进行反应以抑制产物的水解。Hang等采用反应分离耦合的方式,在酶膜反应器中催化菊糖水解生成双果糖酐Ⅲ,减弱了产物的抑制作用,反应产率和产物纯度均有显著提高[24]。Schwarz等采用连续反应的方式,催化邻硝基苯基葡萄糖苷和甘油发生转糖基反应,最终甘油葡萄糖苷得率达到80%[25]。采取合适的策略来进行反应将有利于进一步提高NAG的利用率,从而获得更多的GNAG。
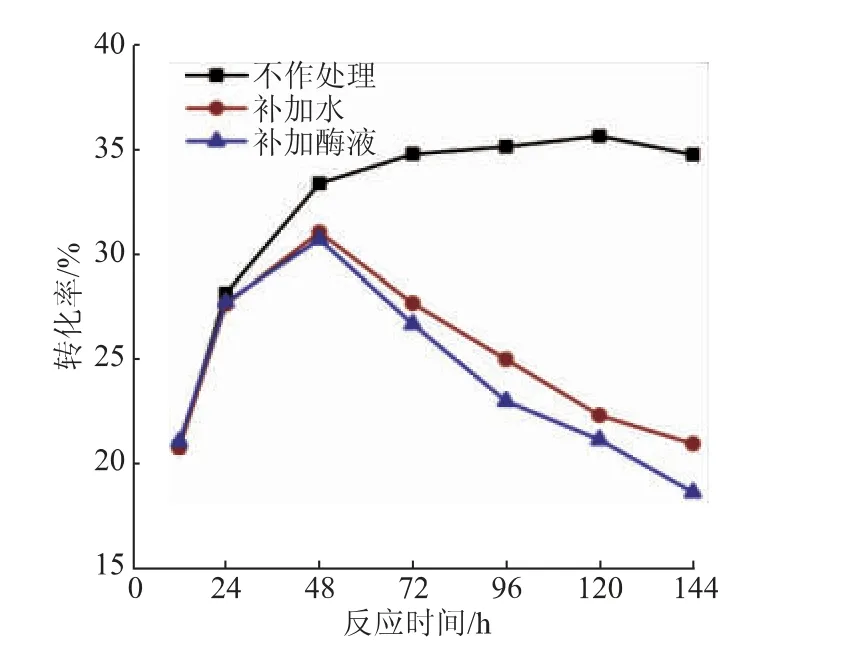
图10 反应时间对反应转化率的影响Fig.10 Effect of reaction time on the conversion rate of reaction
3 结语
作者从杆菌状链霉菌中克隆获得一个NAGase的编码基因,并将其在大肠杆菌BL21(DE3)中实现可溶性表达,获得了具备优良催化特性的SbNag2550。SbNag2550表现出了较强的温度适应性,在45~60℃均能够较好地发挥催化活性。该酶还表现出较好的热稳定性,在55℃孵育60 h仍能保留将近90%的酶活力。同时,SbNag2550还呈现出比较强的pH依赖性,在弱酸性环境中才能较好地发挥作用。利用该酶催化NAG和甘油逆水解实现了GNAG的合成,反应24 h时转化率达到28.20%,反应72 h时转化率为34.82%。本研究中首次利用酶催化的方式合成了GNAG,且逆水解反应底物比较廉价,反应工艺也比较简单,为GNAG的大量制备及其功能活性研究奠定了基础。另外,本研究中所挖掘的SbNag2550还可进一步尝试用于其他含NAG的功能性寡糖的酶促合成。
