谷氨酸脱羧酶基因的挖掘、表征及全细胞制备γ-氨基丁酸的研究
2022-11-30池慧兵孟凡强陆兆新吕凤霞
冯 骁, 池慧兵, 孟凡强, 陆兆新, 朱 萍, 吕凤霞
(南京农业大学 食品科学技术学院,江苏 南京 210095)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种天然存在的氨基酸,广泛分布在原核与真核生物中。在哺乳动物的神经系统中,GABA为抑制性神经递质[1],在神经活动中扮演重要的角色。国内外研究表明,GABA具有调节神经传导,增强记忆力,调节血压心率,促进生长激素分泌,调节肠道微生物区系等多种作用[2-6]。GABA已被添加至许多食品及其加工原料中,包括绿茶、小麦、酒曲[7-9]等,具有一定的保健功能。
GABA的制备方法主要有化学直接合成法[10]、植物富集提取法[11]、生物酶法[12]。化学直接合成法在制备过程中会产生吡咯烷酮、丁内酯、γ-氯丁氰等不安全副产物,且反应条件苛刻;而植物富集提取法存在富集效率低等缺陷。相比之下,生物酶法具有安全性好、生产效率高与生产成本低等优势,为目前较为理想的GABA制备方法。研究学者在动物、植物、微生物中均发现谷氨酸脱羧酶(glutamate decarboxylase,GAD)。但由于动植物来源的GAD分离纯化较为困难,因此,微生物来源的GAD研究较为广泛,主要包括短乳杆菌(Lactobacillus brevis)、植物乳杆菌 (Lactobacillus plantarum)、大肠杆菌(Escherichia coli)、链霉菌属(Streptomyces)、巨大芽孢杆菌(Bacillus megaterium)等[13-16],然而这些来源的GAD存在热稳定性差、pH稳定性范围较窄、与底物的亲和力不高,以及后期产物的分离纯化工艺烦琐、耗能大、收益低等缺点,难以满足工业应用需求。如大肠杆菌GAD在50℃孵育2 h残余酶活力仅剩40%;屎肠球菌GAD仅在pH 5.0~5.2的窄范围内较稳定[17];短乳杆菌Lb85GAD的底物亲和力为22.9 mmol/L等[18-19]。因此,挖掘性能优良的GAD基因,构建高效转化平台对于工业化生产GABA具有重要意义。
作者将酿酒酵母S288C来源的GAD基因进行克隆,实现酿酒酵母谷氨酸脱羧酶在大肠杆菌中高效表达,并对重组GAD进行分离纯化及其酶学性质表征,以及全细胞制备GABA的最适条件探究,为GABA的高效生产提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒菌株E.coli BL21(DE3)由南京农业大学酶工程实验室保藏;酿酒酵母谷氨酸脱羧酶(Saccharomyces cerevisiae glutamate decarboxylase)基因(GenBank NO.:GFP66652.1)由金斯瑞公司合成并克隆至质粒pET-21a(+)中,酶切位点Nde I、Xho I。
1.1.2 主要试剂磷酸吡哆醛(PLP)、GABA标准品(质量分数≥99%)、丹磺酰氯:美国Sigma公司产品;四氢呋喃(色谱级):永华化学股份有限公司产品;甲醇(色谱级):国药集团化学试剂有限公司产品;其他试剂均为国产分析纯。
1.1.3 培养基LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L。
LB固体培养基:在100 mL LB培养基中加入1.8~2.5 g的琼脂糖。
1.2 方法
1.2.1 酿酒酵母GAD的转化鉴定将重组质粒pET-21a(+)-GAD转入表达宿主E.coil BL21(DE3)感受态细胞中,培养后涂布在含有100 μg/mL氨苄青霉素的LB固体培养基中,于37℃恒温培养箱中过夜培养10~12 h,待单菌落长出后于LB液体培养基中挑入单菌落并培养10~12 h,保存至甘油管中(甘油终体积分数为15%),并收集菌体进行测序,以确定转化宿主成功。
1.2.2 摇瓶发酵从甘油管中以体积分数为1%的接种量接种入LB液体培养基中(含100 μg/mL氨苄青霉素),37℃、180 r/min培养10~12 h。以体积分数为1%接种量转接至新的LB培养基中,在菌体生长至对数期时(OD600为0.6~0.8)加入IPTG(终质量浓度100 μg/mL),16℃、180 r/min继续诱导培养18 h。发酵完毕后8 000 r/min离心5 min,收集菌体,每100 mL发酵液用10 mL破碎缓冲液(50 mmol/L Tris-HCl、200 mmol/L NaCl,pH 7.0)重悬菌体,200 W超声破碎处理10 min。破碎液在4℃下12 000 r/min离心30 min去除细胞碎片,收集上清液。
1.2.3 ScGAD酶活力测定总反应体系为500 μL,其中490 μL为底物缓冲液(0.2 mmol/L的乙酸-乙酸钠缓冲液,含0.04 mmol/L PLP、100 mmol/L L-谷氨酸),10 μL为酶液。在60℃反应5 min,沸水浴5 min终止反应。采用高效液相色谱法测定反应生成的GABA的含量。在测定条件下每分钟生成1 μmol GABA所需的酶定义为1个酶活力单位(U)。
1.2.4 ScGAD的纯化及蛋白质质量检测表达载体含有组氨酸标签,使用Ni2+亲和层析法进行纯化。加入8 mL平衡缓冲液(50 mmol/L Tris-HCl、200 mmol/L NaCl、5 mmol/L咪唑,pH 7.0)进行平衡,将粗酶液加载入镍离子亲和层析柱,反复上样2次,加入8 mL清洗缓冲液(50 mmol/L Tris-HCl、200 mmol/L NaCl、50 mmol/L咪唑,pH 7.0)清洗层析柱2次,以去除杂蛋白质;加入8 mL洗脱缓冲液(50 mmol/L Tris-HCl、200 mmol/L NaCl、250 mmol/L咪唑,pH 7.0)洗柱1次,收集洗脱液。采用SDS-PAGE(5 g/dL聚丙烯酰胺浓缩胶、12 g/dL分离胶)检测ScGAD的纯度,蛋白质质量采用Bradford法测定[20],牛血清白蛋白(BSA)作为标准蛋白质。
1.2.5 ScGAD酶学性质测定
1)最适反应温度及温度稳定性 将反应体系先在不同温度(20~70℃)中预热。后加入10 μL酶液(蛋白质质量浓度0.2 mg/mL)反应5 min,迅速置于沸水浴中5 min终止反应,以最大酶活力为100%。将GAD在不同温度(30~60℃)水浴不同时间(0.5~6.0 h),在0.5、1.0、2.0、3.0、4.0、5.0、6.0 h进行取样测定酶活力。以0 h时的酶活力为100%,测定ScGAD在不同温度下的残余酶活力。
2)最适反应pH及pH稳定性 以最大酶活力为100%,在pH 2.4~7.0的缓冲液中分别加入酶液测定酶活力。将GAD酶液在不同pH缓冲液中(3.0~10.0),4℃条件下孵育12 h,调节pH至最适条件下测定酶活力,以孵育0 h处理的酶活力为100%,分别计算ScGAD在不同pH孵育后的残余酶活力。
3)金属离子对酶活力影响 在反应体系中分别加入终浓度5 mmol/L的金属离子Ca2+、Mg2+、Fe2+、Mn2+、Ba2+、Na+、K+、Zn2+、Cu2+测定酶活力,以不添加金属离子(对照组)的酶活力作为100%。
4)酶的动力学参数测定 在最适条件下,配置不同底物浓度(2~20 mmol/L)的缓冲体系,分别加入10 μL酶液反应5 min,测定不同底物浓度下的酶活力,使用Lineweaver-Burk双倒数作图法作图,计算酶的Km和Vmax。
1.2.6 全细胞制备GABA的最适条件菌悬液制备:用分光光度计测定发酵液在600 nm处的吸光度以确定菌体浑浊程度,并控制在吸光度为5.0后终止发酵。取10%(体积分数)发酵液单独离心烘干后称质量以计算菌体质量,剩余发酵液离心后,加入10%发酵液体积的生理盐水将菌体重悬,用于GABA制备及测定。总反应体系为30 mL,其中全细胞添加量为3 mL菌悬液(含酶量为每克底物100 U,菌体干质量0.13 g)。GABA生成效率计算方法如下式(1):

式 中:y1为GABA生 成 效 率,g/(g·h);m1为 生 成GABA的 质 量,g;m2为 菌 体 干 质 量,g;t为 反 应 时间,h。
1)PLP浓度对全细胞制备GABA的影响 在添加100 mmol/L底物条件下,反应体系中分别加入不同浓度(0~0.10 mmol/L)的PLP反应0.5 h,以不添加PLP的处理为对照组,测定不同PLP浓度对全细胞制备GABA的影响。
2)底物浓度对全细胞制备GABA的影响 在添加0.06 mmol/L PLP条件下,反应体系中加入不同浓度(50~200 mmol/L)底物进行反应,测定不同底物浓度下全细胞制备GABA的效率。
3)pH对全细胞制备GABA的影响 在添加0.06 mmol/L PLP、100 mmol/L底物条件下,反应体系使用 不 同pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5)缓 冲液进行反应,测定不同pH下全细胞制备GABA的效率。
4)温度对全细胞制备GABA的影响 在最适反应体系与最适pH条件下,将反应体系在不同温度(35~65℃)下预热后反应,测定不同温度下全细胞制备GABA的效率。
5)全细胞制备GABA的转化率 在确定最优条件后,将反应体系在0.5~3.0 h内进行反应,测定GABA的转化率,计算方法如下式(2):
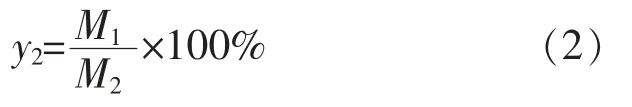
式中:y2为GABA的转化率;M1为生成GABA的浓度;M2为底物浓度。
1.2.7 GABA含量的测定GABA含量的测定使用改进的高效液相色谱法柱前衍生法[21-23],液相柱:Agilent HC-C18柱(4.6 mm×250 mm,0.5 μm)使用丹黄酰氯(1-二甲氨基-萘-5-磺酰氯,DNS-CL)作为衍生剂。衍生体系400 μL,其中待测样品20 μL,碳酸氢钠缓冲液0.1 mol/L(pH 9.8)180 μL,丹磺酰氯-丙酮溶液(4 g/L)200 μL,于37℃下避光反应1 h。流动相:A甲醇,B四氢呋喃-甲醇-50 mmol/L乙酸钠(pH 6.2,体积比5∶75∶420);流量:1 mL/min;进样量:20 μL;柱温:25℃;检测时间:30 min;紫外检测波长:254 nm。
GABA标准曲线如图1所示,线性回归方程为y=8.106 7x-3.030 4,x为GABA浓度,y为信号峰面积,相关系数R2=0.992 8,大于0.990 0,表明自变量与因变量之间的线性关系良好,可用作标准曲线。
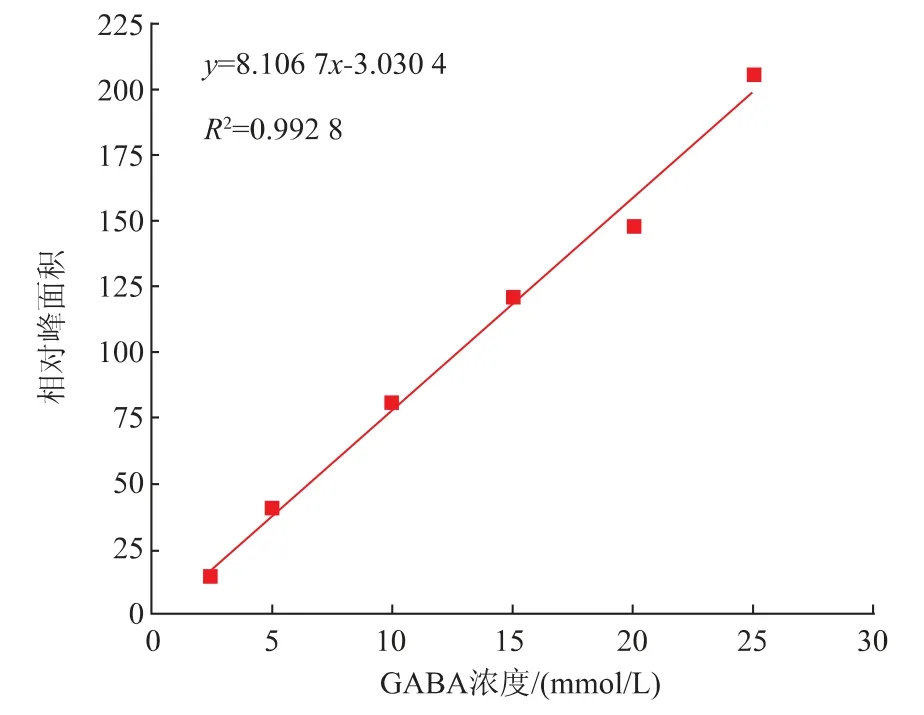
图1 GABA标准曲线Fig.1 GABA standard curve
2 结果与分析
2.1 ScGAD的纯化及SDS-PAGE分析
根据酿酒酵母全基因组序列进行GAD基因克隆,编码基因长度为1 755 bp,无内含子,总计585个氨基酸,蛋白质理论相对分子质量约为65 000。进一步构建重组表达载体pET-21a(+)-GAD,并在E.coli BL21(DE3)中异源表达,其酶活力为2.06 U/mL。通过Ni2+亲和层析纯化单一电泳条带(见图2),与预测GAD相对分子质量大小一致。纯化结果如表1所示。经亲和纯化后,纯酶的回收率为65.3%,提高倍数为13.80倍,比活力为66.55 U/mg。
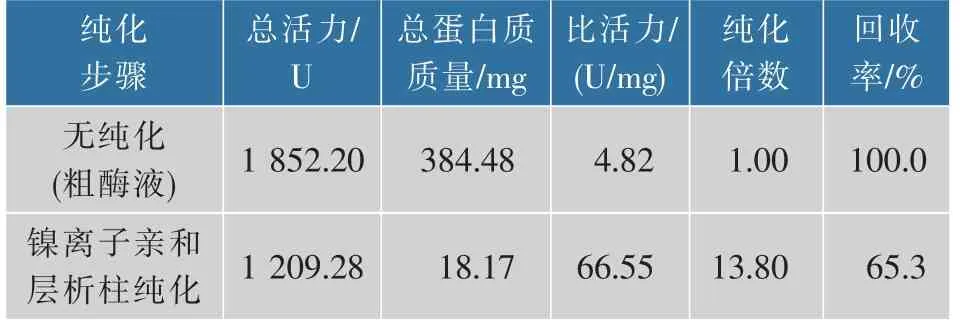
表1 ScGAD的分离纯化Table 1 Separation and purification of ScGAD

图2 pET-21a(+)-ScGAD纯化产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of pET-21a(+)-ScGAD purified product
2.2 ScGAD的酶学性质研究
2.2.1 ScGAD的最适反应温度及温度稳定性不同温度下检测酶活力发现(见图3),ScGAD的最适反应温度为60℃。在20~60℃时,随着温度升高,酶活力逐渐升高;当温度超过60℃后,酶活力急剧下降。进一步对酶的温度稳定性进行分析发现,ScGAD在30~50℃条件下,5.0 h内仍具有约80%残余酶活力;而60℃条件下,酶活力下降较快,6.0 h孵育反应后,仅有20%的残余酶活力。以上研究结果表明,ScGAD具有优越的温度稳定性,对工业加工的应用前景良好。
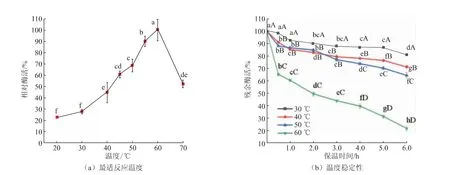
图3 ScGAD的最适反应温度及温度稳定性Fig.3 Optimal temperature and thermostabiligy of ScGAD
2.2.2 ScGAD的最适pH及pH稳定性通过测定不同pH下的相对酶活力发现,ScGAD的最适反应pH为4.0(见图4)。在pH 2.4~4.0时,酶活力随着pH的升高逐渐升高;在pH 4.0~5.6时酶活力随着pH的升高缓慢下降。当pH接近中性时,相对酶活力从50%急剧下降至无活性。该酶的最适pH与其他来源的谷氨酸脱羧酶的最适pH基本一致[24-25],原因是微生物来源的GAD在酸性范围内具有活性,酶促反应过程需要消耗溶液中的H+以催化底物脱羧生成GABA,当溶液接近中性时,反应体系中H+变少,无法完成底物催化,而过低的pH环境会引起酶变性失去酶活[26]。pH稳定性研究结果表明,GAD在pH 4.0~9.0具有良好的稳定性,经12 h孵育反应,仍能保持70%以上残余酶活力,其中pH为5.0时,ScGAD的酶活性最稳定。
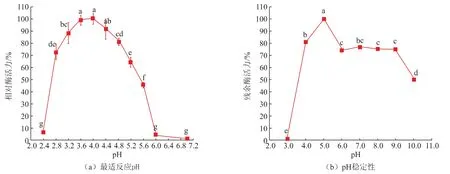
图4 ScGAD的最适反应pH及pH稳定性Fig.4 Optimal pH,pH stability of ScGAD
2.2.3 金属离子对ScGAD的影响通过测定金属离子对ScGAD的影响发现(见表2),Mg2+、Fe2+、Cu2+会抑制该酶10%~15%的酶活力,而其他金属离子对酶活力的影响较小,几乎没有促进或抑制作用。因此,后续GAD的工业应用中不需要额外添加金属离子,可节约生产成本。
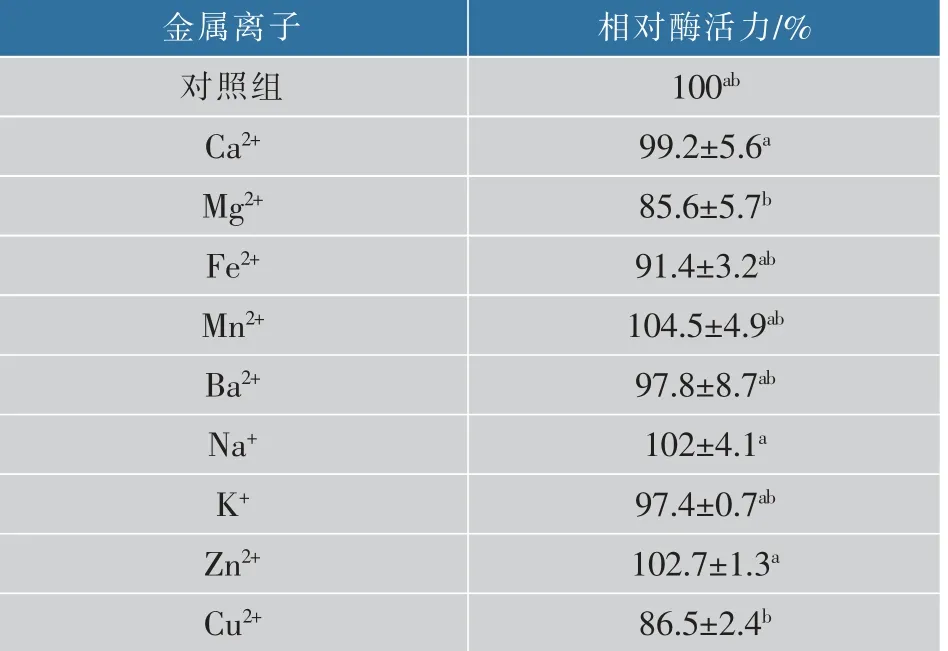
表2 金属离子对ScGAD相对酶活力的影响Table 2 Effects of metal ions on the relative activity of ScGAD
2.2.4 ScGAD的动力学参数研究进一步对ScGAD进行酶促动力学分析,使用Lineweaver-Burk双倒数作图,计算重组酶对底物L-谷氨酸的Km和Vmax,结果如图5所示,米氏常数Km为14.28 mmol/L,最大反应速度Vmax为0.59 mmol/(L·min)。
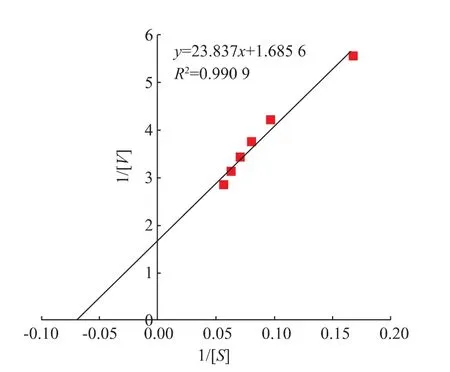
图5 ScGAD动力学参数测定曲线Fig.5 Kinetic parameters of ScGAD
2.3 全细胞制备GABA的最适条件探究
2.3.1 PLP浓度对全细胞制备GABA的影响PLP作为辅酶可与底物L-谷氨酸结合形成Schiff碱结构,该结构可以降低谷氨酸脱羧反应的活化能,从而提高酶促反应速率[27]。通过考察PLP对GAD催化反应的影响发现,添加0.10 mmol/L PLP对GABA生成效率提升最高,是无添加PLP对照组的8倍,可以达到16.7 g/(g·h)(见图6)。而PLP添加浓度在0.06~0.10 mmol/L时,GABA的生成效率变化不大,综合考虑PLP添加成本,最终选取PLP浓度为0.06mmol/L添加至全细胞反应体系。
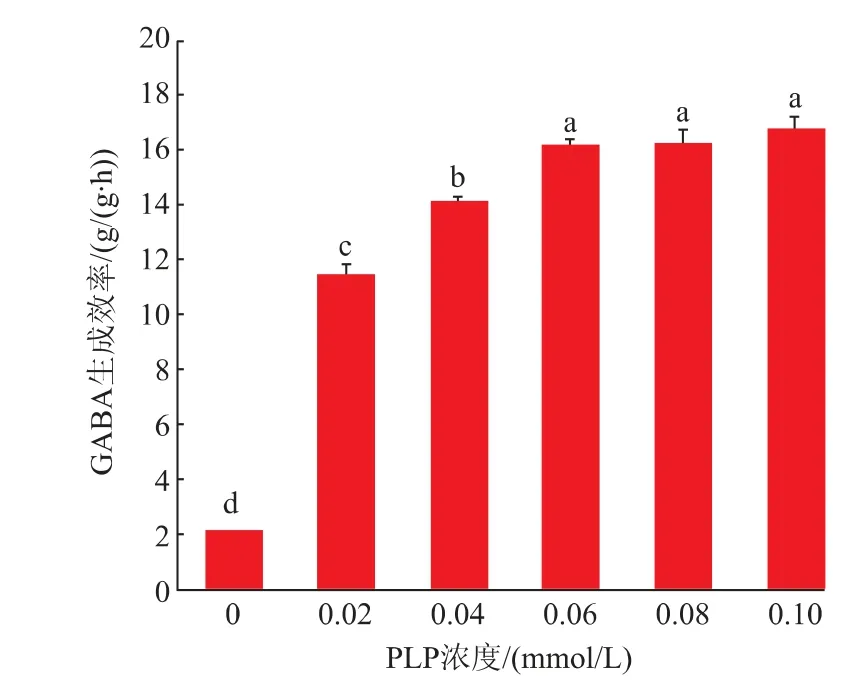
图6 PLP浓度对全细胞制备GABA的影响Fig.6 Effects of PLP concentration on the production of GABA in whole cells by ScGAD
2.3.2 底物浓度对全细胞制备GABA的影响GABA制备过程中底物浓度变化可能会影响细胞膜两侧的渗透压,进而影响GABA生成效率,因此需要考察不同底物浓度对GABA制备过程的影响。如图7所示,当浓度小于100 mmol/L,随着底物浓度的增大,产物的生成效率逐渐提高,且在浓度为100 mmol/L,达到最大生成效率22.2 g/(g·h)。而浓度超过100 mmol/L,GABA生成效率呈现逐渐下降趋势,这可能是ScGAD的催化反应存在底物抑制或过高的环境渗透压抑制底物转运的原因,因此反应体系中过高的底物浓度会影响细胞对于底物的转运[28]。
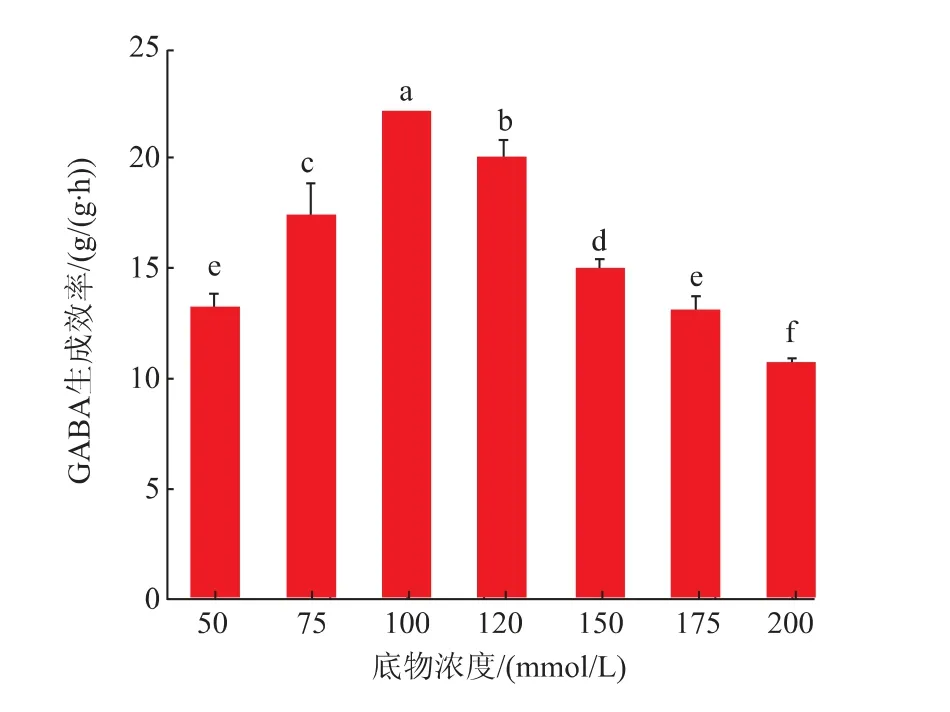
图7 底物浓度对全细胞制备GABA的影响Fig.7 Effects of substrate concentration on the production of GABA in whole cells by ScGAD
2.3.3 pH对全细胞制备GABA的影响ScGAD是一种酸性酶,因此考察pH对GAD制备GABA的影响十分必要。如图8所示,在pH 3.0~5.5时,GABA生成效率均较高,其中pH为4.0时生成效率最高,达到28.8 g/(g·h)。这说明GAD可在宽泛pH范围内制备GABA,满足工业应用中复杂多变的pH条件。
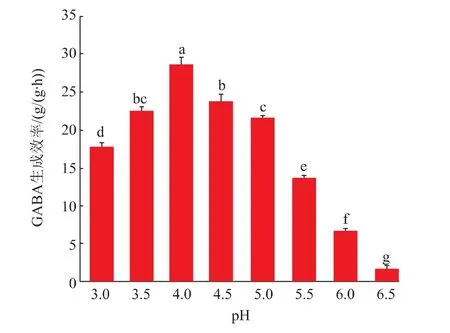
图8 pH对全细胞制备GABA的影响Fig.8 Effects of pH on the production of GABA in whole cells by ScGAD
2.3.4 温度对全细胞制备GABA的影响温度是影响GABA制备的重要因素之一,通过研究温度对ScGAD全细胞制备GABA的影响发现,在35~50℃下,GABA生成效率均较低,最高仅能达到6.5 g/(g·h),而催化温度在55~65℃时,GABA生成效率均较高,且在60℃下产物的生成效率最高达到35.9 g/(g·h)(见图9)。因此60℃为GAD的最适反应温度,反应温度低于60℃,GAD相对酶活力低导致催化效率低,而反应温度高于60℃,重组酶的稳定性受到影响。以上研究结果证明重组酶可在高温下高效合成GABA。
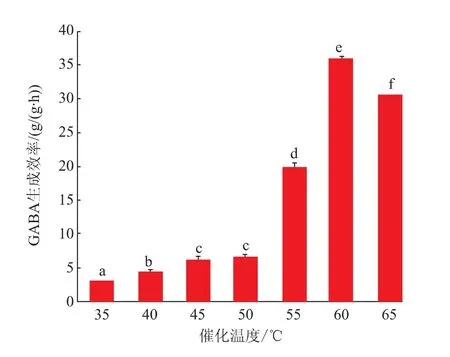
图9 温度对全细胞制备GABA的影响Fig.9 Effects of temperature on the production of GABA in whole cells by ScGAD
2.3.5 全细胞制备GABA的转化率在确定最优条件后,通过研究反应时间对ScGAD全细胞制备GABA的转化率发现,在0.5~2.5 h时,随着反应时间的增加,GABA转化率逐渐提高,但提高幅度逐渐变慢,可能原因是酶在60℃时稳定性随着时间的延长逐渐下降,当反应时间达到2.5 h时,GABA的转化率达到99%,产量为10.3 g/L,并随着反应时间的延长不再变化(见图10)。以上研究结果说明重组酶可在较短的时间内高效合成GABA。
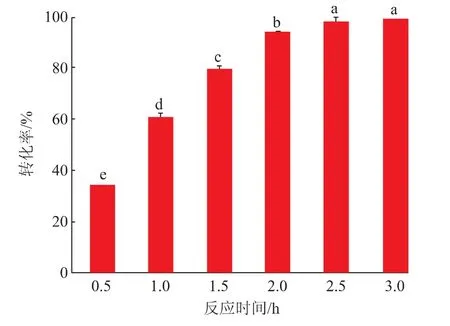
图10 反应时间对全细胞制备GABA的影响Fig.10 Effects of reaction time on the preparation of GABA in whole cells by ScGAD
3 讨论
近年来,谷氨酸脱羧酶因其可应用于功能性物质GABA生产已成为研究热点之一。虽然研究学者们已从多种微生物中挖掘并表征了谷氨酸脱羧酶酶学性质,但这些来源的GAD难以满足工业应用需求。目前有关酿酒酵母谷氨酸脱羧酶研究较少[29],作者通过对酿酒酵母谷氨酸脱羧酶基因进行挖掘,发现该酶的比活力高达66.55 U/mg,显著高于一些微生物来源的GAD的比活力,如植物乳杆菌(Lactobacillus plantarum,比活力37.60 U/mg)[30],以及短乳杆菌Lb85(Lactobacillus brevis,比活力38.46 U/mg)[31]等。
酶学性质研究表明,ScGAD的热稳定较好,在50℃下孵育2 h的残余酶活力高于大肠杆菌谷氨酸脱羧酶在50℃下的残余酶活力(60%)[18],且在30~50℃下孵育5.0 h后残余酶活力仍约为80%。ScGAD的最适反应pH为4.0,这与大部分其他来源的GAD的最适pH为弱酸性相一致[24-25,32]。值得关注的是,ScGAD在pH 4.0~9.0反 应12 h仍 可 保 留70%以上残余酶活力,比其他来源的GAD的pH稳定范围更宽泛[17,33]。因此,本研究中的ScGAD具有良好的热稳定性和宽泛的pH稳定性,有利于其耐受食品加工过程中复杂多变的pH及温度环境,在食品加工领域中具有广阔应用前景。另外,ScGAD的催化反应体系不需要额外加入金属离子,这与巨大芽孢杆菌(Bacillus megaterium)[14]来源的GAD的性质相一致。此外,ScGAD的动力学参数Km为14.28 mmol/L,表明其对底物L-谷氨酸的亲和力显著高于植物来源GAD(米糠GAD,Km为37.30 mmol/L)[34]、(发芽粟谷GAD,Km为22.36 mmol/L)[35]以及微生物来源GAD(短乳杆菌CGMCC1306 GAD,Km为63.70 mmol/L)[19]。总之,ScGAD的优良性质,能够满足食品工业应用的需求,以及对GABA的工业生产具有巨大的应用潜力。
另外,国内外对不同来源的GAD制备GABA也均有研究,李祥从乳酸菌中挖掘到一种谷氨酸脱羧酶LsGAD,其在添加6 g/L的L-谷氨酸后,24 h转化率达到58%[36];田灵芝等对植物乳杆菌来源的谷氨酸脱羧酶IPGAD进行了发酵优化,在5 L发酵体系中,转化24 h,生成GABA 204 g/L,转化率达到97.92%[37]。作者通过全细胞制备GABA的最适条件研究发现,ScGAD的最适催化pH为4.0,这与其他研究者挖掘的其他来源的GAD的研究结果一致[38-39];ScGAD最适催化温度为60℃,而Yang等报道的唾液链球菌来源的酶最适催化温度为55℃[40],这可能是由于GAD的来源不同其性质大不相同;ScGAD反应体系中添加0.06 mmol/L PLP可有效提高GABA生成效率,这与徐林敏的报道研究[41]相一致;在最适催化条件下时,GABA的生成效率可达35.9 g/(g·h),反应2.5 h可将底物催化生成GABA,转化率达到了99%,GABA质量浓度达到10.3 g/L。该产率还有待进一步提升,后续还将进行扩大反应体系以及加入分批补料后的催化研究,同时通过酶分子改造提升其酶催化效率及其工业应用价值。
