基于生殖静脉导引的精准膜解剖经腹腔入路腹腔镜根治性肾切除术35例经验总结
2022-11-23谭伍兵陈晓峰张威邓旺龙孙建明吴志坚邹义华
谭伍兵 陈晓峰 张威 邓旺龙 孙建明 吴志坚 邹义华
根治性肾切除术是公认的可能治愈肾癌的方法,对于不适合行肾部分切除术的T1a期肾癌以及临床分期T1b期、T2期的局限性肾癌患者,根治性肾切除术为首选的治疗方式[1]。国内外多项研究证实,腹腔镜手术治疗局限性肾癌安全可行,其肿瘤控制效果、无复发生存率和总生存率与开放手术类似,且腹腔镜手术凭借术中出血少、术后恢复快等优势[2-5],已逐步成为治疗局限性肾癌的主流术式,其手术入路有经腹腔和经腹膜后两种。经腹腔入路手术需要充分游离肠管、肝脏或脾脏以增加手术视野,且在处理肾动脉方面略显困难[6],国内泌尿外科医师多习惯经腹膜后入路手术。2018年以来,我们通过技术创新与改良,充分发挥经腹腔入路手术的优势,克服其短板,按照生殖静脉导引肾静脉的技术路线,运用膜解剖技术精准分离肾脏周围无血管平面,将经腹腔入路腹腔镜根治性肾切除术的手术步骤标准化、程序化,效果满意。
对象与方法
一、临床资料
纳入2018年1月至2021年6月于郴州市第一人民医院泌尿外科行经腹腔入路腹腔镜根治性肾切除术的患者35例,所有患者术前均行腹部CT或MRI平扫和增强检查,临床诊断为肾癌。排除既往有腹部手术史、合并MayoⅠ级以上下腔静脉瘤栓、孤独肾的肾癌、双肾癌、对侧肾功能代偿不全患者、合并严重心肺功能障碍无法耐受全身麻醉和过度肥胖者。患者年龄43~81岁,平均(57.9±9.6)岁;男22例,女13例;肿瘤直径3.6~10.6 cm,平均(6.5±1.8)cm;左肾肿瘤19例,右肾肿瘤16例;术前临床分期:cT1aN0M01例,cT1bN0M013例,cT2aN0M010例,cT2bN0M09例,cT3aN0M01例,cT3aN0M11例。
二、手术方法
1.术前准备:术前行抗血小板聚集治疗者暂停7~10 d,换用肝素皮下注射桥接治疗,并于术前12 h停用。术前12 h禁食,使用磷酸钠盐口服液清除肠道内容物,术前4 h禁饮,麻醉前留置胃管持续胃肠减压。术前30 min预防性使用抗菌药物静脉滴注,手术时间超过3 h者术中追加1次。
2.麻醉和体位:气管插管全身麻醉,取70°左右健侧斜仰卧位。
3.操作通道的建立:于脐旁2横指纵行切开皮肤3 cm,逐层切开浅筋膜、腹直肌前鞘,撑开腹直肌,切开腹直肌后鞘和壁腹膜约5 mm小孔,置入10 mm Trocar,用于放置腹腔镜镜头;设定气腹压力12~14 mmHg,腹腔镜监视下于锁骨中线肋缘下20 mm、髂前上棘内上方2横指处置入10 mm或12 mm Trocar(右手操作通道置入12 mm Trocar),可按需增加5 mm辅助通道抬举肝脏或牵开肠管。
三、手术步骤
1.建立并扩大肾前筋膜平面,显露肾静脉前壁:①左侧步骤:离断乙状结肠与壁腹膜之间的粘连带,于降结肠外侧黄白交界线处(Toldt’s线)切开侧腹膜,进入肾前筋膜与降结肠“外科系膜”之间疏松的融合筋膜间隙(Toldt’s间隙),顺着肾前筋膜平面充分扩大Toldt’s间隙,脚端达输尿管跨髂血管处,头端达肾前筋膜与胰腺后筋膜之间无血管平面(图1)。离断脾结肠韧带、脾膈韧带、部分脾肾韧带,将脾脏、胰腺向内上方翻转,继续扩大肾前筋膜平面达膈下。顺着左侧生殖静脉向近心端追踪至左肾静脉(图2),切开肾静脉鞘显露肾静脉前壁。②右侧步骤:切断肝肾韧带、肝结肠韧带及部分右侧三角韧带,经剑突旁5 mm辅助通道置入持针器托举肝脏,持针器夹持膈下壁腹膜并上锁扣固定。于升结肠外侧黄白交界线处(Toldt’s线)切开侧腹膜,进入肾前筋膜与升结肠“外科系膜”之间疏松的融合筋膜间隙(Toldt’s间隙),顺着肾前筋膜平面充分扩大Toldt’s间隙,脚端达输尿管跨髂血管处,头端达肾前筋膜与十二指肠降部后筋膜之间无血管平面,显露下腔静脉外侧缘及右侧生殖静脉开口(图3),夹闭、离断右侧生殖静脉,顺着下腔静脉外侧缘向近心端追踪至右肾静脉开口,切开肾静脉鞘显露肾静脉前壁。
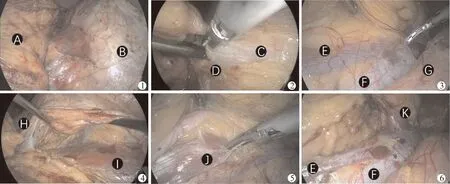
图1 建立左侧肾前筋膜与胰腺后筋膜之间无血管平面(A:胰腺及其被膜;B:左侧肾前筋膜)
2.建立并扩大腰肌筋膜平面(图4、5):于输尿管与髂血管交叉处切开肾前筋膜,提起输尿管进入输尿管周围脂肪与腰肌筋膜之间无血管平面,左侧顺着髂总动脉与腹主动脉外侧缘、右侧顺着下腔静脉外侧缘将腰肌筋膜平面首先由下向上扩大至肾蒂附近,然后由内向外扩大至腰肌外缘(肾后筋膜与腰肌筋膜融合边缘)。
3.处理肾动静脉(图4、6):助手经辅助通道将输尿管提起或将肾脏下极挑起,借鉴经腹膜后入路的角度将30°腹腔镜由后向前观察肾蒂,于肾静脉后方、腰肌筋膜前方游离出肾动脉,先后夹闭、剪断肾动脉、肾静脉,扩大腰肌筋膜平面、膈肌筋膜平面达膈下。
4.处理肾上腺:拟保留肾上腺的患者于肾上腺外侧缘切开肾前筋膜,于肾上腺实质与肾上腺周围脂肪之间隙向背侧分离至膈肌筋膜平面,尽量切除肾上腺周围脂肪。需要切除肾上腺的患者则于肾上腺内侧缘切开肾前筋膜,向背侧分离达膈肌筋膜平面,右侧还需离断肾上腺中央静脉。
5.处理输尿管及肾脏外侧缘:于跨髂血管高度离断输尿管及生殖静脉远心端,于肾周筋膜外分离肾脏外侧缘,于腰肌筋膜外缘由下向上切开肾后筋膜直至膈下。
6.取出标本:将标本装袋,延长腹直肌外侧缘切口,取出标本,留置腹腔引流管。
四、术后处理
若无肠道损伤则全身麻醉苏醒后拔除胃管,术后不使用静脉镇痛泵,采用视觉模拟评分(visual analogue scale, VAS)对患者进行疼痛评估,若疼痛难以耐受(VAS≥7分)则使用非甾体类镇痛药肌肉注射或直肠内给药。待肠鸣音恢复且无腹胀、呕吐后即可进食。
五、观察指标
记录患者手术时间、术中出血量、输血情况、周围脏器损伤情况、术后病理类型、术后并发症、术后VAS评分、肠鸣音恢复时间和术后住院时间。出院后随访采用门诊复查和电话随访。每3~6个月随访1次,连续3年,以后每年随访1次至术后5年,5年后每2年随访1次。随访内容包括病史询问、体格检查、血常规、血生化以及影像学检查。
六、统计学方法
结 果
35例患者均顺利完成手术,除1例转移性肾癌行减瘤性肾切除同时切除同侧肾上腺外,其余34例均保留同侧肾上腺,手术时间120~200 min,平均(150.5±20.3)min;术中出血量30~300 ml,平均(45.5±9.2)ml;无术中、术后输血病例,无周围脏器损伤病例;术后病理类型:肾透明细胞癌22例,乳头状肾癌5例,嫌色性肾细胞癌4例,黏液样小管状和梭形细胞癌2例,未分类的肾细胞癌2例;术后病理分期:pT1aN0M01例,pT1bN0M012例,pT2aN0M010例,pT2bN0M08例,pT3aN0M03例,pT3aN0M11例;术后肠鸣音恢复时间1.0~2.5 d,平均(1.5±0.4)d;术后早期出现1例不完全性粘连性肠梗阻,经非手术治疗后肠道功能恢复;术中、术后无严重并发症发生;术后住院时间5.0~10.0 d,平均(7.2±1.5)d;术后VAS评分1~7分,平均(3.1±1.1)分;术后1例失访,1例转移性肾癌行减瘤性肾切除术后靶向药物治疗无效死亡,其余33例均获随访,随访6~45个月,中位随访时间21个月,暂无局部复发与远处转移。
讨 论
经典的肾癌根治术切除范围应包括患肾、肾周筋膜、肾周脂肪、同侧肾上腺、从膈肌脚到腹主动脉分叉处腹主动脉或下腔静脉旁淋巴结以及髂血管分叉以上输尿管[1],目前研究显示,若术前影像学检查未见肾上腺异常且术中探查未发现肾上腺异常,则无需常规切除同侧肾上腺。经腹膜后入路腹腔镜根治性肾切除术为了保持腹膜的完整性、维持足够的腹膜后操作空间,往往会打开肾周筋膜,在肾前筋膜与肾周脂肪之间的无血管平面分离腹侧平面,导致肾前筋膜不能彻底切除[7],对pT3aN0M0的患者术前可能因低判临床分期而导致肿瘤残留,本组中cT1b与cT2b患者各1例经术后病理证实肿瘤累及肾周脂肪而修正为pT3a,若选择经腹膜后入路手术则可能出现切缘阳性。而经腹腔入路腹腔镜根治性肾切除术则能切除更完整的肾周筋膜和肾周脂肪[8],对侵犯肾脏腹侧脂肪囊的T3aN0M0患者同样可以达到根治效果,更符合恶性肿瘤手术的根治性原则。
相对经腹膜后入路而言,经腹腔入路操作空间大、解剖标志清晰、Trocar穿刺点选择范围大、可根据需要增加辅助通道以及对术中出血、周围脏器损伤等并发症的处理更方便[9],更适合于相对复杂肾癌病例,如大体积肾肿瘤、肾门解剖结构复杂的病例以及合并腔静脉瘤栓的患者。除此之外,我们体会到经腹腔入路手术还有以下优势:①术者与助手站位及操作器械活动范围更符合人体工程学原理,术者与助手感觉更舒适;②较少损害肋间神经或肋下神经,术后发生神经痛及腹壁膨出几率小;③术中无需过多挤压肾脏或瘤体,更符合无瘤原则;④取标本时不需要切断腰部肌肉,取出标本和关闭切口所用时间短,术后疼痛轻微,符合加速康复外科要求。
近年来,我国胃肠外科专家系统地阐述了膜解剖相关理论及其在胃肠道肿瘤根治术中的运用[10-11],从胚胎期中胚层演变过程阐明了膜的起源,认为膜解剖是指广义的系膜与系膜床的解剖,由筋膜和(或)浆膜构成。几乎每个器官都有膜,在实质脏器以“门”或“蒂”的形式呈现,而在空腔脏器却表现为形态多样的“系膜”,膜包围器官或组织及其所属血管、淋巴脂肪组织,形成“组织板块”。癌细胞的转移途径除直接蔓延、淋巴道转移、血行转移、种植性转移外,还存在“系膜内脂肪间的转移”-“第五转移”。相邻器官或组织所属筋膜之间的无血管层面被认为是膜解剖的“神圣层面”,只有通过“神圣层面”整块切除肿瘤才能实现真正意义上的根治性切除,并最大程度地避免对周围脏器的损伤。
Toldt’s线是经腹腔入路进入肾前筋膜平面重要的解剖标志,从胚胎学角度来看,Toldt’s线为结肠系膜在发育过程中与后外侧腹壁的融合边界,从解剖学角度来看,Toldt’s线为结肠系膜内黄色脂肪与侧腹壁白色结缔组织之间的分界线。本研究中,沿Toldt’s线切开侧腹膜即可准确进入肾前筋膜与结肠系膜之间疏松平面,在建立和扩大肾前筋膜平面以后,顺着腹主动脉或下腔静脉外侧缘切开肾前筋膜,以此作为切除范围的内侧界,切除范围下界为输尿管跨髂血管高度,上界为肾前后筋膜融合缘与膈下筋膜相连接处,外侧界为肾前后筋膜缘与腹横筋膜相连接处,后界为腰肌筋膜平面。由于肾后筋膜与腰肌筋膜融合紧密,因此肾后筋膜无法彻底切除,需在腰肌筋膜与肾周脂肪之间无血管平面向外侧分离至肾后筋膜与腰肌筋膜融合边缘,切开肾后筋膜到达肾周筋膜外平面,将肾脏后方平面与外侧平面沟通,实现精准、整块切除患肾、肾周脂肪和肾周筋膜。
肾动静脉的处理是经腹腔入路根治性肾切除术的关键技术之一,我们认为以下几点有助于肾动静脉的显露与处理:①取70°左右健侧斜仰卧位,充分分离Toldt’s间隙,结肠及其系膜因重力自然下垂,不会干扰术野。②于脐旁2横指处置观察镜所得视野较脐孔边缘置观察镜的视野更佳。③在肾前筋膜平面建立后,顺着左侧生殖静脉向近心端追踪可准确到达左肾静脉(右侧生殖静脉多汇入下腔静脉,继续向近心端追踪直至右肾静脉开口),早期显露的肾静脉可作为后续定位肾蒂的解剖标志,还可避免游离肾动脉时肾门处迷走血管损伤出血而影响肾静脉的识别。④在显露与处理肾动脉之前建立并充分扩大腰肌筋膜平面,助手经辅助通道将输尿管提起或将肾脏下极挑起,30°腹腔镜借鉴经腹膜后入路的角度观察肾蒂,适当切开位于腰肌筋膜前方的肾蒂淋巴脂肪组织,便可见到明显搏动的肾动脉。若不慎伤及肾血管导致腹腔镜下难以控制的出血,可使用无损伤血管钳将位于肾前筋膜与腰肌筋膜之间的肾蒂血管集束钳夹控制出血,为中转开放手术赢得宝贵的时间。⑤术前仔细阅片了解肾血管走形及变异情况,对肾血管复杂的病例,建议行CT血管重建。⑥若肾动脉阻断后肾静脉未完全塌陷而处于充盈状态,需警惕多支肾动脉供血或肾静脉瘤栓可能,应及时改变手术策略。
本研究显示,基于生殖静脉导引肾静脉的技术路线可快速、准确定位肾蒂,避免误伤肾静脉及其属支血管。运用膜解剖技术精准分离,充分发挥腹腔镜下肾脏周围解剖结构清楚、组织层次分明的优势,可保证少血或无血手术视野,为安全根除肿瘤、提高手术效率以及减少周围器官损伤提供有力保障,值得在临床上推广应用,但其远期疗效还需要更大样本、更长时间随访的前瞻性随机对照研究进一步证实。