肾移植后胰岛移植治疗2 型糖尿病1 例
2022-11-21刘婷婷陈旭春牛猛王树森王晓黎鲍志野孙赫李弘刘文师韩阳刘永锋程颖
刘婷婷,陈旭春,牛猛,王树森,王晓黎,鲍志野,孙赫,李弘,刘文师,韩阳,刘永锋,程颖
(1.中国医科大学附属第一医院器官移植暨肝胆外科,辽宁沈阳 110001;2.中国医科大学附属第一医院介入科,辽宁 沈阳 110001;3.天津市第一中心医院移植中心,天津 300192;4. 中国医科大学附属第一医院内分泌科,辽宁沈阳 110001;5.中国医科大学附属第一医院病理科,辽宁 沈阳 110001)
胰岛移植和胰腺移植是公认的治疗糖尿病较为理想的手段和方法,鉴于中国医科大学附属第一医院胰腺、胰岛移植治疗胰岛素依赖的2 型糖尿病经验[1-3], 2022 年4 月本院为1 例2 型糖尿病合并慢性肾功能衰竭的患者行肾移植后胰岛移植(islet after kidney transplant,IAK)治疗,现报道如下。
1 资料与方法
1.1 临床资料:2 型糖尿病患者1 例,女性,59 岁,糖尿病病程20 余年,术前应用胰岛素10 余年,血糖控制不达标,5 年前开始出现血压增高伴有尿蛋白阳性,诊断为糖尿病肾病,未系统治疗。9 个月前因周身水肿就诊,化验血清肌酐1000 μmol/L 左右,进展至慢性肾病5 期,开始规律血液透析治疗,血清肌酐波动在350 ~600 μmol/L。2022 年1 月19 日于本院行同种异体肾移植术治疗,术前尿量约500 ml/d,胰岛素用量0.57 U/(kg·d)。肾移植免疫诱导采用兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte immunoglobulin,rATG),维持免疫采用他克莫司、吗替麦考酚酯、泼尼松联合的方案。术后患者移植肾功能恢复顺利,术后3 d 血清肌酐降至正常,尿量2000 ~ 2500 ml/d。规律于门诊随访,监测肾功能、他克莫司血药谷浓度等,逐渐下调他克莫司及强的松用量,无感染、急性排斥反应、血管并发症以及急性排斥反应等事件发生。但肾移植术后患者血糖逐渐升高,外源胰岛素用量达到1.26 U/(kg·d),空腹血糖7 ~8 mmol/L,餐后血糖12 ~20 mmol/L。肾移植术后3 个月(2022 年4 月23 日)于本院行胰岛移植治疗。
供者临床资料:女性,35 岁,供者的体重指数(body mass index,BMI)为24 kg/m2,心脏死亡器官捐献 (donation after cardiac death,DCD),器官捐献时供者的血糖水平及肝肾功能正常,无糖尿病病史。供受者的ABO 血型相同,人类白细胞抗原(human leukocyte antigen, HLA)配型3 点错配,受者的群体反应性抗体(panel reactive antibodies,PRA)为阴性,供胰腺质量为100 g,热缺血时间为5 min,冷缺血时间为6 h。供者家属及受者签署知情同意书,符合相应法律规定及医学伦理学规定。
1.2 方 法
1.2.1 胰岛细胞的分离和纯化:应用改进的腹部器官联合快速切取技术获取供胰腺,使用3 层无菌器官保存袋盛装供胰,采用UW 液冷保存,放置于 4℃器官保存箱中运送至天津市第一中心医院胰岛分离实验室,该实验室获得药品生产质量管理规范(good manufacturing practices,GMP) 认证。无菌台修整供胰,采用三管法进行灌注膨胀,消化酶为Liberase,置于37℃下的Ricordi 系统中进行消化,使用COBE 2991 型细胞分离机连续密度梯度离心纯化胰岛。将纯化的胰岛产物悬浮于300 ml 培养液中,在移植前加入肝素(70 U/kg)。
1.2.2 胰岛细胞的计数和评估:① 胰岛细胞计数以及纯度鉴定。于胰岛样本中加入双硫腙,在倒置显微镜下观察,胰岛细胞呈猩红色(图1)。统计不同直径胰岛的数量并计算本次实验收获的胰岛当量(IEQ)及纯度。② 胰岛活性的鉴定。应用吖啶橙/溴化乙啶(AO/EB)染色并计数活细胞的百分比。③ 胰岛功能的鉴定。取10 当量胰岛,分别用含终浓度为2.8 mmol/L 和 16.7 mmol/L 葡萄糖的Kreb-Hanks液孵育1 h,收集第1 小时和第2 小时的培养液,利用全自动标记免疫分析系统(美国雅培AxSYM 系统)检测培养液中胰岛素的含量,并计算胰岛素释放指数(insulin release index,SI):SI=第2 小时(高糖环境,即葡萄糖浓度为16.7 mmol/L)的胰岛素含量/第1 小时(低糖环境,即葡萄糖浓度为2.8 mmol/L)的胰岛素含量。④ 病原学检査。采集胰岛分离和纯化过程中各个环节产物的样本进行病原学及内毒素检测。
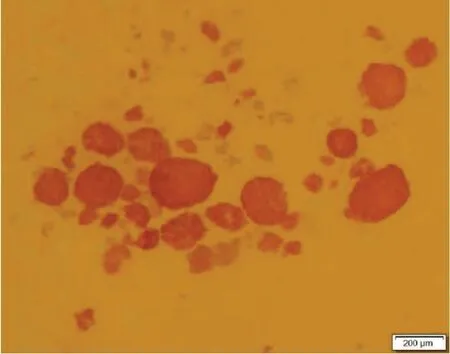
图1 分离纯化过程中胰岛细胞
1.2.3 胰岛移植:采用经TIPS 入路:采用射介入的方法,经颈内静脉插入穿刺导管,通过肝右静脉,在肝实质内穿刺门静脉右支,建立门体通道,置管入门静脉主干,造影确认门静脉及其分支形态(图2),输注胰岛细胞前测量门静脉压力为3 mmHg(1 mmHg=0.133 kPa)。利用重力匀速、缓慢地输注胰岛悬液至受者的肝脏内。输注过程为25 min,胰岛移植后门脉压为 16 mmHg,门脉造影显示肝内门静脉及分支充盈良好,较移植前无明显变化。移植过程顺利。
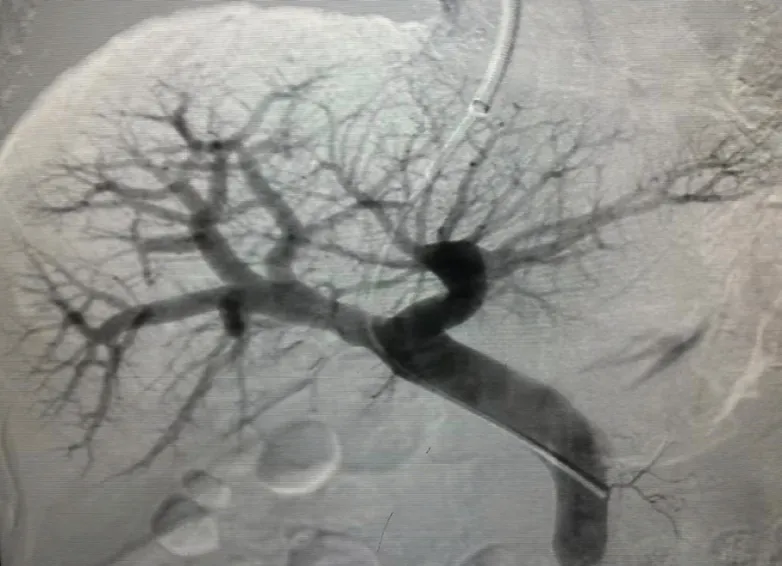
图2 TIPS 入路门静脉插管造影
1.2.4 免疫抑制治疗方案:免疫诱导应用巴利昔单抗(于术前即刻、术后第4 天分别给予20 mg,共2 次)。联合应用依那西普 〔肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) 抑制剂〕(术前即刻给予50 mg,术后第3 天、第7 天分别再给予25 mg,共3 次)。免疫维持方案继续应用他克莫司和吗替麦考酚酯,他克莫司血药浓度谷值维持在6 ~8 ng/ml。
1.2.5 术后常规治疗:① 抗凝:术后48 h 内持续应用肝素钠抗凝,维持活化部分凝血活酶时间(activated partial thromboplastin time,APTT) 40 ~60 s,术后第3 日开始更换为低分子肝素钙皮下注射,术后第7 日更换为阿司匹林口服。②控制血糖:根据监测血糖结果调整胰岛素用量,维持血糖为6 ~10 mmol/L。降门静脉压力、抑制外分泌功能,术后3 d 应用奥曲肽皮下注射。预防感染治疗。
1.2.6 术后观察项目:外源性胰岛素使用情况,采用动态血糖监测血糖水平、胰岛功能(血清C 肽、血清胰岛素)、糖化血红蛋白水平以及外源性胰岛素使用量。术后当日,每小时测量1 次血糖,术后恢复正常饮食后,监测三餐前、餐后2 h 及睡前血糖。术后定期完善彩色多普勒超声明确肝脏和门静脉系统情况,术后24 h 明确腹腔情况,除外出血等并发症。每周监测胰岛素功能、血常规、肝功能、肾功能及离子,每2 ~3 个月监测糖化血红蛋白。定期监测他克莫司血药谷浓度。
2 结 果
2.1 胰岛分离与纯化结果:供胰成功分离出胰岛,胰岛数量为334 432 IEQ,纯度为38.5%~49.7%,存活率为95%~97%,SI 为2.8 ~5.4。病原学及内毒素检测结果均为阴性。
2.2 受者术后糖代谢情况
2.2.1 血糖及外源胰岛素使用情况:术后当日血糖正常,暂停外源胰岛素;术后1 周内监测空腹血糖波动在4.8 ~8.5 mmol/L,餐后血糖为6.9 ~15.1 mmol/L(图3),根据血糖调整外源胰岛素用量,术后1 周早餐前外源胰岛素量较术前下降了47.61%,午餐前胰岛素量下降了51.40%,晚餐前下降了53.18%,睡前长效胰岛素下降了19.40%。外源胰岛素总用量较术前下降了50.14%。
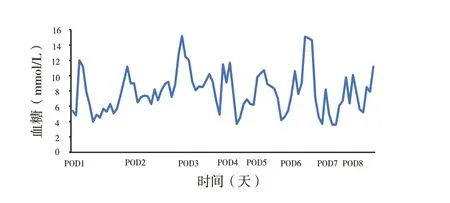
图3 术后1 周血糖情况
2.2.2 糖化血红蛋白与胰岛功能:术后1 周受者的糖化血红蛋白为6.3 %(术前为6.6%)。胰岛功能:术后空腹及餐后C 肽及胰岛素水平较术前均有增长(图4)。术后第 5 天,行胰岛素释放及C 肽释放试验结果 (图5) 提示移植胰岛的功能部分恢复,胰岛素的分泌有节律。
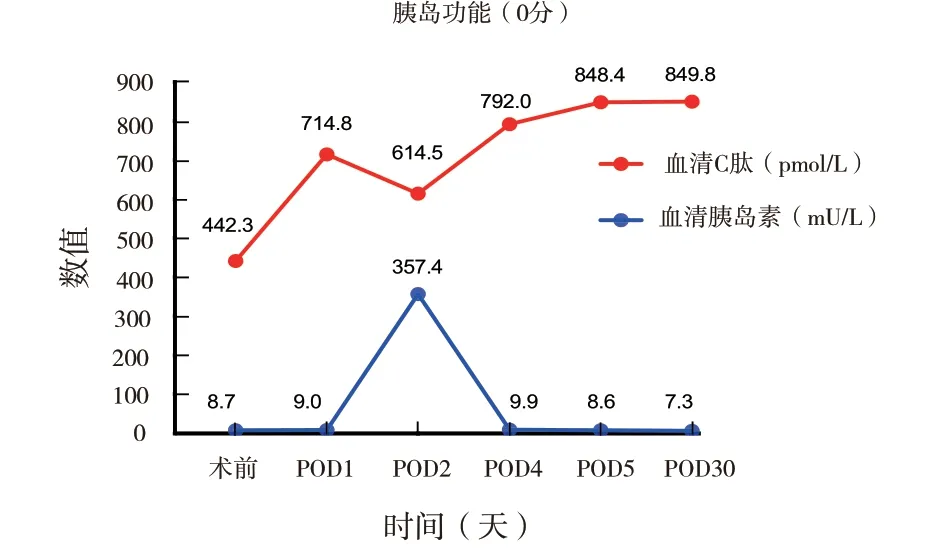
图4 术后1 周空腹胰岛功能
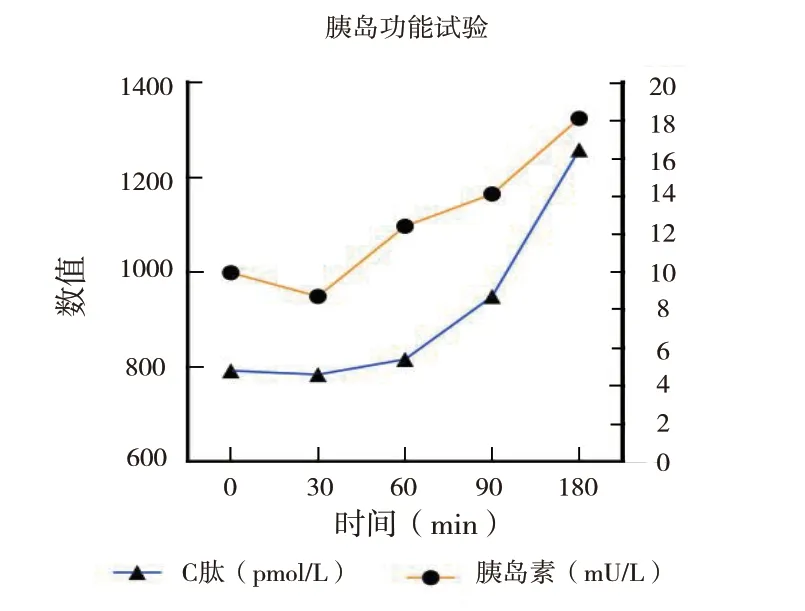
图5 术后1 周胰岛功能实验
2.3 并发症:术中血流动力学稳定,门静脉压有一过性增高,但最高值小于20 mmHg,术后监测肝脏及血管超声无静脉血栓形成、无腹腔出血。连续监测肝肾功能正常,未发生明显低血糖、酮症酸中毒症状,未发生感染、急性排斥反应等并发症。
3 讨 论
随着糖尿病的发病率逐年增高,其已经成为危害人类健康的世界公共卫生问题。据预测,到2025年,全世界至少有5%的人口将会罹患糖尿病[4-5]。
自1921 年人类发现了胰岛素,糖尿病得到了有效的治疗,从而延长了糖尿患者的预期寿命。然而,2 型糖尿病患者是以胰岛素抵抗为主,而且在疾病后期随着胰岛功能的下降,患者需要使用更大剂量的胰岛素和更为复杂的治疗方案。胰岛素用量的不断增加会带来体重增加以及更多的慢性并发症的风险。如何减轻胰岛素抵抗并改善自身胰岛功能,一直是2 型糖尿病的治疗重点和难点。自20世纪60 年代以来,胰腺移植的技术在不断地完善,但是由于其较高的并发症发生率及病死率,只有少数患者从中获益,从而促使了胰岛移植的发展。尤其是2000 年Edmonton 方案的提出,改善了胰岛移植的临床预后,胰岛移植进入一个新的快速发展的阶段[6]。与胰腺移植相比,胰岛移植具有创伤小、手术相关并发症发生率低等优势,是一项相对简单、 安全、有前景的治疗方式。经分离纯化的胰岛细胞输注至受者体内后,有助于恢复生理性胰岛素的分泌模式,建立内源性葡萄糖依赖的胰岛素分泌系统,从而达到实时、精准血糖控制,减少/摆脱外源性胰岛素,延缓并预防糖尿病远期并发症,从而改善受者的生活质量。单独胰腺/胰岛移植(pancreas/islet transplant alone,PTA/ITA)仅适用于无肾脏疾病且伴有危及生命的糖尿病并发症患者,主要是顽固性低血糖意识受损(impaired awareness of hypoglycaemia,IAH)。对于这样的患者,IAH 和昏迷的风险要大于手术和终身免疫抑制的风险。在过去的20 年中,胰岛移植已成为治疗IAH 的理想选择,而且风险较单独胰腺移植明显降低。
此前,本院为13 例胰岛素依赖的2 型糖尿病合并慢性肾功能衰竭的患者实施了胰肾联合移植,效果良好。术后患者能够摆脱胰岛素治疗,C-肽水平及葡萄糖耐量试验正常,且未出现胰岛素抵抗或胰岛素释放高峰延迟现象[7]。基于以上经验,我们提出胰岛素依赖期的2 型糖尿病也是胰腺移植的适应证。在2007 年12 月— 2010 年4 月间,本院为3 例胰岛素依赖期的2 型糖尿病合并慢性肾功能衰竭的患者共实施了4 次胰岛移植[3],其中2 例为胰岛细胞肾联合移植(simultaneous islet kidney transplant,SIK),1 例为肾移植术后5 个月连续2 次接受胰岛移植(2 次胰岛移植间隔9 d)。其中的1 例SIK 受者在术后24 h 内血糖即恢复正常,并停用了外源胰岛素。1 例IAK 受者在第1 次胰岛移植后胰岛素用量减少了50%,在第2 次胰岛移植后停用了胰岛素,术后1 年其糖化血红蛋白波动在5.5%~5.9%。另1 例SPA 受者术后1 年的糖化血红蛋白波动在6.7%~7.3%。本例IAK 受者在胰岛移植术后1 周内外源胰岛素用量比术前下降了50.14%,血清C 肽及胰岛素升高,胰岛功能改善,血糖易于控制。
虽然胰岛移植治疗糖尿病取得了比较理想的效果,目前仍面临较多困难,供器官短缺是全球移植领域的共同难题,严重制约了胰岛移植的开展。因此,改进胰岛分离和纯化技术,将该过程对胰岛细胞的损伤降到最低,改良移植和免疫抑制方案,保护移植物功能,以进一步提高其临床疗效是 DCD 胰岛移植的关键。Edmonton 方案推广以来,从1 例受者需接受至少2 例供体的胰岛细胞来实现胰岛素不依赖,到现在越来越多的移植中心使用单个胰腺移植即能实现长期胰岛素不依赖[8-9]。虽然胰岛移植技术在不断完善,实际上胰岛移植术后5 年胰岛素不依赖率仅为 25%~50%,经验丰富的移植中心可达60%,胰岛移植后5 年的移植物存活率(空腹C 肽>0.3 ng/ml,无严重低血糖发作)为70%[10]。虽然部分受者术后仍需要接受胰岛素治疗,但存活的胰岛移植物能够极大地降低血糖管理的难度和风险,减少低血糖发生率,有利于维持血糖的稳定,从而改善受者的生活质量。
本例单个DCD 供体获得的胰岛细胞数量为334432 IEQ(460000 ~505200 IEQ),纯 度 为38.5%~49.7%,存活率为95%~97%,术后胰岛素用量从88 U/ d, 减少到43 U/ d,减少 50.14%,血糖易于控制,缓解了高血糖症状,增加受者治疗的自信心,拟择期再行胰岛移植治疗达到胰岛素不依赖。
肝脏在胰岛素水平的调节中发挥着重要的作用,它是胰岛素的效应器官,肝脏作为胰岛细胞的移植部位更符合生理[11],而且肝脏血供丰富,胰岛细胞可以在肝窦中更好地存活[12]。门静脉因操作简便、所需胰岛细胞少,成为临床胰岛移植的常规移植部位。本例受者在局麻监护下采用数字减影血管造影(digital subtraction angiography,DSA)引导穿刺颈内静脉经TIPS 入路,穿刺门静脉置管,利用重力缓慢、匀速输注胰岛细胞,术后按压穿刺部位至无出血,无需长时间制动,手术创伤小,术后恢复迅速,术后1 周出院。减少了术后出血的风险。但有研究表明,门静脉系统内的胰岛存在缺氧和不能完全血管化,而β 细胞不耐受缺氧,导致胰岛素分泌减少,尤其是经门静脉胰岛移植有可能造成经血液介导的炎症反应(instant blood mediated inflammatory reaction,IBMIR),一旦发生,会导致移植物在移植后极早期大量丢失[13]。还有可能出现出血、血栓形成、门静脉高压症、门静脉周围脂肪变性等。因此该部位并不是十分理想的胰岛移植部位。其他部位如肾包膜、脾、胰腺、胃肠壁、大网膜、腹膜、肌肉、皮下、眼前房、睾丸、胸腺、骨髓、脑室等亦均有研究[14-15],上述移植部位各有优缺点 ,具体应根据临床可行性、提高移植物存活率、降低并发症、患者接受程度等方面来探讨最佳移植部位。
胰岛移植术后免疫抑制剂的应用,不仅需要抑制自身免疫状态,还要尽可能减少免疫抑制剂对β 细胞的毒性作用。已知钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)类药物和糖皮质激素不仅对胰岛移植物有较大的毒性,而且可诱导发生胰岛素抵抗,降低胰岛移植的成功率。Shapiro 等[16]在2000 年提出的免疫抑制方案明显改善了胰岛移植的预后,该方案采取抗CD25 单克隆抗体作为免疫诱导,将西罗莫司+小剂量他克莫司作为免疫抑制维持方案。在最初的Edmonton 队列中,所有7 例胰岛移植受者在术后1 年均达到了胰岛素不依赖,然而术后5 年胰岛素不依赖仅为10%。于是不断有研究替代性免疫抑制策略来改善长期结果。T 细胞耗竭剂如胸腺细胞球蛋白、抗CD3 和阿来单抗等已被用作替代诱导治疗,并联合使用依那西普,维持免疫采用他克莫司+霉酚酸酯等药物联合[17]。Barton 等[18]对1999 — 2010 年 期 间 接 受1375次胰岛输注的677例受者的数据统计报告表明,与早些年相比,2007 — 2010 年期间长期胰岛素不依赖显著改善,3 年胰岛素不依赖接近50%。该报告还显示,接受T 细胞耗竭剂联合肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抑制剂的受者有更好的3 ~5 年胰岛素不依赖率(62%比43%)。米兰移植中心的一项研究结果表明,胰岛移植不仅有利于血糖的控制,还可以提高肾移植的存活率并改善移植肾功能[19]。肾移植术后的受者已经处于免疫抑制状态, 所以更易于接受胰岛移植。目前尚无胰岛移植导致肾移植失败的报道,结合目前的经验来看,胰岛移植并没有对移植肾产生额外的损伤。本例胰岛移植为肾移植术后满3 个月时完成,此时糖皮质激素已减停,他克莫司减量至2 ~3 mg/d,这就减少了糖皮质激素及CNI 类药物对β 细胞的毒性作用,有利于胰岛移植物的存活,此时建立了比较稳定的免疫抑制剂浓度,降低了胰岛移植术后排斥反应发生率,患者从肾移植手术中充分恢复,脏器功能改善,整体状态良好,对胰岛移植手术接受度高,术后恢复快。本例在肾移植手术前透析期间外源胰岛素用量达0.57 U/(kg·d),在肾移植手术后胰岛移植手术前胰岛素用量达1.26 U/(kg·d),胰岛素用量增高的原因一方面是因为术后糖皮质激素及CNI 类药物导致的胰岛细胞破坏,胰岛素分泌减低,并加剧胰岛素抵抗,另一方面是因为内源性胰岛素通过门静脉入血,主要由肝脏清除,外源性胰岛绕过了肝脏的第一次排泄通过肾脏清除,因此,肾功能直接影响外源胰岛素的代谢,随着肾脏清除率的降低,胰岛素需求减少,另外,尿毒症毒素的蓄积会损害肝脏中胰岛素的降解,延长内源性胰岛素的半衰期,所以透析期间患者对胰岛素的需求下降[20]。虽然目前的研究针对胰岛移植提出了很多的免疫抑制方案,但最有效且不良反应最小的免疫抑制方案还需要进一步研究。
综上所述,胰岛移植是一种相对安全、 有效、创伤较小的治疗2 型糖尿病的理想方法,尤其是胰岛素依赖期的2 型糖尿病合并慢性肾功能衰竭的患者,肾移植后胰岛移植能够改善、预防糖尿病远期并发症,同时改善肾脏移植物功能。虽然在扩大胰岛来源、分离提纯等方面已有了很大的突破,但是如何改善胰岛移植物功能,使其长期存活,从而改善长期临床疗效,是移植工作者迫切需要解决的难题。
