肝移植后糖尿病发病相关因素分析及预后影响
2022-11-21李畅张慧李长贤吴晓峰张峰杨涛张梅李相成
李畅,张慧,李长贤,吴晓峰,张峰,杨涛,张梅,李相成
(1.南京医科大学第一附属医院肝胆中心,江苏 南京 210029;2.南京医科大学第一附属医院内分泌科,江苏 南京 210029)
肝移植是肝脏恶性肿瘤与终末期肝病的根治性治疗手段之一[1-2]。 器官移植后糖尿病(posttransplantation diabetes mellitus,PTDM)作为肝移植术后常见并发症,发病率高达9.8% ~ 63.3%[3],并对患者预后造成了负面影响[4]。近年来的研究表明,PTDM 发生的危险因素包括年龄、遗传因素、肥胖、病毒感染等一般性因素, 以及慢性肝病、肝移植手术、免疫抑制剂等移植特异性因素[5]。 本文旨在研究肝移植后糖尿病发生的相关危险因素,并分析其对患者晚期并发症和总体生存的影响。
1 对象与方法
1.1 研究对象:2015 年1 月至2020 年9 月南京医科大学第一附属医院肝胆中心共开展公民逝世后器官捐献(donation after citizen’s death,DCD)肝移植539 例,排除重症肝炎或暴发性肝衰竭46 例,二次移植3 例,合并肾移植2 例,术后因重症感染、腹腔出血等原因院内死亡患者48 例,术前有糖尿病病史71 例,年龄<18 岁者5 例,最终有364 例肝移植患者纳入分析。其中终末期肝病139例(38.2%),包括乙肝肝硬化78 例、自身免疫性肝硬化16 例、原发性胆汁性肝硬化13 例、酒精性肝硬化11 例、不明原因肝硬化7 例、多囊肝3 例、丙肝肝硬化2 例、药物性肝硬化2 例、肝内胆管结石2 例、Wilson 氏病2 例、先天性肝内胆管扩张1 例、原发性硬化性胆管炎1 例、肝动静脉瘘1 例;肝脏恶性肿瘤225 例(61.8%),包括肝细胞癌135 例、肝癌切除术后补救性肝移植72 例、胆管细胞癌17 例,肝血管肉瘤1 例。
1.2 分组:本研究参照《2022 年美国糖尿病学会糖尿病医学诊疗标准》[6]与2014 年《移植后糖尿病国际共识会议记录:建议和未来方向》[7]的糖尿病诊断共识,将PTDM 定义为术前无糖尿病史,移植1 个月后持续高血糖状态的临床稳定患者,诊断标准为:空腹血浆葡萄糖(fasting plasma glucose,FPG)≥7.0 mmol/L 或75 g 口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)中2 h 血 浆 葡萄糖(plasma glucose, PG)≥11.1 mmol/L 或糖化血红蛋白(glycated hemoglobin,HbA1c)≥6.5%(48 mmol/mol)。将患者分为PTDM 组与非PTDM 组,其 中PTDM 组67 例,非PTDM 组297 例。PTDM组平均年龄为(52.6±8.2)岁;非PTDM 组平均年龄为(49.2±10.2)岁
1.3 数据收集:本研究数据来源于本院肝胆肿瘤数据库[8],连续纳入本中心开展的肝移植患者,及时录入患者临床数据并开展数据核查,按每6 个月1 次的频率对患者进行电话随访,并结合本院就诊记录整理患者生存状态、肿瘤复发、用药及后续治疗情况。移植后免疫抑制治疗以他克莫司+吗替麦考酚酯+激素三联方案或无激素方案为主。临床信息主要包括患者性别、年龄、体重指数(body mass index,BMI)、肝病病因、合并慢性病史、既往手术史、终末期肝病模型(model for end-stage liver disease,MELD)评分、疾病诊断、手术时间、无肝期时间、腔静脉阻断方式、术中出血量、热缺血时间、冷缺血时间、供肝脂肪变性、术后早期并发症(指术后30 d 内发生的肝移植并发症)、术后住院天数、术后晚期并发症(指术后30 d 后发生的肝移植并发症,主要收集术后感染与术后胆道并发症信息)、免疫排斥等。手术后并发症采用Clavien-Dindo 并发症分级系统评估。随访截止日期为2022 年6 月。
2 结 果
2.1 患者基本特征:364 例患者中,男性患者285 例(78.3%),女性患者79 例(21.7%),平均年龄为(49.8±9.9)岁,最小为21 岁,最大为73 岁。由表1 可见,非PTDM 组平均年龄为 (49.2±10.2)岁,PTDM 组平均年龄为(52.6±8.2)岁,组间差异有统计学意义(t=2.534,P=0.012);术后住院<30 d 患者PTDM 发生率为15.5%,术后住院≥30 d 患者PTDM 发生率为24.0%,组间差异有统计学意义(χ2=3.966,P=0.046);术后早期无免疫排斥反应患者PTDM 发生率为17.3%,有免疫排斥患者PTDM 发生率为34.8%,组间差异有统计学意义(χ2=4.384,P=0.036)。随着体重指数(bodymass index,BMI)的增加,PTDM 发生率逐渐升高,但组间差异无统计学意义(χ2=2.072,P=0.558)。患者性别、MELD 评分、疾病诊断、手术时间、无肝期时间、腔静脉阻断类型、出血量、冷缺血时间、供肝脂肪变性、术后早期并发症在两组间的差异无统计学意义。
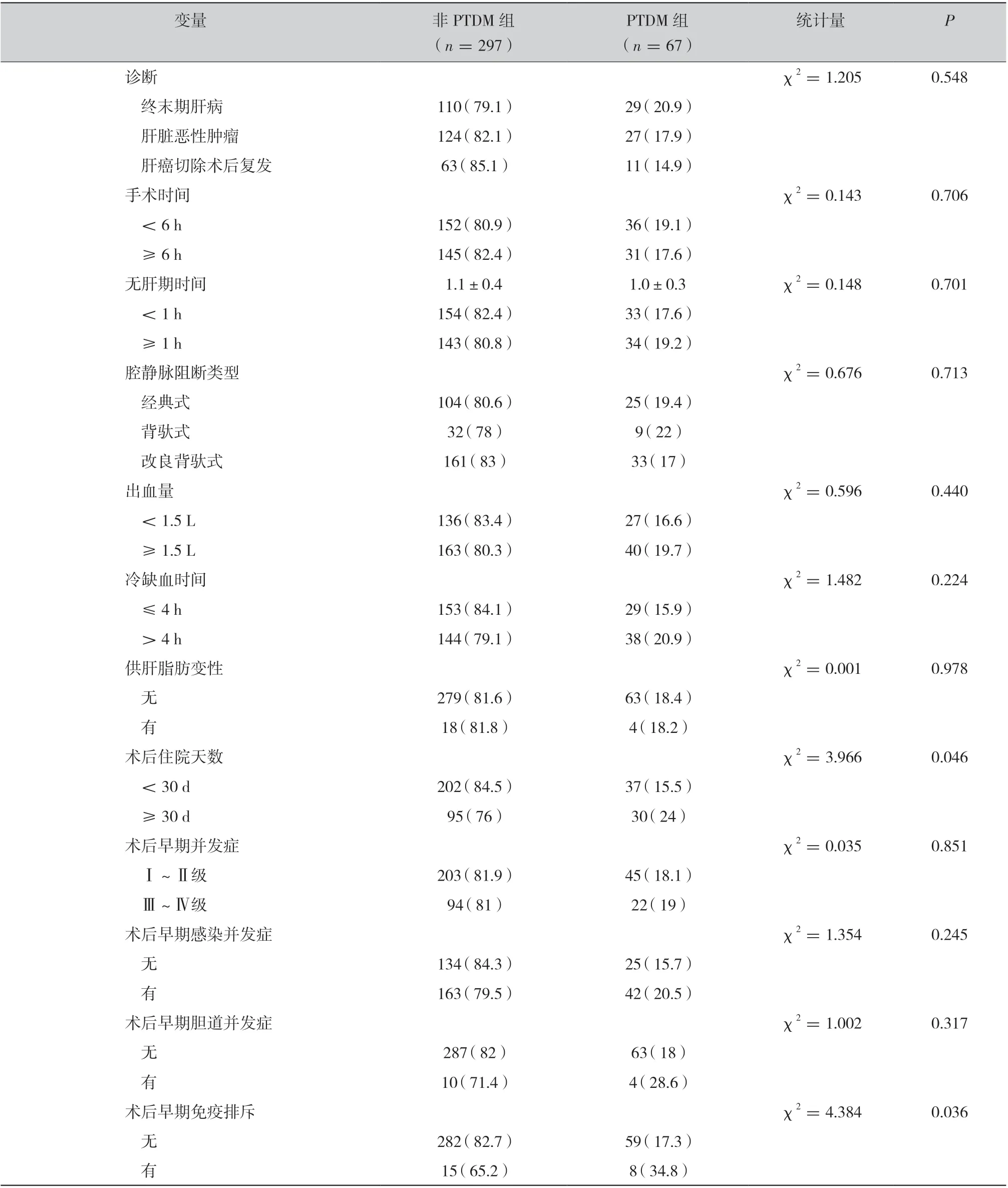
续表1 非PTDM 与PTDM 组患者特征比较〔例(%)〕
2.2 影响PTDM 发病风险的因素:肝移植术后1、3、5 年糖尿病的发病率分别为13.3%、16.9%、27.0%,见图1A。由表2 可见,考虑死亡为竞争风险事件的前提下,控制免疫排斥反应、术后住院天数、疾病诊断后,年龄每增加10 岁,发生PTDM 的风险增加45% (SHR=1.45,95% CI=1.17 ~1.80)。有免疫排斥患者发生PTDM 的风险是无免疫排斥患者的2.06 倍(95% CI=1.00 ~4.24)。术后住院超过30 d的患者发生PTDM 的风险增加了62% (SHR=1.62,95% CI=1.01 ~2.59)。肝脏恶性肿瘤发生PTDM的风险比终末期肝病患者减少19% (95% CI=0.49 ~1.33),但差异无统计学意义。图1B 给出了竞争风险模型估计的不同年龄组别下PTDM 累积发生率曲线,随着年龄的增加,PTDM 发生率明显升高。
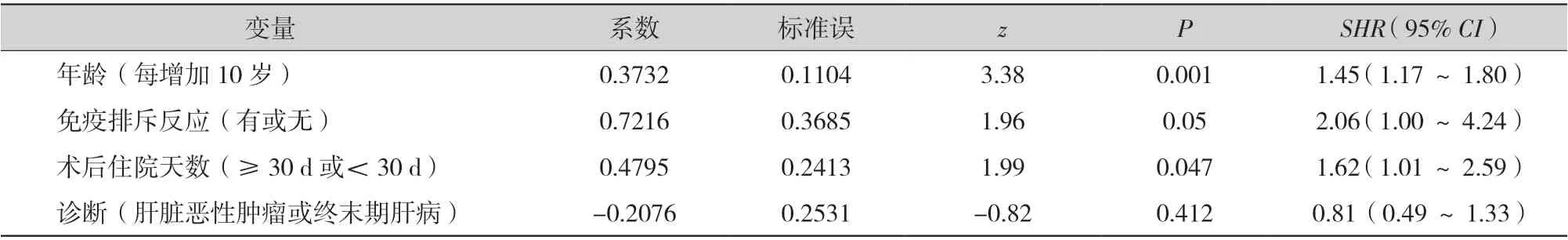
表2 影响PTDM 发病风险的多因素分析结果(竞争风险模型)
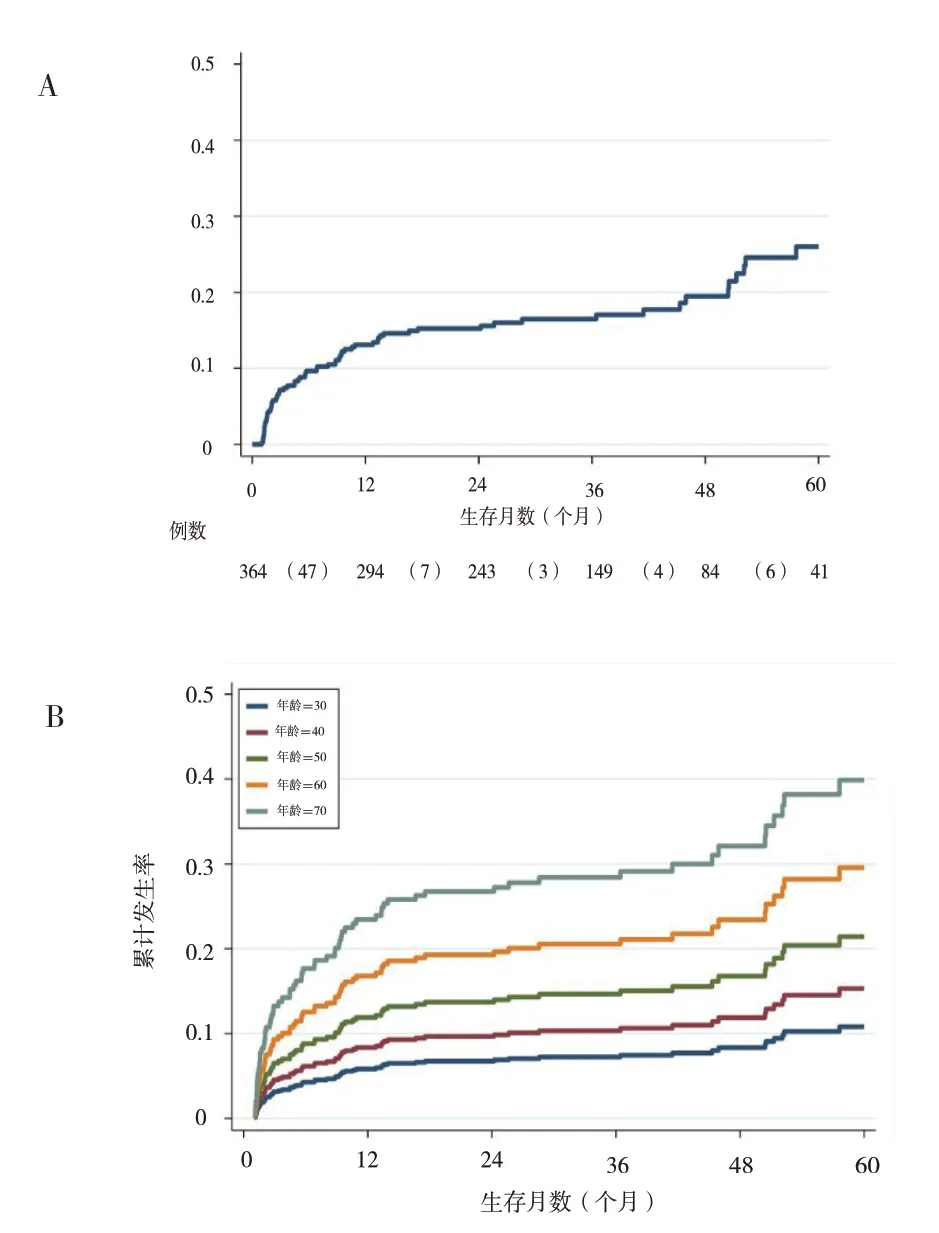
图1 PTDM 发生率曲线及不同年龄组别下PTDM 累积发生率曲线
2.3 PTDM 对患者预后影响:非PTDM 组和PTDM组晚期感染并发症发生率分别为9.4%(28/297)和20.9%(14/67),组间差异有统计学意义(χ2=7.044,P=0.008);控制早期感染并发症的影响后,PTDM发生晚期感染并发症的风险是非PTDM 组的2.48 倍(95% CI = 1.22 ~5.04)。 非PTDM 组 和PTDM 组晚期胆道并发症发生率分别为11.8%(35/297)和17.9%(12/67),组间差异无统计学意义(χ2=1.824,P=0.177);控制早期胆道并发症的影响后,PTDM发生晚期胆道并发症的风险是非PTDM 组的1.58 倍(95% CI=0.77 ~3.26)。
364 例肝移植患者1、3、5 年生存率分别为90.9%、74.8%、69.5%,见图2A。终末期肝病患者1、3、5 年生存率分别为98.6%、91.5%、88.9%;肝脏恶性肿瘤患者1、3、5 年生存率分别为86.2%、64.3%、56.2%。非PTDM 组肝移植术后1、3、5 年生存率分别为92.9%、75.9%、69.6%;PTDM 组肝移植术后1、3、5 年生存率分别为82.1%、69.7%、67.3%,见图2B。调整疾病诊断因素后,PTDM 组死亡风险为非PTDM 组的1.73 倍 (95% CI=1.07 ~2.77)。
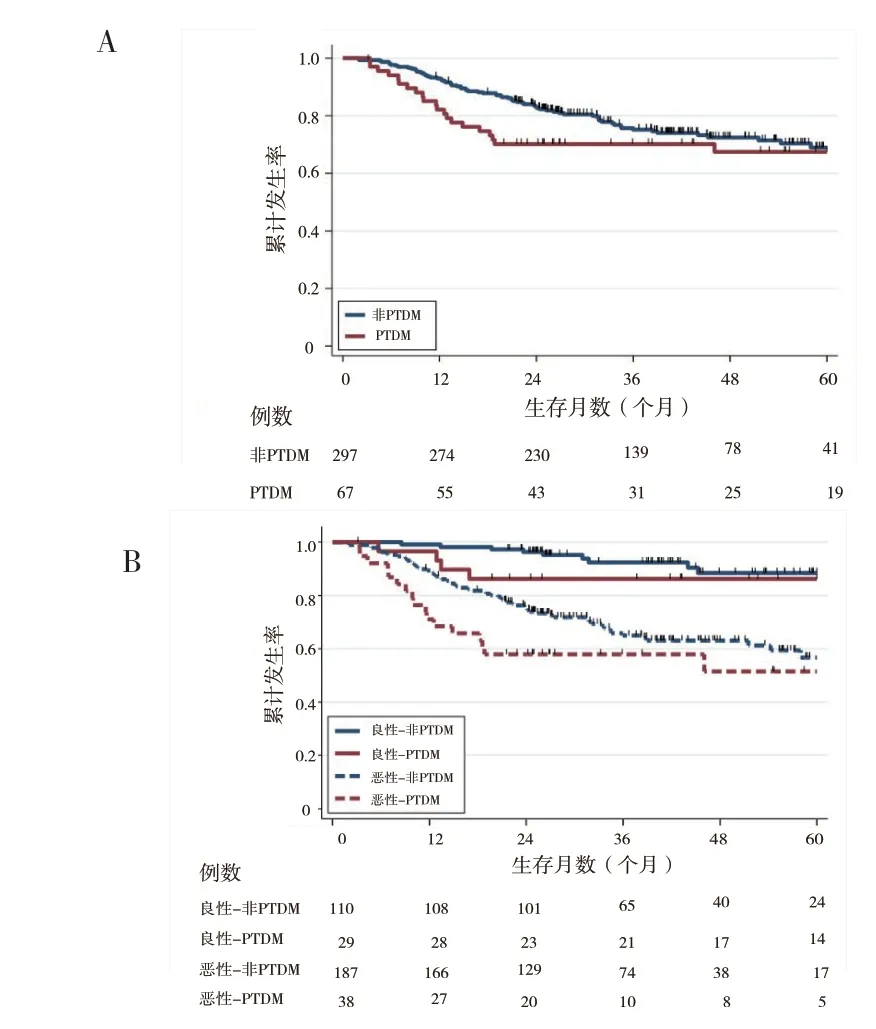
图2 非PTDM 患者与PTDM 患者总体生存曲线
3 讨 论
肝移植术后1、3、5 年糖尿病的发病率分别为13.3%、16.9%、27.0%,主要与肝移植时年龄、免疫排斥反应、术后住院天数等有关。有研究者搜集PTDM 危险因素的观察性研究进行Meta 分析[3],得出PTDM 的发生率为9.8% ~ 63.3%。70.1%(47/67)的患者于术后1 年内即发生糖尿病,其术前血糖正常,侧面印证了PTDM 患者血糖代谢改变与肝移植围术期因素的相关性。本研究发现PTDM 患者死亡风险提升73%有报道称,PTDM 患者发生器官排斥、感染、心血管事件和死亡的风险比非糖尿病患者高2 ~ 3 倍[9]。
受者年龄与PTDM 发生率有关,年龄每增加10 岁,发生PTDM 的风险将增加45%。其他研究也报道了类似的结果,认为年龄为PTDM 发生的重要因素[4,10]。研究显示,欧美肝移植受者的年龄在2004 — 2019 年间中不断增长,其原因可能是肝移植结果改善导致候选人的年龄限制有所放宽,以及新药使用令部分丙肝相关肝硬化及肿瘤患者临床情况改善[11]。近年来,中国关于肝移植受者年龄结构的大规模临床研究相对缺失,但在人口老龄化的社会背景下,PTDM 发病率也有进一步上升风险,需引起研究者重视。术后发生免疫排斥反应的患者发生PTDM 的风险是无免疫排斥反应患者的2.06 倍,该结果可能与患者发生免疫排斥反应后需使用大剂量糖皮质激素冲击治疗并调整他克莫司使用剂量有关[12]。《中国肝移植受者代谢病管理专家共识(2019 版)》指出[13],PTDM 发病与免疫抑制剂有关,而免疫抑制剂中糖皮质激素和他克莫司是最重要的致病因素。糖皮质激素对葡萄糖代谢的影响复杂,通过各种机制发挥作用,主要包括增加肝糖异生、增加胰岛素抵抗和胰岛β 细胞功能障碍[14]。研究表明,术后使用泼尼松剂量每增加0.01 mg/kg,PTDM 的发生风险上升5%[15]。肝移植术后3 个月他克莫司血药浓度>8 ng/ml 是PTDM 的独立危险因素[16]。他克莫司诱导胰岛β 细胞凋亡、影响线粒体代谢可能与IER3 表达下调相关,并诱发PTDM[17],其具体机制尚不明确。研究发现,法尼脂X 受体(farnesoid X receptor,FXR)在糖代谢中发挥重要作用,其受体激动剂GW4064 可改善他克莫司诱导的PTDM,可能是防治移植后糖尿病的潜在新靶点[18],为肝移植受者改善预后提供了新希望。术后住院>30 d 的患者发生PTDM 的风险增加62%,提示术后长时间住院会提高患PTDM 的风险。有报道称,低肾小球滤过率、高 Meld 评分、 存在肝肾综合征(hepatorenal syndrome,HRS)、围术期需要肾脏替代治疗以及未应用麦考酚酯是导致住院时间延长的危险因素[19]。发生免疫排斥反应患者往往需要长时间住院调整肝功能指标,可能是术后住院时间较长患者PTDM 患病风险提高的原因之一。
非PTDM 与PTDM 组的BMI 值之间的差异无统 计 学 意 义,BMI <18.5 kg/m2、18.5 ~ 23.9 kg/m2、24 ~ 28 kg/m2、≥28 kg/m2的患者PTDM 发病率分别为14.3%、15.8%、21.1%、22.6%,可见肥胖组和偏胖组PTDM 发病率高于正常组和超重组,但其差异仍无统计学意义,这可能与终末期肝病及肝脏恶性肿瘤患者病程后期体重减轻有关。乙型肝炎对PTDM发生率无影响。有报道称丙型肝炎病毒感染对PTDM发病有影响[20],但在本研究中,我们认为其对PTDM 发病率的影响不明显,可能由于我国居民丙型肝炎病毒感染率较低,丙型肝炎病毒相关肝硬化及肝脏恶性肿瘤患者较少,样本量不足所致[21]。肝脏恶性肿瘤患者发生PTDM 的风险比终末期肝病患者小,但差异无统计学意义,可能与肝脏恶性肿瘤患者预后较差,生存时间较短有关。
感染是造成肝移植受者死亡的主要原因之一,高达80%的肝脏受者在肝移植后的第一年内至少会发生1 次感染[22]。有报道称,PTDM 作为代谢性疾病,是肝移植术后发生感染的重要危险因素,很大程度上影响受者的生存质量和长期存活[23]。研究表明,肝移植术后96 h 内血糖>9.72 mmol/L 的患者,术后发生感染风险比其他患者提升3 倍以上[24]。本研究发现PTDM 患者发生术后晚期感染的风险为非PTDM患者的2.48 倍,为PTDM 提升术后感染率提供了新证据。PTDM对术后晚期胆道并发症的发生影响不大。
PTDM 发生率高且降低患者总体生存,应该为肝移植患者制定个体化血糖监测与免疫抑制治疗方案,及时发现患者血糖异常并予以早期控制,以期改善患者预后。所有的肝移植患者都应该在移植前被告知患PTDM 的潜在风险,并在移植术后定期筛查血糖,包括筛查FPG、HbA1c,具有多种危险因素的高危患者应加做OGTT,筛查频率:术后4 周内每周1次; 随后 1年中每3个月1次; 此后每年筛查1次[25]。对于PTDM 的防治,《中国肝移植受者代谢病管理专家共识(2019 版)》提出建议:肝移植术后静脉使用糖皮质激素以及移植肝功能未完全恢复时,建议胰岛素治疗;胰岛素用量降至24 U/d以下,移植肝功能正常时可给予口服降糖药物;肾功能正常时可以选用二甲双胍或磺酰脲类药物,肾功能受损时首选磺酰脲类药物(如格列吡嗪和格列美脲);糖皮质激素最小化及MPA 联合钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)减量的方案有助于减少PTDM 的发生血糖控制不佳;餐后血糖峰值>11 mmol/L 和HbA1c >9%)的肝移植受者,建议将他克莫司转换为环孢素[12]。
作为一项回顾性研究,本研究过程中不免存在一些不足之处。如部分患者无法在术前进行完善的血糖检测,可能使数据出现偏差,以及本中心肝移植受者在移植术后立即使用相对同质化的免疫抑制方案,患者间用药差异较小,相关数据不具有分析价值。本研究为未来开展相关前瞻性研究,如免疫抑制剂使用方案优化等打下了基础。
综上所述,PTDM 发生与患者年龄、免疫排斥反应、住院时间有关,提升患者感染风险,降低患者总体生存率。应术后早期筛查血糖并予以个性化治疗,以期改善患者预后。
