肝脏切除术后肝再生对肿瘤复发影响的实验研究
2022-11-21韩俊峰沈中阳高伟田彦璋付西峰
韩俊峰,沈中阳,高伟,田彦璋,付西峰
(1.山西白求恩医院普通外科,山西太原 030000;2.天津市第一中心医院器官移植中心,天津 300100)
原发性肝癌在我国恶性肿瘤排名中位于第4位[1],同时在肿瘤致死病因排第2 位,其中肝细胞肝癌(hepatocellular carcinoma,HCC)占到75% ~ 85%。近年来,肝细胞肝癌分子靶向药物、免疫检查点抑制剂等系统治疗的突破性进展使肝癌患者的预后较前明显改善,但对于中国肝癌分期方案(China liver cancer staging,CNLC)中Ⅰa 期、Ⅰb 期、Ⅱa 期肝癌的首选治疗方式仍是外科治疗,主要包括肝切除术和肝移植术。肿瘤复发是肝癌外科治疗后面临的主要问题,原发性肝癌诊疗指南(2022 年版)指出,肝癌切除术后5 年肿瘤复发转移发生率高达40% ~70%[2]。
当前肝癌在内的终末期肝病患者的主要治疗手段是原位肝移植,在一些肝移植中心活体肝移植(living donor liver transplantation, LDLT)已普遍开展。然而有研究报道指出,在HCC 患者治疗过程中,LDLT 较尸体供肝肝移植术后肝癌复发率较高,可能的原因是LDLT 手术完成后患者肝再生过程加速了残存肝癌细胞的生长[3-4]。
肝切除或LDLT 术后患者的肝细胞会立即进入增殖的状态,目前还不能确定肝再生过程是否能够加速肿瘤组织的复发和转移,其具体机制也没有明确的解释,本研究拟初步探究肝癌肝脏切除或LDLT 术后患者肝再生过程是否对肿瘤复发产生影响,并揭示其可能存在的发生机制。
1 材料与方法
1.1 实验动物和试剂:SPF 级健康的成年雌性Wistar 大鼠体重200 ~ 230 g,8 ~ 10 周龄,购买自解放军军事医学院动物实验中心,动物检疫合格,许可证号为SCXK-(军)2014-0001,保持自由进食饮水。Walker 256 肿瘤细胞株由中国医学科学院肿瘤细胞库提供。鼠增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) IgG、c-met 抗体、VEGFR2 抗体、CAPNS-1 抗体均购买于英国Abcam 公司。本研究获得天津市第一中心医院学术与伦理委员会批准(审批号:2014 -SYDWLL-000062)。
1.2 肿瘤细胞悬液的制备:于幼鼠腹腔接种含Walker 256 肿瘤细胞株的原始细胞悬液,并连续传代2 ~ 3 代,最终获得处于对数生长期的细胞株。台盼蓝染色法用于确定活性细胞的比例是否大于90%,PBS 缓冲液用于调整悬液浓度至约1.0×106/ml备用。
1.3 实验分组及术后管理:将24 只SPF 级健康的成年雌性Wistar 大鼠随机分为3 组,无肝切组定义为H0 组:将麻醉后的大鼠充分游离肝脏周围韧带,于门静脉注射0.5 ml Walker 256 肿瘤细胞的悬液(约5.0×105个);30%肝切组定义为H30 组:切除大鼠肝脏左外侧叶后经门静脉注射肿瘤细胞悬液0.5 ml;70%肝切组(H70):切除大鼠肝脏左叶和肝中叶后经门静脉注射肿瘤细胞悬液0.5 ml。手术完毕后为预防感染静脉注射100000U/Kg 青霉素钠,并在SPF 环境中保持大鼠自由进食和饮水。
1.4 病理学检查:使用4%多聚甲醛溶液固定瘤肝组织,石蜡包埋后获得常规病理切片,观测HE 染色后组织病理学改变。于显微镜下观察免疫组化染色结果,400×下随机观测5 个视野,计算增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)染色阳性细胞占比,即PCNA 指数。
1.5 Western Blot 用于分析VEGFR-2、c-met、CAPNS-1蛋白表达水平:取冻存的肿瘤组织,进行液氮研磨匀浆,1% Triton 重悬后进行BCA 蛋白测定。将裂解的蛋白按照80 V 30 min 转100 V 1.5 h 进行SDS-PAGE 凝胶电泳;电泳后进行DVPF 膜恒流300 mA,转膜2 h;转膜后封闭缓冲液2 h;一抗孵育过夜(待测蛋白c-met、VEGFR2、CAPNS-1 与内参GAPDH);洗膜后进行二抗孵育;最后在凝胶成像仪中分别曝光,采集条带图片。
1.6 RT-PCR 检 测c-met、VEGFR-2 mRNA 转 录 丰度:冻存的肝组织样品使用RNA iso Plus 提取总RNA,进行定量测定。随后,提取的RNA 按照反转录试剂盒说明加入试剂,在37℃ 60 min、85℃5 min、4℃的条件下进行逆转录反应;将逆转录所得cDNA 根据定量试剂盒,在37℃ 2 min、95℃ 10 min、95℃ 15 s、60℃ 30 s、72℃ 30 s 的条件下进行40 个周期循环。本部分设计检测基因和引物序列如下:CMET(F-AAAAGTTCACCACCAAGTC;R-CATTC ACATAAGTAGCGTTC)、VEGFR2(F-TTTTGG TAGCGGGATGAA;R-ATGGGATTGGTGAGGATGA)、GAPDH(F-ATGCCGCCTGGAGAAACC;R-GCATC AAAGGTGGAAGAATGG)。
1.7 统计学处理:SPSS 26.0 软件用于统计学分析,计量实验数据以均数±标准差(±s)表示,单因素方差分析用于组间差异分析,皮尔逊相关检验用于相关性分析,P <0.05 为差异有统计学意义。
2 结 果
2.1 术后存活率及一般观察指标:术后3 周无肝切组、30%肝切组、70%肝切组大鼠均存活,大鼠肝脏表面出现不同程度转移性肿瘤结节,复发率在各组间无显著性差异。此外,70%肝切组大鼠瘤肝体积较对照明显变大,质地较硬,且表面分布许多不同大小的灰白色转移性肿瘤结节,肝实质明显受累(图1A)。在无肝切组和30%肝切组,肝脏表面的结节显示斑点状浸润,肝脏轮廓完整,肝实质轻微受累(图1B)。
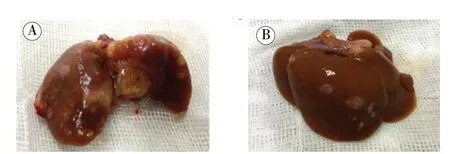
图1 不同实验组瘤肝组织外观
无肝切组、30%肝切组、70%肝切组实验大鼠术前的平均体重不存在统计学意义的差异(F=1.885,P >0.05)。然而术后3 周,70%肝切组实验大鼠的平均体重显著低于其他2 组(F=26.692,P <0.05),而无肝切组与30%肝切组的大鼠平均体重仍没有明显差异。实验前后大鼠的体重变化(F=31.933)、荷瘤肝重(F=36.424)、荷瘤肝体质量比 (F=65.813) 70%肝切组明显高于无肝切组、30%肝切组(P <0.05)(表1)。
表1 一般观察指标(±s)
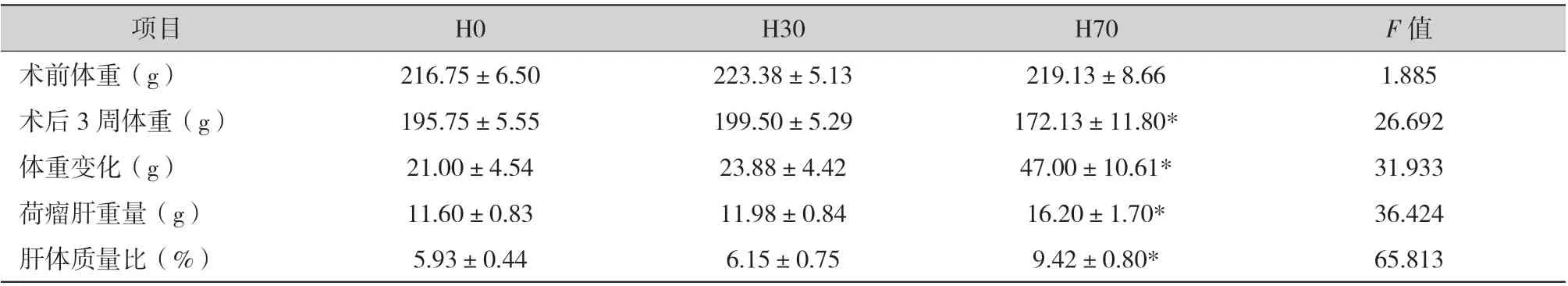
表1 一般观察指标(±s)
注:* P <0.05 为差异有统计学意义。
项目 H0 H30 H70 F 值术前体重(g) 216.75±6.50 223.38±5.13 219.13±8.66 1.885术后3 周体重(g) 195.75±5.55 199.50±5.29 172.13±11.80* 26.692体重变化(g) 21.00±4.54 23.88±4.42 47.00±10.61* 31.933荷瘤肝重量(g) 11.60±0.83 11.98±0.84 16.20±1.70* 36.424肝体质量比(%) 5.93±0.44 6.15±0.75 9.42±0.80* 65.813
图2 说明肿瘤细胞团灶弥漫性分布于70%肝切组大鼠肝脏内。由于转移性肿瘤细胞团灶的膨胀性生长,使得周围的肝实质受到不同程度的损伤,其中70%肝切组肝脏周边的肝实质损伤最为严重(图2A),而无肝切组、30%肝切组肝实质破坏较轻。PCNA 指数的大小可间接反映出肿瘤组织的侵袭性,本研究中70%肝切组大鼠肿瘤组织的PCNA 指数显著高于其他两组(F=131.746,P <0.05),且无肝切组与30%肝切组的PCNA 指数无显著差异(图2B、2C)。
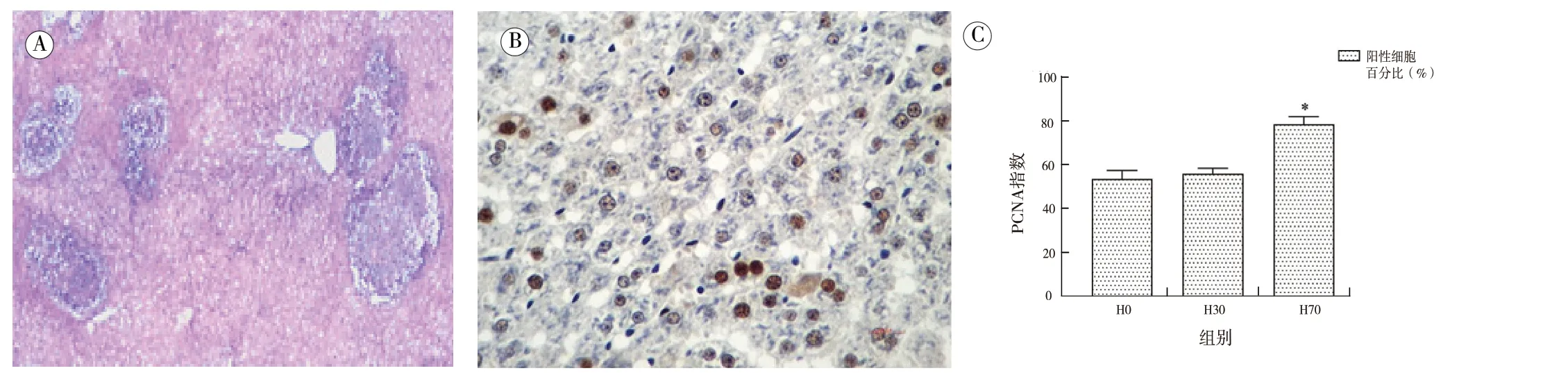
图2 不同实验组瘤肝组织病理学检查(×400)
2.2 肿瘤的侵袭性:本研究中70%肝切组的CAPNS-1 蛋白表达水平显著高于无肝切组、30%肝切组(F=28.115, P <0.05),而无肝切组与30%肝切组的表达水平之间差异无统计学意义(图3)。
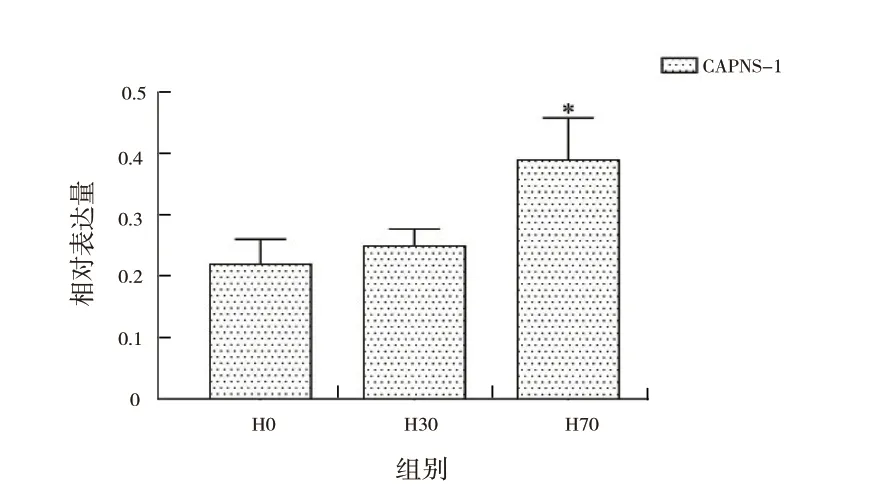
图3 Western Blot 示不同实验组中CAPNS-1 的蛋白表达水平
2.3 肿瘤结节中c-met、VEGFR-2 的蛋白及mRNA表达水平:图4 可见70%肝切组的c-met(F=178.083, P<0.05)、VEGFR-2(F=14.035,P<0.05)蛋白表达水平与无肝切组、30%肝切组存在显著性差异(图4 a)。
RT-PCR 结 果 表 明70%肝 切 组c-met(F=22.803, P <0.05)、VEGFR-2(F=35.005, P <0.05)的mRNA 转录丰度显著高于30%肝切组以及无肝切组(见图4 b)。
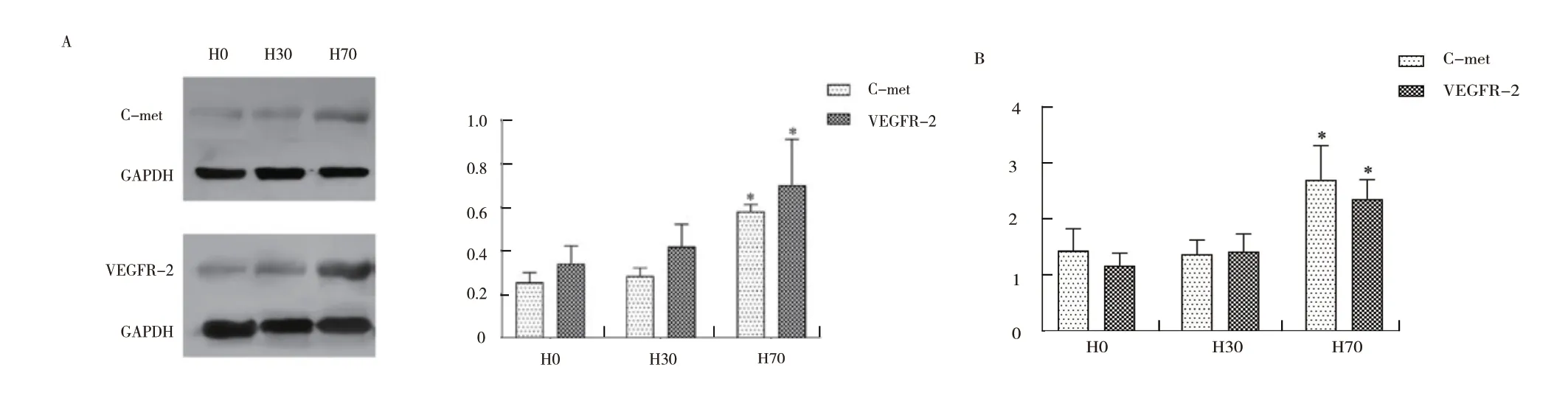
图4 不同实验组肿瘤结节中c-met、VEGFR-2 的蛋白表达及mRNA 转录丰度
c-met、VEGFR-2 蛋白的表达分别与荷瘤肝重、体重变化、荷瘤肝体质量比、CAPNS-1 表达水平之间存在显著正相关。其中c-met 与荷瘤肝重、体重变化、荷瘤肝体质量比、CAPNS-1 表达水平之间的相关系数分别为0.864、0.865、0.897、0.895,VEGFR-2 与荷瘤肝重、大鼠体重变化、荷瘤肝体质量比、CAPNS-1 表达水平之间的相关系数分别为0.796、0.710、0.803、0.606。
3 讨 论
当前HCC 患者的主要治疗方式是肝移植和肝部分切除,然而有数据显示,患者术后5 年肿瘤复发或转移的发生率达到40% ~ 70%,这严重威胁到HCC 患者的生命健康。一些研究表明,肝切除术后肝脏再生过程会产生大量的细胞因子并表达部分特征基因,进而诱导肝癌的复发和转移[5-6],本研究以陈颖华等[7]的方法为参考经门静脉将Walker 256肿瘤细胞悬液注射至大鼠,探索不同比例肝切除对肿瘤复发的影响程度并探究其可能的发生机制。
在肝脏实质遭受损伤或部分切除术后肝脏会进行自我修复,在大鼠肝切除研究中,不同比例的肝切除会引起不成程度的肝再生。本研究表明,肝切除的比例与肝再生过程显著相关,且该过程可加速肿瘤组织的生长。同时30%肝切实验组大鼠肝再生过程并未明显影响肿瘤结节的生长,这可能是由于肝切除比例低于30%时,其DNA 合成速度仅是无肝切实验组的1 ~ 5 倍。
钙蛋白酶小亚基-1(calpain small subunit-1,CAPNS-1)是钙蛋白酶家族成员的一种调节性小亚基,在许多恶性肿瘤侵袭、进展和迁移等过程异常表达[8]。在Dai 等[9]的研究中指出肝癌组织中基因CAPNS-1 的转录水平明显比癌旁正常组织高,其可能通过促进基质金属蛋白-2 的表达或参与黏附斑激酶/酪氨酸蛋白激酶途径加速肝癌细胞的形成、侵袭、迁移等过程。PCNA 是一种细胞核非组蛋白,研究表明可以通过PCNA 表达强弱判断肿瘤的生物学行为从而作为预测患者预后的一项指标[10]。本研究中,CAPNS-1 蛋白在70%肝切组大鼠肿瘤组织的表达水平、PCNA 指数显著高于30%肝切组和无肝切组,说明70%肝切组大鼠的肿瘤组织侵袭性更高,恶性潜能更大。这些结果说明肝再生过程可能会导致肿瘤组织发生恶性转换,进而表现出较高水平的侵袭性与恶性潜能。
肝细胞生长因子(hepatocyte growth factor,HGF)最早于20 世纪80 年代末被人们发现,其信号通路在肝脏再生中起着核心作用,HGF 信号通路依赖于酪氨酸激酶受体c-met 的激活。研究表明,肝切除术后约30 min,HGF 表达水平上升约30 倍,并伴有c-met 受体的激活[11]。c-met 受体本身就是一种原癌基因,c-met 的过表达是肿瘤预后不良的一项指标[12]。我们发现大鼠肿瘤组织中的c-met 蛋白和mRNA 表达量70%肝切实验组显著高于无肝切组和30%肝切组,且c-met 的表达水平显著相关于大鼠体重变化、荷瘤肝重等指标,说明肿瘤组织的侵袭性与较高水平的c-met 表达密切相关。因此,我们推测肿瘤细胞的增殖与迁移可能被70%肝切组手术完成后大量HGF 与c-met 高表达之间的相互作用促进。
新生血管的生成为肝脏的再生过程中提供了充足的氧气和营养物质,在哺乳动物体内血管内皮生长因子(vascular endothelial growth factor ,VEGF)是活性较强的促血管生成因子之一。已有研究表明,在多种恶性肿瘤中VEGF 皆表现出较高的转录丰度,其受体VEGFR-2 在肿瘤的转移、侵袭以及血管的形成发挥着至关重要的作用,目前在中晚期肝癌治疗中应用了多种抗VEGF 和VEGF 受体靶向药[13]。此外,本实验中70%肝切组大鼠肿瘤组织表现出高水平的VEGFR-2 mRNA 和蛋白表达,这与荷瘤肝重等指标以及CAPNS-1 表达显著相关,说明VEGFR-2 的大量积累与肿瘤组织的侵袭性紧密相关。在肝再生过程中,VEGF 与VEGFR-2 受体的结合有利于肿瘤血管的生成进而加速肿瘤生长,同时VEGF 提高血管内皮的通透性从而达到促进肿瘤细胞转移与浸润的目的。
4 小 结
在切除不同比例肝的基础上经门静脉注射Walker 256 肿瘤细胞模拟肝癌肝部分切除或LDLT术后肿瘤转移复发模型,研究结果显示,肝再生过程不仅促进了肿瘤细胞的生长,还加快了其恶性转换的速度,这可能与肝再生的过程中释放大量的细胞因子有关。
