骨髓间充质干细胞靶向p16INK4a 蛋白诱导慢性髓细胞性白血病细胞K562衰老的分子机制
2022-11-17唐紫云何思悦刘小虎
周 雯,唐紫云,何思悦,刘小虎,周 玥
(大理大学基础医学院,云南 大理 671000)
慢性髓细胞性白血病(chronic myeloigenous leukemia,CML)是一种骨髓增生性肿瘤,其特点是染色体9q34的ABL1基因与染色体22q11.2上的断点簇区BCR基因的融合,这种重排被称为费城染色体〔1〕。K562细胞是从人CML急性病患者中分离的细胞,费城染色体阳性,被用作为CML的细胞模型。化疗是当前治疗白血病的主要方法,大部分患者通过化疗可达到临床完全缓解的治疗效果。酪氨酸激酶抑制剂的广泛使用使患者总体生存时间提高到几乎接近于普通人群的预期寿命〔2〕。但化疗药物在杀伤肿瘤细胞的同时对机体正常细胞也带来不同程度的损伤〔3〕,使治疗难以进行。因此,探寻CML有效、安全的治疗方法成为人们关注的焦点。
正常的造血需要骨髓微环境和造血干细胞之间的双向相互作用。白血病细胞破坏了造血干细胞的微环境,其肿瘤细胞将微环境的稳态转变为有利于白血病细胞加速增殖的状态。骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)作为骨髓微环境的一员在白血病的发展和治疗中发挥着不可或缺的作用〔4〕。据报道〔5-6〕,间充质干细胞可通过分泌细胞因子或阻滞细胞周期来抑制K562细胞的增殖能力。Fathi等〔7〕研究表明,间充质干细胞分泌的白细胞介素6、白细胞介素8和转化生长因子-β可通过Wnt5α/β-Catenin和p53通路降低白血病细胞端粒酶活性和端粒长度。由此可见,间充质干细胞对白血病细胞的增殖具备调控作用,但具体机制尚不清楚。p16INK4a蛋白是常见的衰老调控分子,它的激活已被证明是最有用的体内衰老标志物之一〔8〕。p16INK4a蛋白的表达是高度动态的,在健康的年轻组织中基本不存在,但在许多老化的组织中被检测到〔9〕。有报道〔10-11〕称,将p16基因转染至K562细胞后,K562细胞表面电荷密度增高,限制了K562细胞的增殖和迁移功能。提示p16基因的表达对K562细胞的功能起到一定的调控作用。本文旨在探究BMMSC能否通过诱导K562细胞衰老而抑制其增殖能力,同时探讨p16INK4a蛋白在BMMSC诱导K562细胞衰老中的调控作用,为诱导白血病细胞衰老的途径提供理论和实验基础。
1 材料
1.1 细胞及实验动物K562细胞购于齐氏生物科技有限公司。6~8周SPF级C57BL/6J雄性小鼠,体质量20~30 g,购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。
1.2 主要试剂及仪器DMEM/F12培养基、青-链霉素(赛业生物科技有限责任公司,批号:69010395、BL505A);RPMI-1640培养基(普诺赛生命科技有限公司,批号:PM150110);胎牛血清(BI公司,批号:C04001050);胰蛋白酶(Hyclone公司,批号:J190034);骨髓间质干细胞成骨、成脂诱导分化培养基试剂盒(Cyagen公司,批号:MUBMX-90031、MUBMX-90021);SA-β-Gal衰老染色试剂盒(碧云天生物技术公司,批号:C0602);细胞周期检测试剂盒(KeyGENBioTECH公司,批号:KGA512);细胞裂解液、ECL化学发光试剂盒(Thermo Fisher公司,批号:FNN0011、WP20005);PE-anti-human CD29、PE-anti-human CD44、PEanti-human CD45(Bioscience公司,批号:SC3746、SC7297、SC1178);CDKN2A/p16INK4a、β-actin、HRP标记山羊抗兔IgG(abcam公司,批号:EPR1473、ab210083、ab97051);PBS、TBST缓冲液(索莱宝生物科技有限公司,批号:P1020、T1081);酶标仪(BIORAD公司);流式细胞仪(CytoFLEX公司)。
2 方法
2.1 实验分组取对数生长期K562细胞和第3~6代BMMSC进行实验,分为对照组和实验组,对照组仅含K562细胞;实验组BMMSC和K562细胞比例分别为1∶4、1∶2、1∶1及2∶1,培养24、48、72 h,筛选出细胞最佳比例和作用时间后进行后续实验。
2.2 骨髓来源间充质干细胞的分离与培养颈椎脱臼法处死小鼠,75%乙醇浸泡15 min,于超净工作台中剪断双足。剥离皮毛后紧贴脊柱平行剪断股骨,避免破坏股骨腔完整性。分离出的腿骨暂置于含青-链霉素的PBS缓冲液中,漂洗3次,剪开胫、股骨两端,用1 mL注射器吸取DMEM/F12完全培养基(DMEM/F12基础培养基+10%胎牛血清+1%青-链霉素)冲出骨髓腔内容物,直至骨体发白。吹打均匀后收集细胞悬液,1 000 r/min离心5 min后收集小鼠骨髓细胞,每只小鼠的骨髓细胞放入2个6 cm培养皿,置于37℃、5% CO2细胞培养箱中培养。48 h后半量换液,以后每3 d换液,并用PBS缓冲液轻柔冲洗培养皿,待细胞生长融合至80%~90%时按1∶1或1∶2的比例进行传代。
2.3 流式细胞术检测BMMSC的表面标志物和K562细胞周期取第3代BMMSC,PBS缓冲液冲洗3次,胰蛋白酶消化后,用PBS缓冲液将其调整为1×106个/mL的细胞悬液,分别往4支1.5 mL EP管内加入100 μL细胞悬液,依次加入PE-anti-human CD29、PE-anti-human CD44、PE-anti-human CD45、PBS缓冲液各5 μL,室温避光孵化30 min,1 000 r/min离心5 min,去除上清液,200 μL PBS缓冲液重悬,1 000 r/min离心5 min,上机检测。
取对数生长期K562细胞2×105个/孔与各实验组共培养48 h后,离心收集细胞,加入1 mL预冷的70%乙醇,4℃固定过夜。染色前细胞用PBS缓冲液洗涤2次,细胞重悬于含核糖核酸酶A的PBS缓冲液中,37℃孵育30 min消化RNA。加人PI染液,缓慢并充分重悬细胞沉淀,37℃避光温浴30 min。染色完成后用流式细胞仪在488 nm激发波长、507 nm发射波长下检测红色荧光,同时检测光散射情况。
2.4 BMMSC的成脂诱导分化消化重悬后将4×104个第3代BMMSC接种在24孔板中,每孔加入0.5 mL DMEM/F12完全培养基。置于37℃、5% CO2培养箱中进行培养,每隔3 d更换DMEM/F12完全培养基,直到细胞融合度达到100%或者过融合。吸走完全培养基,向24孔板中加入0.5 mL配制好的成脂诱导分化培养基A液。诱导3 d后吸走A液,加入0.5 mL成脂诱导分化培养基B液。24 h后吸走B液,换回A液进行诱导。A液和B液交替作用3~5次(12~20 d),继续用B液维持培养4~7 d直到脂滴变得足够大、足够圆。B液维持培养期间,每隔2~3 d需要换用新鲜的B液。成脂诱导分化结束后,使用油红O染色,于显微镜下观察成脂染色效果。
2.5 BMMSC的成骨诱导分化取第3代BMMSC,消化重悬后取2×104个BMMSC接种在事先包被0.1%明胶的24孔板中,每孔加入0.5 mL DMEM/F12完全培养基,置于37℃、5% CO2培养箱中进行培养,直到细胞融合度达到60%~70%时吸走完全培养基,换成0.5 mL配制好的成骨诱导分化完全培养基继续培养,每隔3 d换液,诱导2~3周后,视细胞的形态变化及生长情况,用茜素红进行染色,于显微镜下观察成骨染色效果。
2.6 CCK-8法检测细胞增殖能力取第3代BMMSC消化重悬后按与K562细胞的比例为1∶4、1∶2、1∶1、2∶1分别铺入4个24孔板中,待细胞贴壁后移除DMEM/F12完全培养基,加入500 μL含1×105个K562细胞的RPMI-1640培养基,并设置仅含K562细胞的对照组和含RPMI-1640培养基的空白组分别培养24、48、72 h,轻柔吹打收集24孔板中的K562细胞铺入96孔板中,每组5个复孔,每孔加入10 μL CCK-8溶液,置于37℃、5% CO2培养箱内继续培养4 h,用酶标仪检测450 nm波长处的吸光度(OD)值,并计算细胞增殖率。细胞增殖率(%)=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
2.7 SA-β-Gal染色法检测K562细胞衰老情况取对数生长期K562细胞1×105个/孔与BMMSC共培养48 h,PBS缓冲液洗涤2次,固定液常温固定15 min;再用PBS缓冲液离心洗涤3次,加入配制好的染色液置入37℃、无CO2的恒温培养箱中过夜。12 h后置于显微镜下观察,计算400个细胞中的阳性细胞率。
2.8 蛋白质印迹法检测衰老调控分子p16INK4a的表达对数生长期K562细胞1×106个/孔与各实验组共培养48 h后收集各组K562细胞,PBS缓冲液洗涤2次,提取各组细胞总蛋白,按BCA蛋白浓度测定试剂盒方法测定总蛋白浓度,取等量总蛋白经SDS-PAGE电泳分离后转移至PVDF膜,5%脱脂奶粉封闭2 h,加入兔抗鼠CDKN2A/p16INK4a一抗(1∶200),4℃过夜,TBST缓冲液漂洗2次;加入HRP标记的羊抗兔二抗(1∶5 000),室温反应2 h,TBST缓冲液洗膜3次,ECL增强发光试剂显色,凝胶成像系统曝光,显影定影后观察结果。
2.9 统计分析运用SPSS 26.0软件进行数据分析,两样本间均数比较使用独立样本t检验,数据以(±s)表示,P<0.05为差异有统计学意义。
3 结果
3.1 BMMSC的形态观察原代BMMSC形态大小不一,呈圆形。2~3 d后可见部分细胞贴壁生长,呈多角形或椭圆形,散在分布。见图1A。7 d后细胞变长呈纺锤形或梭形,呈漩涡状。见图1B。传代后细胞增殖速度明显变快,形成多个相互独立的成纤维样细胞。见图1C。
3.2 BMMSC表面标志物的鉴定流式细胞仪检测结果显示,第3代BMMSC表面标志物CD29、CD44的阳性表达率分别为89.18%、87.65%;造血干细胞表面标志物CD45阳性表达率为1.16%。见图2。
3.3 BMMSC的成脂、成骨分化加入成脂诱导液14 d时出现大量透光性良好的大小不等的空泡,排列不规则,油红O染色可见红色脂滴。见图3A。加入成骨诱导细胞液后BMMSC开始变大,长纺锤形细胞数量减少,多角形细胞数量增加,形成大量小结节,诱导至第21天,茜素红染色可见大量橘红色钙结节。见图3B。
3.4 BMMSC对K562细胞增殖的影响与对照组相比,培养24、48、72 h后各实验组K562细胞增殖率逐渐降低,在每个时间点,细胞比例为2∶1的组别K562细胞增殖率均最低。当细胞比例为2∶1时,共培养48、72 h的K562细胞增殖率均低于24 h时K562细胞的增殖率,48 h时K562细胞增殖率最低,差异有统计学意义(P<0.05)。共培养48 h与72 h时K562细胞增殖率无明显差异。见表1。故选择BMMSC和K562细胞比例2∶1的实验组,共培养时间为48 h进行后续实验。
表1 BMMSC对K562细胞增殖率的影响(±s,n=3)
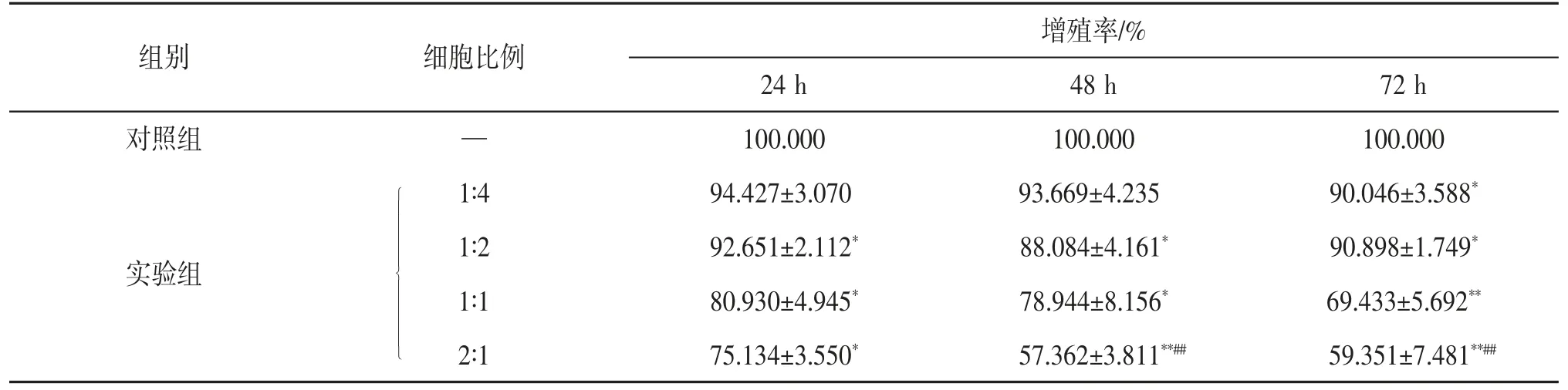
表1 BMMSC对K562细胞增殖率的影响(±s,n=3)
注:与对照组比较*P<0.05,**P<0.01;与培养24 h比较##P<0.01。
增殖率/%24 h 48 h 72 h对照组 — 100.000 100.000 100.000组别 细胞比例实验组■■■■■■■■■■■■■1∶4 94.427±3.070 93.669±4.235 90.046±3.588*1∶2 92.651±2.112* 88.084±4.161* 90.898±1.749*1∶1 80.930±4.945* 78.944±8.156* 69.433±5.692**2∶1 75.134±3.550* 57.362±3.811**## 59.351±7.481**##
3.5 BMMSC对K562细胞衰老的影响与BMMSC共培养48 h后,SA-β-Gal染色衰老阳性细胞呈蓝色。见图4。对照组K562细胞阳性率为(14.500±2.858)%,实验组细胞阳性率为(41.750±5.683)%,与对照组相比,实验组细胞阳性率明显增高,差异有统计学意义(P<0.01)。
3.6 BMMSC对K562细胞周期的影响与BMMSC共培养48 h后K562细胞周期改变。见图5、表2。与对照组相比,实验组K562细胞阻滞在G0/G1期增多,进入S期和G2/M期的细胞减少。
表2 BMMSC对K562细胞周期的影响(±s,n=3)

表2 BMMSC对K562细胞周期的影响(±s,n=3)
注:与对照组比较**P<0.01。
组别 G0/G1期/% S期/% G2/M期/%对照组 59.113±1.141 36.587±1.490 4.300±0.528实验组 72.950±2.247** 23.247±1.811** 3.803±0.504
3.7 BMMSC对K562细胞p16INK4a蛋白表达量的影响与BMMSC共培养48 h后K562细胞的p16INK4a蛋白表达量为(42.703±1.520)kD,对照组p16INK4a蛋白表达量为(17.196±2.196)kD;与对照组相比,实验组p16INK4a蛋白表达量明显升高,差异有统计学意义(P<0.01)。见图6。
4 讨论
骨髓微环境的动态演化参与了白血病细胞的增殖和浸润。对急性髓性白血病的研究表明,骨髓微环境的正常化可减缓疾病进展,证实微环境是白血病患者的新治疗靶点〔12〕。在骨髓微环境中输注间充质干细胞减少了肿瘤负荷并延长了白血病小鼠的生存期〔13〕。这些证据都表明了BMMSC是白血病治疗的一个可靠切入点。间充质干细胞是造血干细胞微环境中异于造血干细胞的一类具有自我更新、修复损伤,具有多向分化潜能的干细胞,能维持造血干细胞的自我更新、增殖分化、归巢迁移等功能〔14〕。小鼠和人间充质干细胞上的细胞表面分子表达谱相似,来源于小鼠的BMMSC能够在体外支持人类造血干细胞的增殖和迁移能力〔15〕,遂使用全骨髓贴法分离小鼠BMMSC与慢性粒细胞白血病K562细胞共培养,体外模拟白血病干细胞龛。
细胞增殖能力降低和SA-β-Gal活性增高是衰老的表现。本研究结果显示,将BMMSC与K562细胞共培养后,能够抑制K562细胞增殖。SA-β-Gal活性一直是使用最广泛的衰老生物标志物,pH=6时,在经历复制性或诱导性衰老的细胞中检测到,但在增殖细胞中不存在〔16〕,被认为是衰老检测的金标准。本研究BMMSC作用于K562细胞后,SAβ-Gal染色细胞阳性率增高,提示BMMSC可诱导K562细胞衰老。
哺乳动物细胞中的癌基因激活导致限制肿瘤生长的增殖应激和衰老诱导。因此,衰老是一种生理性的肿瘤抑制机制,可抑制良性肿瘤病变向恶性肿瘤发展。细胞衰老是指先前具有增殖能力细胞的一种特定形式的高度持久的细胞周期停滞,该细胞对有丝分裂刺激具有抗性,并伴有持续的DNA损伤反应〔17〕。细胞周期的进展取决于细胞通过4个细胞周期检查点,即G1到S过渡、S期检查点、G2到M过渡和有丝分裂纺锤体检查点〔18〕。G1是一个许多信号介入影响细胞分裂和细胞发育程序部署的时期,进一步决定是否自我更新、分化或死亡〔19〕;细胞阻滞在G0/G1期后,失去分裂能力,对肿瘤的增长失去作用。p16INK4a属于INK4基因家族,是常见的衰老相关基因,据报道〔20〕,从BubR1小鼠中去除表达p16INK4a基因的细胞,延缓了小鼠年龄相关疾病的进展。不仅如此,p16INK4a基因在细胞周期中还可以负向调节pRb-E2F通路。p16INK4a基因与CDK4/6结合抑制其激酶活性,从而阻止Rb磷酸化,将其维持在低磷酸化状态,促进Rb与E2F1的结合并导致G1细胞周期停滞。因此p16INK4a不仅可以抑制细胞周期蛋白依赖性激酶,导致G1期停滞,还可以通过长期的高表达推动细胞进入衰老〔21〕。将INK4a基因转染到具有INK4a基因缺陷的K562细胞中,p16INK4a基因诱导K562细胞周期停滞在G0/G1期,并促进活K562细胞的红系分化,还能诱导分化不完全的K562细胞凋亡,提示p16INK4a基因能够抑制K562细胞的功能,可以对K562细胞产生调控作用〔22〕。本研究中BMMSC使K562细胞的p16INK4a蛋白表达明显升高,K562细胞在G0/G1期增多,进入S期和G2/M期的细胞减少。说明BMMSC可以通过上调p16INK4a蛋白的表达抑制K562细胞周期的进展,诱导K562细胞衰老,减少K562细胞的恶性增殖。K562细胞衰老是一个受多因素调节的过程,BMMSC诱导K562细胞衰老是否还有其他调控机制发挥作用有待进一步探讨。该研究为后续体内实验提供了理论基础,为临床白血病诊疗提供了新的靶点和思路。
