降糖乳制品的制备及其贮藏性能
2022-11-16韩瑨
韩 瑨
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
随着社会的飞速发展,消费者对于有健康促进作用食品的需求与日俱增,适合不同年龄段、满足不同营养诉求以及附加不同益生功能的乳制品也越来越受到消费者的青睐[1-2],其中,功能性乳制品最受追捧,这些乳制品功能繁多,如添加益生元促进肠道健康[3]、通过酪蛋白水解产生血管紧张素转换酶(angiontens converting enzyme,ACE)抑制活性肽来控制血压[4]、添加益生菌或植物固醇来降低胆固醇水平[5-6],借助酪蛋白磷酸肽介导促进多元素(钙、铁、锌)的吸收和利用[7]、提高免疫力、调节血脂、抗氧化等。但截止目前,有关降糖乳制品的研究报道相对较少,例如,向乳制品(乳粉)中添加外源性降糖因子Cr3+是主流工艺[8],其原理是生产过程中Cr3+形成一种葡萄糖耐受因子,该因子具有调节胰岛素与胰岛素受体的结合、外周组织胰岛素增敏、改善胰岛素抵抗等多种与降血糖有关的生物学功能[9]。然而,铬属于重金属元素,尽管对人体而言不可或缺,但不能摄入过多,因此乳粉中其含量通常控制在200~300 μg/100 g[10]。此外,还有研究将枸杞、知母、黄芪、山药等多糖作为降糖因子添加入乳粉[11],但此法多糖提取繁琐、操作相对复杂并且机制不够明确,因而产业化的可能性较小。
牛类芽孢杆菌(Paenibacillus bovis)BD3526是一株筛选自西藏生牦牛乳的类芽孢杆菌属新种菌株[12],前期研究表明,牛类芽孢杆菌BD3526发酵乳上清具有较强的体外降血糖活性,将其接种入脱脂乳发酵6 h后的上清对α-葡萄糖苷酶的抑制活性即达80%以上[13],但其活性物质的稳定性尚不明确,尤其在后续作为功能因子添加入食品中再加工时,会受到各工艺步骤和加工条件的影响,因此在试制相关功能性降血糖乳制品前,有必要对其发酵乳上清体外降糖活性的稳定性进行检测。因此,本研究以开发产品为主旨,首先考察牛类芽孢杆菌BD3526发酵乳上清在不同温度和pH值条件下体外降糖效果的稳定性,继而以该上清为核心功能组分,通过不同工艺制备多种降糖乳制品,并对这些产品进行体外α-葡萄糖苷酶抑制活性和微生物指标测定,同时,以常规发酵乳制品为对照,跟踪贮藏期内不同温度下贮藏降糖乳制品的相关指标。
1 材料与方法
1.1 材料与试剂
脱脂乳粉 新西兰Foterra公司;鲜牛乳 上海光明乳业股份有限公司。
牛类芽孢杆菌BD3526(CGMCC No.8333)光明乳业股份有限公司;保加利亚乳杆菌LB340丹尼斯克(中国)有限公司;嗜热链球菌ST-BODY-3丹麦科汉森公司。
MRS琼脂/液体培养基 德国默克公司;M17琼脂/液体培养基 英国Oxoid公司;NaOH、Na2CO3、乳酸 上海国药集团化学试剂有限公司;木糖醇、柠檬酸 安徽中粮生物化学股份有限公司;α-葡萄糖苷酶、对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,pNPG) 德国Sigma公司。
1.2 仪器与设备
HVE-50型高压灭菌锅 日本Hirayama公司;SG-402TX型超净工作台 美国Baker公司;AVANTI J30I型高速冷冻离心机 美国Beckman Coulter公司;HZQ-F160型摇床 苏州培英实验设备有限公司;APV1000型均质机 丹麦APV公司;FSDTM型喷雾干燥机 丹麦GEA Niro公司;FreeZone 12型真空冷冻干燥机 美国Labconco公司;Spectra Max M5型酶标仪美国Molecular Devices公司;GNP-9270型隔水式恒温培养箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 牛类芽孢杆菌BD3526发酵乳上清的体外降糖活性测定
牛类芽孢杆菌BD3526发酵乳上清的制备:将牛类芽孢杆菌BD3526在前述优化条件(培养时间43 h、培养温度29 ℃、脱脂乳质量浓度5 g/100 mL、三角瓶装量50 mL/250 mL)[14]下进行发酵,所得发酵乳经沸水浴灭活5 min后,4 ℃、10 000 r/min离心2 min,得发酵乳上清。
热稳定性实验:取发酵乳上清10 mL分别置于40、50、60、70、80、90、100 ℃水浴保温15 min,取出后冷却至室温,用无菌水补足样品溶液体积至保温前体积,以1 mol/L NaOH溶液调节pH值至6.8,4 ℃、10 000 r/min离心2 min,取上清,以未加热处理的样品为对照组,采用改良的pNPG法[13]测定不同温度处理后样品溶液的体外降糖效果,以α-葡萄糖苷酶活性抑制率表示。
pH值稳定性实验:取发酵乳上清10 mL,用1 mol/L HCl或NaOH溶液调节pH值至2、4、6、8、10、12,置于37 ℃水浴保温30 min,将pH值回调至6.8,离心(4 ℃、10 000 r/min、2 min)取上清,以未经pH值调节处理的样品溶液为对照组,测定不同pH值处理后样品溶液的体外降糖效果。
1.3.2 降糖乳制品的制备工艺
以发酵乳上清为核心功能组分,拟制备3 种降糖乳制品,分别为降糖乳清饮料、降糖乳清粉和降糖乳粉,其主要工艺路线如图1所示。
1.3.3 降糖乳清饮料的制备
降糖乳清饮料的总体工艺路线参考文献[15]并稍作改动,如图1所示,其具体步骤如下:参照1.3.1节所述方法制备牛类芽孢杆菌BD3526的发酵乳上清。将木糖醇完全溶解于50 ℃蒸馏水中制得相当于25%蔗糖甜度的甜味勾兑液,将柠檬酸完全溶解于50 ℃蒸馏水中制得高浓度的酸味勾兑液。将发酵乳上清与甜味勾兑液以1∶1(V/V)充分混合均匀,再与酸味勾兑液缓慢混合直至65 °T酸度,最后经20 MPa均质、110 ℃、15 min杀菌,灌装后即得降糖乳清饮料,该饮料甜度折合成蔗糖甜度为12.5%,酸度为65 °T。
乳清饮料对照样品的制备:以嗜热链球菌和保加利亚乳杆菌发酵乳(发酵条件:嗜热链球菌和保加利亚乳杆菌接种量均为3%、发酵温度37 ℃、发酵时间12 h)制备上清,再参照降糖乳清饮料的后续工艺(勾兑、均质、杀菌、灌装)制得乳清饮料对照组样品。
1.3.4 降糖乳清粉的制备
参照1.3.1节所述方法制备牛类芽孢杆菌BD3526的发酵乳上清,将该上清直接冷冻干燥,包装后即得降糖乳清粉。
乳清粉对照样品的制备:参照1.3.3节所述方法制备嗜热链球菌和保加利亚乳杆菌的发酵乳上清,再参照降糖乳清粉的后续工艺(冷冻干燥、包装)制得乳清粉对照组样品。
1.3.5 降糖乳粉的制备
参照1.3.4节所述方法制备降糖乳清粉,将该乳清粉与乳粉以1∶9(m/m)进行混料,包装后即得降糖乳粉。
乳粉对照样品的制备:参照1.3.3节所述方法制备嗜热链球菌和保加利亚乳杆菌的乳清粉对照样品,再参照降糖乳粉的后续工艺(混料、包装)制得乳粉对照组样品。
1.3.6 乳制品体外降糖效果的测定
降糖乳粉及乳清粉待测样品的制备:取乳粉(或乳清粉)完全溶解于无菌水中,配制成15 mg/mL(或100 mg/mL)的溶液,以乳酸调节pH值至4.0,4 ℃、10 000 r/min离心2 min,取上清,以1 mol/L NaOH溶液调节pH值至6.8,再次4 ℃、10 000 r/min离心2 min,取上清,即得乳粉(或乳清粉)待测样品。
降糖乳清饮料待测样品的制备:取乳清饮料以1 mol/L NaOH溶液调节pH值至6.8,4 ℃、10 000 r/min离心2 min,取上清,即得乳清饮料待测样品。
参照1.3.1节所述方法测定上述待测样品的体外降糖效果。
1.3.7 微生物指标的测定
降糖乳粉及其对照样品的主要微生物指标参照GB 19644—2010《食品安全国家标准 乳粉》测定,具体检测方法为:大肠杆菌参照GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》、金黄色葡萄球菌参照GB 4789.10—2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》、沙门氏菌参照GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》、菌落总数参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》测定。
降糖乳清粉及其对照样品的主要微生物指标参照GB 11674—2010《食品安全国家标准 乳清粉和乳清蛋白粉》测定,具体检测方法为:金黄色葡萄球菌参照GB 4789.10—2016、沙门氏菌参照GB 4789.4—2016测定。
降糖乳清饮料及其对照样品的主要微生物指标参照GB 7101—2015《食品安全国家标准 饮料》测定,具体检测方法为:霉菌、酵母参照GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》、大肠杆菌参照GB 4789.3—2016、菌落总数参照GB 4789.2—2016测定。
1.3.8 贮藏实验
将上述方法制备的降糖乳制品和对照样品分别置于8、25、60 ℃条件下贮藏6 个月,期间每3 个月取样1 次,参照1.3.6节和1.3.7节所述方法测定各组样品的体外降糖活性和微生物指标的变化。
1.4 数据处理
所有实验均平行测定3 次,结果表示为平均值±标准差。应用SPSS软件进行显著性分析,并使用Excel软件绘图。
2 结果与分析
2.1 牛类芽孢杆菌BD3526发酵乳上清的体外降糖活性
由图2可知,各组样品的α-葡萄糖苷酶活性抑制率均为90%左右,与对照组样品无显著差异,表明牛类芽孢杆菌BD3526发酵乳上清对温度(40~100 ℃)不敏感,其中的活性成分不会因环境温度的升高导致结构受损,研究表明,天然来源(动物[16]、植物[17]或微生物[18])的α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,α-GI)普遍对高温具有一定的耐受性,但也有少量中药来源的α-GI遇热会失活[19]。
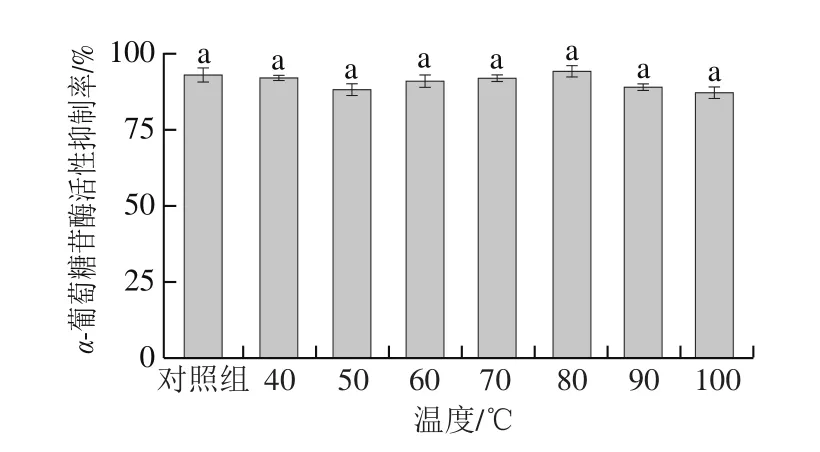
图2 不同温度对牛类芽孢杆菌BD3526发酵乳上清体外降糖活性的影响Fig.2 Effect of temperature on in vitro hypoglycemic activity of fermented milk supernatant
由图3可知,中性pH值环境(pH 6~8)下,发酵乳上清的抑酶效果与对照组完全一致(α-葡萄糖苷酶活性抑制率90%以上),而当环境pH值逐渐酸化或碱化后,其降糖活性也呈现略微下降的趋势,这种现象一方面可能是α-GI活性受到酸碱环境的影响,另一方面酸碱回调带来的少量稀释作用也是可能的原因之一。由于人体胃液pH值可低至2.0左右[20],因此,极端pH值的耐受能力有利于活性成分在体内稳定地发挥降糖效果,自然界中有许多相同特性的α-GI,如紫菜酶解产生的肽类α-GI[21]、知母α-GI[22]等。

图3 不同pH值对牛类芽孢杆菌BD3526发酵乳上清体外降糖活性的影响Fig.3 Effect of pH on in vitro hypoglycemic activity of fermented milk supernatant
2.2 降糖乳制品的体外α-葡萄糖苷酶抑制活性
上述稳定性实验已证实牛类芽孢杆菌BD3526发酵乳上清具有强烈且稳定的体外降糖活性。由图4可知,新鲜制备而成的降糖乳清饮料、降糖乳清粉和降糖乳粉的体外α-葡萄糖苷酶活性抑制率分别为57%、48%和37%,这些产品间的抑制率差异主要来自加工过程中功能性成分(发酵乳上清)勾兑比例的不同;另一方面,对照组几乎没有抑酶效果(<3%),这是因为传统乳酸菌(保加利亚乳杆菌、嗜热链球菌等)普遍没有代谢牛乳产α-GI的性能,因此很难发现与发酵乳制品降血糖相关的报道。
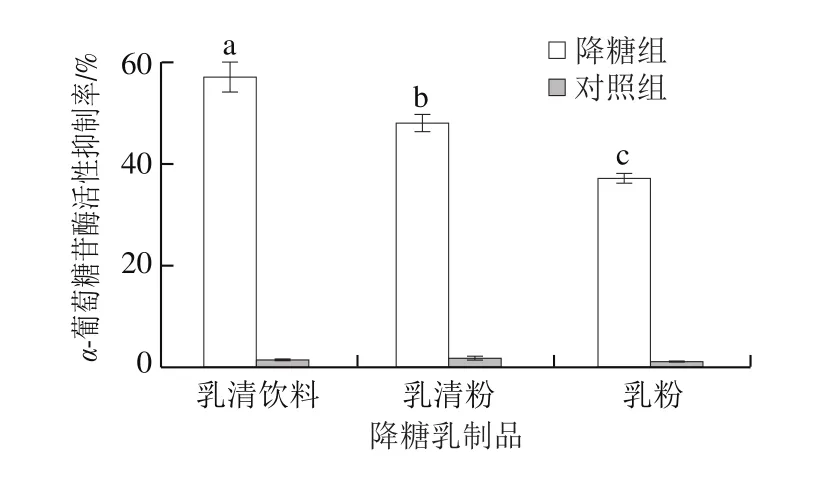
图4 降糖乳制品的体外α-葡萄糖苷酶抑制活性Fig.4 α-Glucosidase inhibitory activity of hypoglycemic dairy products in vitro
2.3 降糖乳制品的微生物指标
由表1可知,所有新鲜制备而成的受试样品的微生物指标都符合国标要求,并且与对照组样品基本相同。以乳清饮料为例,降糖样品组中大肠杆菌、霉菌、酵母和菌落总数分别为(1±1)、(3±1)、(2±1)、(20±3) CFU/mL,对照组为(2±1)、(2±2)、(2±2)、(18±4) CFU/mL,2 组检测结果均满足GB 7101—2015(≤10、≤50、≤20、≤1 000 CFU/mL)。各组数据经SPSS软件分析后发现降糖样品在微生物指标方面与常规菌株制备的产品无显著差异。
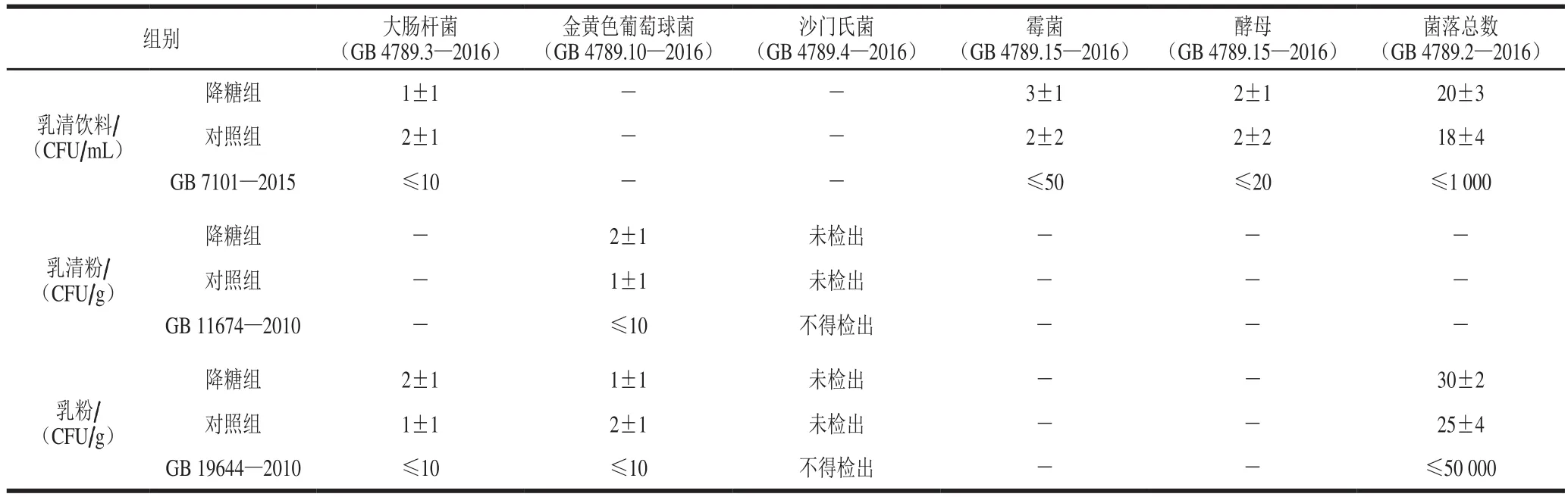
表1 降糖乳制品与对照样品的微生物指标比较Table 1 Comparison of microbiological indexes between hypoglycemic dairy products and control sample
2.4 降糖乳制品贮藏期内体外α-葡萄糖苷酶抑制活性变化
由图5可知,虽然降糖乳清饮料、降糖乳清粉及降糖乳粉对α-葡萄糖苷酶活性的抑制率各不相同,然而在贮藏期内不同温度条件下的各组抑制率无显著差异。在8 ℃条件下贮藏0、3、6 个月后降糖乳清饮料的α-葡萄糖苷酶活性抑制率分别为57%、58%和56%,25 ℃和60 ℃条件下的抑酶情况与8 ℃类似,这种稳定的抑酶效果表明牛类芽孢杆菌BD3526发酵脱脂乳合成的α-GI具有一定的高温耐受能力。

图5 贮藏期内降糖乳制品的体外α-葡萄糖苷酶抑制活性变化Fig.5 Changes in α-glucosidase inhibitory activity of hypoglycemic dairy products in vitro
2.5 降糖乳制品贮藏期内微生物指标变化
微生物指标是衡量被检动植物性产品的加工环境和卫生质量,并判定其能否食用的重要科学依据,定期监测该指标有利于防止或减少因微生物超标而引发的食物中毒等疾病,通常认为,微生物指标控制较好的产品保质期内发生变质的可能性较小。由于采用的菌株牛类芽孢杆菌BD3526是一株类芽孢杆菌属微生物,这类菌株的发酵乳此前报道较少,因此,有必要对其发酵乳制品进行微生物指标的跟踪监测,为了增加样品组和对照组的对比性,以保藏期内变化幅度较大的菌落总数作为评价指标,对降糖乳清饮料和降糖乳粉样品进行测定。
由图6可知,乳清饮料对照组的菌落总数随着贮藏时间的延长而显著增加,8(低温)、25(常温)、60 ℃(高温)条件下贮藏期末对照组样品中菌落总数分别为(174±9)、(420±19)、(74±4) CFU/mL,其中25 ℃贮藏的产品中菌落总数最多,说明常温是产品中微生物增殖的适宜温度,该产品在此温度下微生物指标更易超标,60 ℃贮藏的产品中菌落总数最少,说明高温不利于微生物的大量增殖,低温贮藏的产品菌落总数也有一定程度的增长,却明显少于常温贮藏的产品,其中主要增殖的是嗜冷菌和耐寒菌。相比之下,降糖乳清饮料在不同温度(8、25、60 ℃)下贮藏6 个月后,菌落总数始终维持在35 CFU/mL以下,与初始值无显著差异,这可能是因为牛类芽孢杆菌BD3526能合成细菌素类的抑菌物质,对多种革兰氏阴性菌和致病菌都有很好的抑制效果[23-24],所以其产品的微生物指标优于对照组。降糖乳粉及其对照样品中也发现了相同的微生物变化趋势。

图6 贮藏期内降糖乳制品的菌落总数变化Fig.6 Changes in total viable count of hypoglycemic dairy products storage at different temperatures
3 讨 论
利用具有强烈且稳定体外α-葡萄糖苷酶抑制作用的牛类芽孢杆菌BD3526发酵乳上清作为核心功能组分,制备获得3 种降糖乳制品:降糖乳清饮料、降糖乳清粉和降糖乳粉,根据自身的产品特点,可将其定位于不同的目标消费群体。前期报道指出,牛类芽孢杆菌BD3526能合成一种具有凝乳酶功能的金属蛋白酶,该酶可将β-乳球蛋白等水解为具有多种益生功能(抑制ACE、抗菌、免疫调节等)的肽类物质[25-27],因此,以牛类芽孢杆菌BD3526发酵乳上清为原料勾兑制备的乳清饮料中含有大量肽类物质,更适合运动后饮用,可同时补充水分和多种生物活性肽。与乳清饮料相比,乳清粉因其是冻干粉剂状态而易于存放且便于携带。降糖乳粉则可以满足高龄人群对降血糖和补充钙质的双重需求。
目前,已有相当数量的研究公开了降糖乳酸菌的筛选工作[28-29],并且部分结构改造的α-GI的体内降血糖效果得到了动物实验确认[30]或分子机制得到了揭示[31]。然而,当前的乳制品市场鲜见以降血糖为主要功效宣称的产品,可能的原因是:1)菌株代谢缺陷,即筛得的降糖株无法发酵牛乳制得乳制品,如植物乳杆菌[32];2)已知的降糖菌株基本均不在《可用于食品的菌种名单》内,如多黏类芽孢杆菌[33];3)缺少关键的人群实验数据支持,乳企对产品的前景缺乏信心,不予投资生产。尽管以类芽孢杆菌作为发酵剂制备功能性发酵乳制品基本没有,但是本研究制备的牛类芽孢杆菌BD3526降糖乳制品为将来相关产品的市场化提供了一定的理论参考。
4 结 论
本研究以牛类芽孢杆菌BD3526发酵乳上清为研究对象,验证了其体外α-葡萄糖苷酶抑制活性的稳定性,进而将其作为核心加工原料,利用不同工艺制备了3 种降糖乳制品:降糖乳清饮料、降糖乳清粉和降糖乳粉,经检测,上述产品在贮藏期内微生物指标符合国标,且体外降血糖效果稳定、有效。