乳酸菌DNA甲基化的研究进展
2022-11-16焦杨波
焦杨波,赵 洁
(内蒙古农业大学食品科学与工程学院,乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古 呼和浩特 010018)
许多细菌作为病原菌与疾病密切相关,主要通过接触、呼吸道、消化道及蚊虫叮咬等途径在健康人体间传播疾病。细菌也在发酵食品[1-2]、环境处理[3-4]及医药[5]等多个领域被人类广泛利用,例如,利用乳酸菌发酵酸乳、酵母菌酿酒,利用细菌进行污水处理及部分抗生素的制造等。
对DNA、RNA、蛋白质的结构和功能进行调控的DNA甲基化、RNA干扰、组蛋白修饰及染色质重塑等是表观遗传学的主要调控方式[6-7]。表观遗传广泛存在于所有生命体中,原核生物因其结构相对简单,因此,DNA甲基化是原核生物表观遗传的主要调控手段。在不改变核苷酸序列的前提下,DNA甲基化不但可以帮助细菌构建限制修饰系统来抵御外源DNA的入侵,而且可以控制基因的表达,是细菌进化和繁衍过程的重要部分[8]。
本文主要结合已有细菌甲基化研究,介绍甲基化及测序技术在病原菌、乳酸菌DNA甲基化等方面的研究。
1 甲基化组学
随着分子生物学的发展,测序技术与生物信息学分析日趋成熟。因此,从基因组层面了解细菌愈发便利。研究发现,表观遗传修饰可能是造成不同菌株间基因型相似而表型存在差异的原因[9-10]。表观遗传学调控是指由于化学修饰等原因导致基因表达发生可遗传的变化。DNA甲基化是研究最深入的表观遗传调控机制之一,其机制是由于甲基转移酶(methyltransferase,MTase)将S-腺苷甲硫氨酸(S-adenosyl-methionine,SAM)上的甲基基团(—CH3)转移至腺嘌呤和胞嘧啶而形成的[8],其特点是不改变基因序列。在细菌基因组中存在3 种DNA甲基化形式[11-13]:N6-甲基腺嘌呤(6mA)、N4-甲基胞嘧啶(4mC)和5-甲基胞嘧啶(5mC),研究最多的是6mA和4mC。真核生物中主要存在5mC,动物基因组甲基化主要是CG碱基的甲基化[14];高等植物中通常存在于CG、CHG和CHH(H为A、T或C碱基)3 个序列中,且在不同植物中观察到的甲基化程度不同[15];脊椎动物DNA甲基化的分布范围具有全局性[16]。以细菌为代表的原核生物中,SAM在MTase的作用下将甲基基团转移到胞嘧啶的第4位碳上形成4mC,转移到胞嘧啶第5位碳上形成5mC,转移到腺嘌呤的第6位碳上形成6mA[17]。
1.1 MTase
细菌以SAM作为甲基供体,通过与限制修饰系统相关的MTase和孤儿MTase两类酶实现6mA、5mC和4mC甲基化修饰;6mA在细菌中出现的频率最高,它在原核生物中对于调控DNA复制、修复、转座、转录及细胞防御起着重要作用[18]。4mC在细菌中出现的频率低于6mA,嗜热菌的甲基化修饰以4mC为主[19]。细菌之所以能保持自身的稳定遗传,是由于其拥有一种免疫系统或防御机制[20],这种机制或系统被称为限制性修复系统,它的作用包括阻止细菌内源DNA降解以及阻挡外源DNA入侵,从而保护细菌。
与限制性修复系统相关的MTase,可以识别出发生甲基化的基因位点和限制性内切酶酶切位点一致的DNA序列,从而阻止胞内产生DNA致死性切割[21]。而在细胞内单独发挥作用的孤儿MTase,与限制性修复系统相关的MTase不同的是,它没有与之对应有功能的限制性核酸内切酶[22]。孤儿MTase主要分为3 种:DNA腺嘌呤MTase(DNA adenine MTase,Dam)、细胞周期调控MTase(cell cycle-regulated MTase,CcrM)和DNA胞嘧啶MTase(DNA cytosine MTase,Dcm)[23]。与限制修饰系统相关的MTase和孤儿MTase这2 种酶对于细菌除了具有防御功能外,还在细菌的其他方面起着重要作用,例如,细菌的进化及基因表达调控[24]。表1呈现了不同甲基化类型细菌MTase及识别基序。
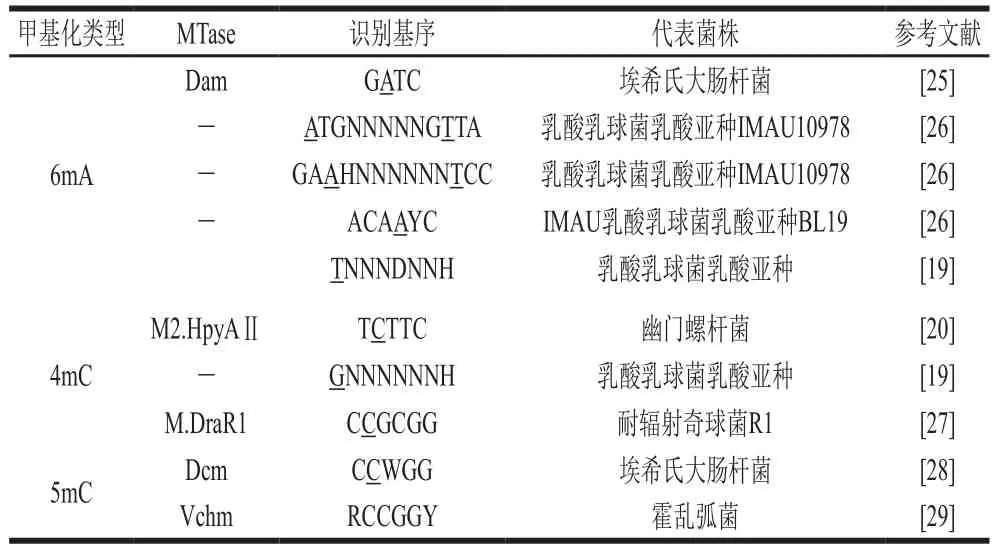
表1 不同甲基化类型细菌MTase及识别基序Table 1 Bacterial MTase and recognition motifs of different methylation types
1.2 甲基化组学在细菌病原菌方面的应用
基于噬菌体侵染细菌的研究开启了原核生物DNA甲基化的研究。由于噬菌体侵染细菌宿主,呈现出不同的甲基化模式,也正是因为这种不同的模式保护宿主的基因免受同源性限制性内切酶的消化,并能防止宿主免受外源噬菌体DNA的侵染[30]。
在原核生物中,DNA甲基化参与防止外来DNA入侵、细胞周期调控、DNA错配修复和基因表达调控等多个细胞过程[24]。Blow等[30]通过对200余种不同细菌和古细菌等的研究发现,超过180 种(高于90%)的生物体中存在DNA甲基化,并在生物体的毒力调节、抗生素耐药性、氧化适应、营养匮乏等生理生化中发挥至关重要的作用。5mC和4mC甲基化修饰信号对幽门螺杆菌的生命活动起着重要作用。Kumar等[31]研究发现,5mC参与幽门螺杆菌调控基因的表达,在其运动性、黏附和毒力中起着重要作用。随后,该团队发现一个具有全局性的表观调控因子4mC参与幽门螺杆菌致病机制,与4mC修饰相比,缺失4mC修饰的菌株中102 个基因发生差异表达,主要体现在菌株自然转化能力、编码毒力基因、核糖体组装和细胞成分等方面[12]。此外,Cohen等[32]研究抗生素胁迫对大肠杆菌表型的影响,从基因组角度解释其存活情况,结果表明,基序GATC发生6mA甲基化的菌株会对其存活有促进作用,而未发生6mA甲基化的菌株,整个细胞会发生毒性DNA断裂。Nye等[33]利用单分子实时测序(single molecule real time sequencing,SMRT)技术对化脓性链球菌MEW123进行测序,结果共测出6mA甲基化位点412 个,发生在基因组的基因编码区(92%)的6mA甲基化位点占比很大,且正是这些甲基化修饰的存在影响毒力基因Mga的表达。
1.3 乳酸菌甲基化组学
目前,有关甲基化的研究主要是针对致病菌,而极少有优良发酵剂乳酸菌的甲基化研究。世界上第1株和中国第1株全基因组测序的乳酸菌分别于2001年和2008年完成[34-35],至此标志着乳酸菌基因组时代的来临。基于基因敲除、SMRT等技术手段对益生菌干酪乳杆菌Zhang(Lactobacillus caseiZhang)的LCAZH_2056(pglX)和LCAZH_20542 种基因MTase的研究发现,该菌株基因组上的6mA甲基化表型不仅可以调控菌株对数生长期相关基因的表达,进而影响菌株生长,还有利于菌株的抗氧胁迫能力[36]。郑慧娟等[26]通过对2 株乳酸乳球菌乳酸亚种IMAU10978和BL19的研究发现,2 株乳酸菌在发酵表型上存在差异。例如,发酵速率、蛋白质水解与产生香气物质等方面,这些发酵特性差异有可能与6mA甲基化密切相关。此外,结合基因组学和甲基化组学对嗜热链球菌的基因型和生产功能特性进行研究,结果发现,多个差异甲基化基因富集于嘌呤代谢和萜类化合物骨架生物合成等代谢通路,而这些代谢通路有可能是调控嗜热链球菌产酸特性的因素[37],揭示了甲基化对嗜热链球菌产酸特性可能的调控机制。
综上所述,在不改变遗传信息的情况下,DNA甲基化同样对乳酸菌的基因表达和表观特性产生影响。甲基化现象与乳酸菌的重要生理过程密切相关。目前,国内外针对乳酸菌甲基化修饰及其生物学效应的系统报道较少。解密乳酸菌基因组上的DNA甲基化“遗传密码”能够为乳酸菌功能基因组学和生物特性研究以及优良乳酸菌菌种筛选及其应用开发提供理论参考。
2 甲基化组学研究技术
过去几十年,由于测序技术迅速发展,使得测序成本不断降低,为基因组研究带来极大利好。Zhao Jie等[38]对分离自中国和蒙古国不同地区发酵乳中的185 株嗜热链球菌进行基因组重测序,从群体遗传学角度解析嗜热链球菌基因型与表型之间的关系,定位与产酸能力相关的功能基因。在此基础上,研究团队进一步在表观遗传学上探索嗜热链球菌表型特征差异产生的本质。将基因组测序技术运用到DNA甲基化修饰研究中,可以在全基因组层面获得更全面的DNA甲基化信息。
2.1 传统甲基化检测技术
传统的甲基化检测方法由于自身存在一定的局限性,只能对发生甲基化修饰的DNA含量和类型进行定量和鉴别,未能对特定的序列和单核苷酸水平上的全基因组甲基化进行分析,从而无法找到新的甲基化位点[39]。随着重亚硫酸盐测序的出现,解决了这一难题,因此该测序的发现被誉为是DNA甲基化研究中的里程碑[40]。利用重亚硫酸盐法处理DNA,可以将没有发生甲基化的胞嘧啶转化为尿嘧啶,从而可以从单个核苷酸检测的水平检测到胞嘧啶甲基化,进而实现胞嘧啶甲基化的全基因组分析。与未发生甲基化的DNA相比,DNA中发生的甲基化产生了不同碱基组成,这种差异容易使用常规的测序技术对其进行定量分析。而对于腺嘌呤甲基化的研究则起步较晚,在20余年以后才随着SMRT的发展达到了单碱基的分辨率[36]。
根据原理,目前DNA甲基化检测方法可分为3 类。第1类是鉴定DNA序列甲基化状态,这类方法主要是使用甲基化敏感的限制性内切酶鉴定[41-42]。再结合Southern印迹区分非甲基化与甲基化相关序列,此法仅对已知限制性酶切作用位点情况下适用。第2类是以重亚硫酸盐修饰DNA为基础而发展的多种检测方法[43-44],例如,用亚硫酸钠处理甲基化DNA,经聚合酶链式反应(polymerase chain reaction,PCR)及测序技术鉴定序列差异性的甲基化特异PCR法等,对胞嘧啶甲基化具有很高的灵敏性,但是对于4mA和6mA不适用。第3类是一些其他方法[45-47],例如,将DNA降解为单核苷酸后再利用液相色谱或气相色谱等精密仪器检测、利用特异性识别甲基化修饰DNA的蛋白或抗体等,从而可以更精确、灵敏地检测甲基化信号,但是仍无法确定发生甲基化的具体位点。其中以重亚硫酸盐修饰DNA是甲基化分析研究的重要方法,重亚硫酸盐测序主要应用于真核生物的甲基化检测,步骤是基于2代高通量测序技术对预先重亚硫酸盐处理的DNA再PCR扩增基因模板进行测序,后续结合生物信息学分析甲基基团的修饰及修饰的定位[40,48-50]。
传统的检测方法有很多局限性。例如,操作过程耗时、繁琐、对仪器要求严格、成本高等缺点。不仅费时费力,而且无法分析整个基因组的甲基化,很难找到新的甲基化位点[51]。
2.2 SMRT技术在细菌甲基化修饰中的应用
随着测序技术的发展和革新,以SMRT为代表的第3代测序技术已渐渐趋于成熟,并且获得研究人员的青睐。SMRT是先用荧光标记样品核苷酸实时成像,与此同时沿着单个DNA模板进行合成的一种测序技术,零模波导(zero-mode waveguides,ZMW)孔是一种直径20~50 nm的圆形纳米孔,是SMRT技术的核心,对于SMRT技术实现超长读长的关键因素之一的DNA聚合酶被固定在ZMW底部[52]。DNA聚合酶除了实现DNA的合成速率外,同时还能保持测序延续性。本研究团队利用SMRT技术和2代测序技术对植物乳杆菌P-8(Lactobacillus plantarumP-8)进行基因组测序比对,结果发现,SMRT技术多检测出1 个GC含量为39.7%、长度为15.174 kb的质粒[53]。
由于SMRT测序成本低、超长读长、精准性高、速度快等突出优点被迅速应用到DNA甲基化研究中[54-55],全基因组水平上分析DNA甲基化图谱得以实现,它能够快速、高效地识别甲基化,并且可以直接对6mA、5mC和4mC 3 种甲基化类型同时进行检测,并且利用生物信息学分析可以得到多种不同种类的甲基化基序[37,55]。SMRT技术在其测序过程中会出现脉冲记录峰,在检测过程中若检测到有修饰的碱基时,脉冲峰会发生变化[19]。这一技术的主要优势在于能够使整个基因组产生6mA、5mC等检测信号,且对于不同甲基化修饰的检测灵敏度由高到低依次为6mA、5mC和4mC[19,56]。利用“边合成边测序”的第3代测序技术,使得从单分子水平对生物分子的实时分析得以实现,无需PCR扩增[57]。
在牛结核分枝杆菌无毒株卡介苗BCG的研究中,采用第3代测序技术对BCG菌株测序分析,结果显示,BCG菌株含有3 种DNA甲基化基序位点,且均为6mA修饰[58]。Murray等[59]对硫还原泥土杆菌(Geobacter metallireducens)、需盐色盐杆菌(Chromohalobacter salexigen)、布罗加尼弧菌(Vibrio breoganii)、蜡样芽孢杆菌(Bacillus cereus)和空肠弯曲杆菌(Campylobacter jejuni)的2 个亚种,共6 株细菌采用PacBio SMRT测序技术进行全基因组序列测定,得到这些细菌的甲基化信息,与以往的研究方法结果不同,发现了多个新的6mA和4mC甲基化模式,并鉴别出不同甲基化模式相应的DNA MTase。Krebes等[60]对2 株幽门螺杆菌的甲基化组进行研究,不同菌株间甲基化模式有很大区别,高度甲基化存在于幽门螺杆菌基因组中,且对基因表达、宿主间相互作用及菌株致病性有影响,丰富了幽门螺杆菌的遗传多样性。此外,Cooper等[61]也采用PacBio SMRT测序技术对4 株不同血清型的大肠埃希氏菌(Escherichia coli)基因组进行测定。该研究表明,有一部分菌株毒力产生与其DNA的甲基化相关,这4 株不同血清型菌株的祖先都是能够致使胃肠道感染的肠道致病性大肠杆菌,但也有一部分菌株的毒力产生是由于获得产志贺毒素的原噬菌体而逐渐转化为毒力型菌株。以上研究均已表明,SMRT技术在原核细菌(尤其是致病菌)中由于不同DNA甲基化模式,导致菌株间毒力产生、基因表达及生命活动发生差异中已有应用,且被越来越多的学者研究。对于乳酸菌甲基化研究,目前正处于起步阶段。
2.3 SMRT技术在乳酸菌甲基化修饰中的应用
Zhang Wenyi等[62]利用SMRT测序对L.caseiZhang和L.plantarumP-8进行甲基化组分析,在L.caseiZhang基因组中鉴定识别到一种6mA甲基化修饰,而L.plantarumP-8中未发现。宋宇琴[63]利用SMRT方法,在9 株保加利亚乳杆菌的基因组中发现了6mA和4mC甲基化修饰及37 个甲基化基序,构建出德氏乳杆菌保加利亚亚种的甲基化位点图谱;菌株的发酵特性与发生甲基化修饰有关,或是参与菌株对于外来入侵的防御机制和功能基因的调控;此外,利用SMRT对产酸性能差异较大的22 株代表性嗜热链球菌进行研究,结果显示,被划分为快产酸和慢产酸的2 个类群菌株存在多个4mC和6mA差异甲基化基因。上述研究均已显示出基于SMRT技术的DNA甲基化分析在乳酸菌中得到应用,而且会应用越来越广泛,并逐渐发展为探索乳酸菌基因型与表型特征相关性的一种技术手段。从甲基化修饰角度对乳酸菌进行研究,极大丰富了人们对乳酸菌的认识,为深入解析乳酸菌的遗传进化历程、乳酸菌资源的利用和优良发酵剂的研究提供坚实的理论基础。
3 结 语
DNA甲基化是非常重要的基因表达调控之一,其在细菌疾病的研究中越来越占据重要的地位,而对于发酵食品乳酸菌的研究正处于起步阶段。DNA甲基化的发生有利于细菌高水平基因表达的实现,对于细菌适应各种不同的生活环境提供了独立于DNA序列变化的表观遗传学调控机制,因此其可以成为微生物耐药性、抗逆性和致病性等诸多菌种特殊性能研究以及微生物与环境相互作用研究的热点前沿。不同的检测方法具有其独特的优越性和局限性。SMRT为DNA甲基化研究提供了新的平台,由于其成本低、超长读长、精准性高、速度快等突出优点被迅速应用到DNA甲基化研究中。将乳酸菌的甲基化组学研究与SMRT技术相结合,有助于获得甲基化位点的特征和在乳酸菌中整个基因组的准确分布,以及特定MTase相关基因的表达,更有助于理解甲基化修饰在乳酸菌中的发生和在乳酸菌发酵机制中的作用。此外,它可以成为研究乳酸菌基因型和表型相关性的一种方法,丰富对于乳酸菌的认识,从基因水平揭示乳酸菌在发酵食品方面的机理,从而可以为发酵工业优良乳酸菌的筛选和应用提供理论参考。