微载体规模化培养草鱼鳔细胞以增殖Ⅱ型草鱼呼肠孤病毒的工艺研究
2022-11-11杨玉茹王英英周文礼尹纪元石存斌
杨玉茹,王英英,王 庆,周文礼,尹纪元,石存斌
(1.天津农学院水产学院,天津 300384;2.中国水产科学研究院珠江水产研究所,农业农村部渔药创制重点实验室,广东省水产动物免疫与绿色养殖重点实验室,广州 510380)
草鱼(Ctenopharyngodon idella)是我国最重要的淡水经济鱼类之一,其产量约占全国淡水养殖总量的18%,其产值一直稳居我国养殖淡水鱼的首位[1]。草鱼呼肠孤病毒(grass carp reovirus,GCRV)会引起草鱼出血病,近些年大规模暴发的草鱼出血病严重地阻碍了草鱼养殖业的健康发展[2-3]。草鱼呼肠孤病毒在血清学上尚无系统分类。基于各分离株不同基因节段编码的氨基酸序列构建的系统进化树表明,我国的GCRV分离株可分为3个基因型,分别是以873为代表的基因Ⅰ型病毒(GCRV-Ⅰ)、以HZ08为代表的基因Ⅱ型病毒(GCRV-Ⅱ)和以HGDRV为代表的基因Ⅲ型病毒(GCRV-Ⅲ)[4-7]。目前,国内流行的GCRV基因型主要为GCRV-Ⅱ,占阳性检出比例95%以 上[8]。与GCRV-Ⅰ和GCRV-Ⅲ相 比,GCRV-Ⅱ对鱼体致病性强,但对细胞敏感性弱,接种常见的鱼类细胞均不能产生明显的细胞病变效应(cytopathic effect,CPE),且病毒增殖滴度较低[9],不利于诊断和防控产品的研发。YANG等[10]建立的草鱼鳔组织细胞系(grass carp swim bladder cells,CiSB)对Ⅱ型GCRV敏感,可用于增殖Ⅱ型GCRV的研究。
迄今为止,尚无任何特效药物可用于草鱼出血病的治疗,免疫预防是最有效的防控措施[11]。传统的疫苗主要包括灭活疫苗和减毒疫苗,基因工程疫苗的研究也取得了一定的进展[12]。但已有疫苗研发是以针对基因Ⅰ型GCRV为主,而针对流行基因Ⅱ型GCRV疫苗研究相对滞后[13]。基于分子流行病学数据,采用新分离的流行株型进行疫苗制备,是目前防控草鱼出血病的关键。对草鱼细胞和病毒流行株的大规模培养技术的研究,是草鱼出血病疫苗规模化生产的重要基础[14]。
新型的微载体悬浮培养细胞技术具有单位体积利用率高、参数易控制等优点,目前在哺乳动物细胞培养及产物制备领域已经有了较为广泛的应用,如狂犬病疫苗等已实现工业化的大规模生产[15]。在水产动物疫苗研发中微载体培养技术仍然处于探索阶段,CHEN等[16]建立了基于低血清培养的鲑鱼属鱼类(Oncorhynchus)胚胎细胞(Chinook salmon embryo cells,CHSE)的大规模培养体系;王维玲等[17]利用Cephodex微载体对鲫(Carassius auratus)脑组织细胞(gibel carp brain cells,GiCB)和鲤疱疹病毒Ⅱ型(cyprinid herpesvirusⅡ,CyHV-2)的规模化条件进行了探索和优化;贾路路等[18]优化了大鲵(Andrias davidianus)肌肉细胞(giant salamander muscle cells,GSM)和大鲵虹彩病毒(Chinese giant salamander iridovirus,GSIV)的Cytodex 3微载体培养体系等。在草鱼出血病疫苗规模化生产工艺上,叶雪平等[19-20]利用GT-2微载体分别对草鱼的吻端细胞ZC-7901和胚胎细胞CP-80以及草鱼呼肠孤病毒的培养条件进行了研究。刘秋凤等[21]对草鱼CIK细胞与草鱼呼肠孤病毒在Cephodex结合微载体规模化培养的工艺条件进行了优化,但目前还未见针对流行基因型Ⅱ型GCRV的大规模细胞培养、疫苗生产的相关研究报导,微载体细胞培养技术在水产疫苗应用上尚未成熟,已有研究都处于初期摸索阶段。
本研究利用微载体培养CiSB细胞,并对大规模培养细胞工艺进行优化探索,同时进行Ⅱ型GCRV扩增培养,以期为草鱼出血病Ⅱ型GCRV疫苗的制备和工业化生产提供技术参考。
1 材料与方法
1.1 实验材料
草鱼鳔细胞系(CiSB)由本实验室建立并保存,其培养条件为含10%胎牛血清的M199培养基,培养温度为28℃;草鱼呼肠孤病毒HN1307株(GCRV HN1307)由本实验室从患病草鱼上分离鉴定并保存[22]。
1.2 主要试剂与仪器
M199培养基、胎牛血清(fetal bovine serum,FBS)和胰酶购自美国Gibco公司;125 mL、1 L双侧臂细胞培养瓶购自美国Wheaton公司;底面积75 cm2细胞培养瓶(T-75)购自美国Corning公司;微载体选择Cytodex 1(GE,美国);磁力搅拌装置为Micro-Stir低速磁力搅拌器(Wheaton,美国);全自动细胞计数仪为Countstar BioTech(艾力特,上海)。
1.2 实验设计
1.2.1 细胞与病毒培养
将CiSB细胞在T-75培养瓶中传代培养。接种103拷贝数·μL-1浓度1 mL GCRV HN1307至单层的CiSB细胞中,7 d后收获病毒,-80℃条件下反复冻融3次,然后在4℃条件下以5 000 r·min-1离心30 min去除细胞碎片。测定病毒拷贝数并置于-80℃冰箱保存备用[23]。
1.2.2 微载体预处理
称量干燥后的微载体并加入硅化过的玻璃瓶中,在无Ca2+和Mg2+的磷酸缓冲液(HBSS)(50~100 mL·g-1Cytodex 1)在37°条件下水合3 h。膨胀后去上清液,用新鲜的HBSS(30~50 mL·g-1Cytodex 1)洗涤微载体。洗涤后去上清液,加入新鲜的HBSS(30~50 mL·g-1Cytodex 1)在121℃条件下高压蒸汽灭菌30 min,置4℃冰箱备用。
1.2.3 最佳起始条件与间歇搅拌方式的确定
取对数生长期的CiSB细胞接种于125mL规格的双侧壁细胞培养瓶内,按表1中的起始条件与贴壁期间歇搅拌条件进行培养,并于接种后0.25 h、0.5 h、0.75 h、1 h、1.5 h、2 h、3 h、4 h时取样观察CiSB细胞在微载体上的贴附情况,计算CiSB在Cytodex 1上的贴壁率(贴壁率=1-未贴壁细胞数/接种细胞数×100%),并绘制不同时间的贴附曲线,以获得细胞微载体悬浮培养最优起始及间歇搅拌方式参数。

表1 贴壁期循环搅拌参数设置Tab.1 Parameter setting of agitation procedure during cell attachment
1.2.4 最佳胰酶消化参数的确定
用125 mL双侧壁细胞培养瓶培养细胞,24 h后,在超净台中于搅拌状态下均匀取5 mL培养物至离心管中,静置使微载体沉降,吸去上清液并用HBSS清洗2次。在4℃和37℃条件下,分别加入0.25%和0.5%的胰酶进行消化1、3、5 min,分组信息见表2。消化后弃置消化液,加入相同体积含5%FBS的M199培养基。对细胞进行计数并观察微载体空球率,确定适宜的消化浓度、温度及时间。
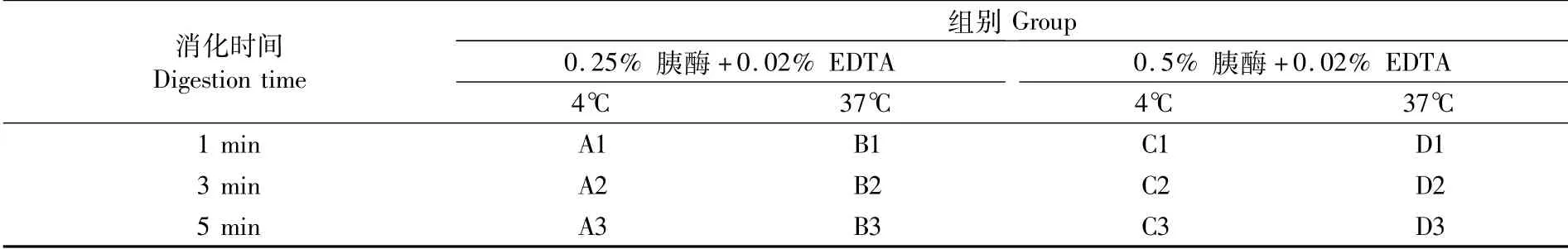
表2 胰酶消化参数Tab.2 Trypsin digestion parameters
1.2.5 最佳细胞接种密度的确定
Cytodex1的用量为2 g·L-1,工作体积为100 mL,细胞初始接种密度分别设置为1×105个·mL-1、2×105个·mL-1、3×105个·mL-1、4×105个·mL-1,将细胞接种于125 mL双侧壁培养瓶中,在28℃培养箱中搅拌悬浮培养(30 r·min-1),每 隔24 h取 样 观 察CiSB细 胞 在Cytodex1上的生长情况,绘制细胞生长曲线,确定细胞最佳接种密度。
1.2.6 最佳微载体密度的确定
Cytodex1密度分别设置为1 g·L-1、2 g·L-1、3 g·L-1、5 g·L-1,细胞接种密度为2×105个·mL-1,工作体积为100 mL。接种对数生长期细胞后,于培养箱中28℃悬浮培养(30 r·min-1),每 隔24 h取 样 观 察CiSB细 胞 在Cytodex1上的生长情况,并进行细胞计数,绘制细胞生长曲线,确定Cytodex 1的最佳用量。
1.2.7 最佳搅拌速度的确定
1.2.8 不同补料方式对悬浮培养的影响
取对数生长期的CiSB细胞接种于125mL双侧壁细胞培养瓶中,接种密度为2×105个·mL-1,初始培养基采用含10%FBS的M199培养基,Cytodex1密度为2 g·L-1,工作体积为100 mL。分别采用分批式培养、接种2 d后每天更换10%培养基和接种3 d后1次性更换50%培养基进行培养,每隔24 h取样观察在Cytodex1上的生长状况,并进行细胞生长曲线的绘制。
1.2.9 血清维持液对悬浮培养的影响
取对数生长期的CiSB细胞接种于125 mL双侧壁细胞培养瓶中,接种密度为2×105个·mL-1,初始培养基采用含10%FBS的M199,Cytodex1密度为2 g·L-1,工作体积为100 mL。在接种3 d后更换50%培养基并调整血清浓度至含5%、8%、10%、15%FBS的M199,每隔24 h取样观察在Cytodex1上的生长状况,并进行细胞生长曲线的绘制。
1.2.10 1 L悬浮培养扩增工艺
测定125 mL双侧壁培养瓶的细胞浓度,弃去生长液,注入HBSS清洗两次,加入10 mL 0.5%的胰酶消化,3 min后注入含10% FBS的M199终止消化。1 500 r·min-1离心5min收集细胞,接种至1 L双侧壁培养瓶中并补足体积至500 mL,3 h后补足培养液至1 L。按照125 mL双侧壁培养瓶设定好的培养参数进行扩增培养。
1.2.11 GCRV HN1307株增殖和测定
在培养24 h后,观察到CiSB在Cytodex 1上长成单层,静置一段时间待Cytodex1沉降至底双侧壁培养瓶底部,弃去上层培养液,接种10 mLⅡ型GCRV(GCRV HN1307株),15 r·min-1条件下连续搅拌促进病毒吸附,2 h后换5%FBS的维持液至体积100 mL,以30 r·min-1进行连续搅拌培养细胞和病毒。同时在T-75培养瓶中仅接种病毒作为贴壁培养的对比。在接种病毒后每隔24 h取细胞培养液1 mL,在-80℃条件下反复冻融3次,用qPCR测定病毒拷贝数[21];实验持续7 d,绘制病毒增殖动态曲线。
事实上,一般情况下,慎众,主要还是难在不敢做自己,怕落个不合群、不识相或假清高、假正经之类的名声,因而讨人嫌、招人恨,说到底还是修养不到,私心杂念在作怪。元人王冕,不从权贵,不随世俗,穷隐村野,唯抱贞心,其《墨梅题图诗》云:“吾家洗砚池头树,朵朵花开淡墨痕。不要人夸颜色好,只留清气满乾坤。”
1.3 数据处理与分析
本研究中所有实验均重复3次,实验数据采用SPSS 19.0统计软件进行分析,细胞密度的差异通过t检验来分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 最佳起始条件及间歇搅拌培养条件结果
不同起始条件下培养的CiSB细胞贴壁率如图1所示,其中A、C、E、F组贴壁率均低于90%,在初始培养体积为100 mL的组别中:C组和E组贴壁率显著低于其他组(P<0.05)。在初始培养体积为50 mL的组别中:A组贴壁率相对较低;F组贴壁率达86%;D组贴壁率达92%,但由于静置时间过长,微载体上细胞贴壁未能均匀分布;B组贴壁率可达96%且贴附均匀,因此选择B组(50 mL培养体积、静置30 min)为贴壁期最佳培养条件。

图1 不同搅拌方式的最大贴壁率Fig.1 Cell attachment efficiency under different stirring m ethods
B组不同贴附时间的细胞贴附率如图2所示。随着贴壁时间的延长,细胞贴壁率逐渐上升;且在间歇搅拌2 h后达到平台期,贴壁率达到96%。因此最佳间歇搅拌时间应为3 h,而后补加培养基至100 mL工作体积进行连续不间断搅拌悬浮培养。

图2 细胞在微载体上的贴附曲线Fig.2 Curve of cell attachment to m icrocarriers
2.2 最佳胰酶消化方式
细胞在微载体上培养1 d后,用不同消化方式所得细胞数如图3所示。结果显示,胰酶浓度为0.5%、工作温度为37℃时消化效果显著好于胰酶浓度0.25%、工作温度4℃(P<0.01)。

图3 不同消化方式获得的细胞数Fig.3 Cell number obtained by different digestion m ethods
37℃、0.5%胰酶消化不同时间观察细胞。在消化1 min后测得细胞浓度为7.3×104个·mL-1,显微镜下观察微载体上仍贴附有大量细胞;消化3 min时细胞浓度达4.1×105个·mL-1,显微镜下观察细胞分散良好,微载体基本为空球状态;消化5 min时细胞浓度下降,显微镜下观察部分细胞因消化过度破碎。因此确定含0.02% EDTA的0.5%胰酶37℃下消化3 min是细胞消化的最佳条件。
2.3 细胞接种密度对细胞悬浮培养的影响
当微载体密度为2 g·L-1时,不同初始细胞密度接种后在微载体上生长曲线的结果如图4所示。初始细胞密度1×105个·mL-1时,单个微载体上分布的细胞少且出现较多微载体空载现象,细胞在接种5 d后仍在缓慢生长,最大细胞密度为9.2×105个·mL-1。以3×105和4×105个·mL-1的细胞密度接种时,最大细胞密度都达到1.7×106个·mL-1,但显微镜下观察到单个微载体上分配的细胞数高,细胞对数生长期提前导致细胞在微载体上出现聚团生长、过早衰亡的现象,第4天大量脱落死亡。当细胞接种密度为2×105个·mL-1时,细胞呈现良好的线性增长;镜下观察到细胞可均匀分布于每个微载体表面,接种后5 d达最高收获浓度1.9×106个·mL-1。因此,确定微载体培养细胞时的最佳接种密度为2×105个·mL-1。

图4 不同细胞接种密度对微载体培养细胞生长的影响Fig.4 Effects of initial cell density on cell grow th on m icrocarriers
2.4 微载体密度对悬浮培养的影响
不同微载体密度对细胞生长曲线的影响见图5。在微载体密度较低的情况下,细胞密度随微载体密度的增加而增大;当微载体为1、2、3 g·L-1时,细胞最大密度分别为8.7×105、1.86×106、1.89×106个·mL-1;在5 g·L-1时,微载体出现大量空载。观察细胞及培养液状态,前48 h无明显变化。第3天,3和5 g·L-1微载体组的培养液偏黄色,pH值下降,细胞脱落严重,而2 g·L-1微载体培养瓶中CiSB细胞覆盖微载体达95%以上。因此确定最佳微载体浓度为2 g·L-1。

图5 不同微载体密度对微载体培养细胞生长的影响Fig.5 Effects ofm icrocarrier densities on cell grow th on m icrocarriers
2.5 搅拌速度对CiSB悬浮培养的影响
不同搅拌速度下的细胞生长趋势如图6所示。当搅拌速度为15 r·min-1时,细胞生长缓慢,最大细胞浓度为8.8×105个·mL-1;显微镜下观察,细胞在微载体表面生长不均匀且细胞生长有细胞团趋势。当搅拌速度为30 r·min-1、45 r·min-1时,细胞密度上升较快,最高密度分别达1.86×106个·mL-1和1.88×106个·mL-1,两者间差异不显著(P>0.05);虽然45 r·min-1较30 r·min-1早1 d到达最大密度,但细胞很快从微载体上大量脱落。搅拌速度为60 r·min-1时细胞密度上升较慢且第4天后细胞从微载体脱落严重。综上结果,确定最佳搅拌速度为30 r·min-1。

图6 不同搅拌速度细胞生长曲线Fig.6 Cell grow th curves at different stirring speeds
2.6 不同补料方式对CiSB悬浮培养的影响
采用分批式培养、第2天起每天更换10%培养基以及第3天一次性更换50%培养基3种不同补料方式培养细胞,结果如图7所示。3种补料方式最终所收获细胞密度并不显著,分批培养细胞密度最低,收获浓度为1.86×106个·mL-1。一次性更换50%培养基,细胞收获浓度达2.01×106个·mL-1,略微优于每天更换10%培养基的1.95×106个·mL-1。考虑到每天进行补料,操作上更加繁琐,因此选择第3天一次性更换50%培养基为最优补料方式。
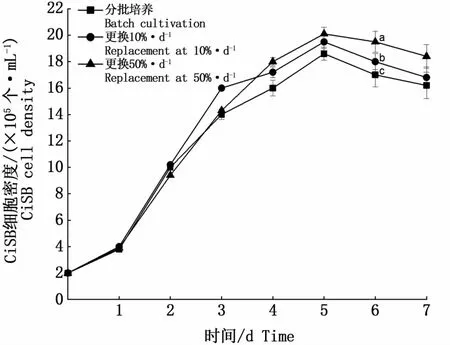
图7 不同补料方式细胞生长曲线Fig.7 Cell grow th curves under different feedingmethods
2.7 血清维持液对CiSB培养的影响
初始时使用含10%FBS的M199培养基,在培养3 d后更换为含5%、8%、10%、15% FBS培养液,细胞生长曲线如图8所示。在达到细胞最大浓度之前,细胞生长速度随着FBS浓度增大而变快;但各组间最大细胞浓度无显著性差异,均在1.98×106个·mL-1上下。但在第5天,FBS浓度增大导致细胞脱落速度变快,培养至第7天时,细胞在含5% FBS的培养液中维持效果相对最好。

图8 不同血清维持液对细胞生长的影响Fig.8 Effects of FBS concentration on cell grow th
2.8 CiSB细胞在微载体上的生长形态观察
在倒置显微镜下观察不同时期CiSB细胞在Cytodex 1上的生长情况,结果显示CiSB细胞在Cytodex 1上具有良好的贴壁性(图9)。CiSB细胞接种4 h后,细胞逐渐贴附在Cytodex 1上,每个微载体上细胞数大致为20个;接种1 d后,CiSB细胞在微载体上呈纤维状并开始缓慢增长;接种3 d后,细胞在微载体上基本长成单层;接种5~7 d,细胞在首层细胞上开始多层生长并且微载体之间出现架桥现象;7 d后,部分细胞从微载体上脱落。

图9 GiSB细胞在微载体上的生长形态Fig.9 G row th m orphology of GiSB cells on m icrocarriers
2.9 1 L悬浮培养工艺放大
将CiSB细胞培养体积从100 mL放大至1 L后,细胞生长曲线如图10所示。放大培养后细胞生长速度与在125 mL双侧壁培养瓶中的生长曲线大体相似,细胞浓度在第5天达到最高值,为1.71×106个·mL-1。
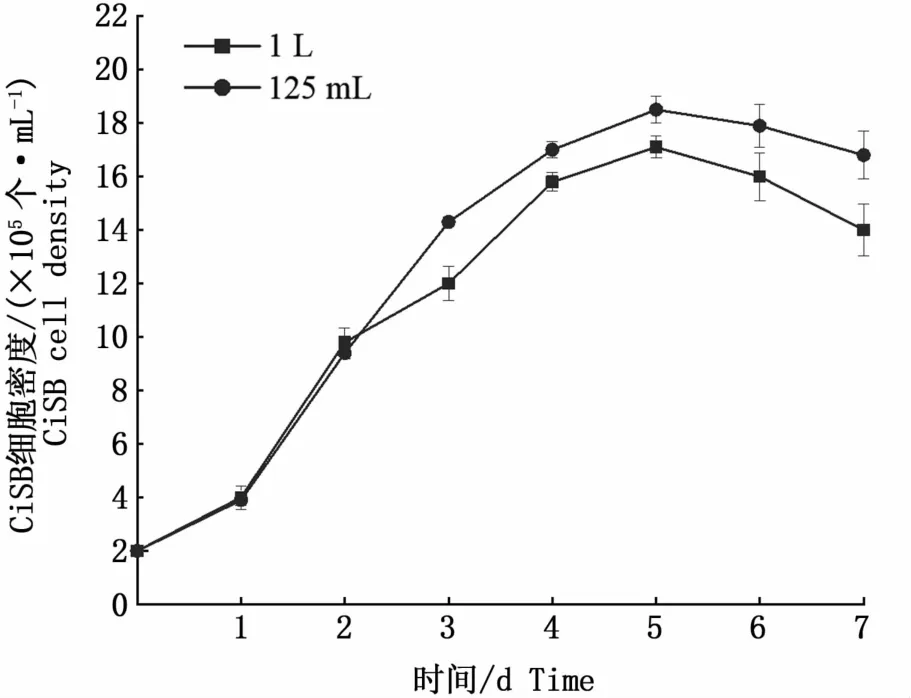
图10 12 m L和1 L悬浮培养细胞生长曲线Fig.10 Grow th curve of cells in 125 m L and 1 L system
2.10 微载体悬浮培养GCRVⅡ型病毒的增殖动态
GCRV HN1307在CiSB细胞中的增殖动态如图12所示。微载体培养条件下,GCRV感染CiSB细胞2 d后病毒开始缓慢增殖,随后进入对数生长期,5 d后达到峰值6.2×105拷贝数·μL-1,之后开始下降;作为对照,GCRV HN1307在T-75细胞瓶中培养,第6天达到峰值1.42×105拷贝数·μL-1。
3 讨论
WEZEL在1967年使用二乙基乙胺(DEAE)作为微载体创立了微载体培养系统[24],目前已经成为了疫苗生产的首选工艺。在众多的微载体中,Cytodex 1是目前最常用的商用微载体,其固体实心的结构有利于细胞贴壁及病毒的感染。本实验的研究结果表明,Cytodex 1适合CiSB细胞的贴附生长及增殖。
微载体培养工艺涉及到很多复杂的参数,其初始阶段中细胞的贴壁率,是整个培养过程中最重要的影响因素[25]。利用间歇搅拌方式,可以提高细胞的贴壁效率与比率[26];同时使细胞与微载体在相对小的体系下搅拌培养,可以提高细胞与微载体的接触机会。本研究中采用50 mL培养、静置30 min、30 r·min-1搅拌2 min的间歇搅拌方式使细胞贴附均匀;对细胞贴壁时间进行观察,最终确定间歇搅拌时间为3 h,与王维玲等[16]获得的35 r·min-1,每静置30 min搅拌2 min的间歇搅拌条件结果类似。

图11 GCRV在微载体培养条件下的增殖动态Fig.11 Proliferation dynam ics of GCRV in m icrocarrier culture system
细胞的存活和生长依赖于接种密度和条件效应,低培养密度会导致低生长速率出现[27];而最终的细胞产量与微载体密度直接相关。选择适当的接种比例,可以有效利用微载体,提高细胞产量[28]。本实验中,以1×105个·mL-1接种时,细胞生长缓慢,无法快速进入对数生长期。以4×105个·mL-1密度接种时,细胞在Cytodex 1上聚团生长,使微载体聚集并沉降到瓶底。在高密度下培养细胞易脱落,造成细胞死亡,死亡细胞的代谢产物又易产生细胞毒性。在一定细胞接种浓度下,低浓度的微载体每cm2的细胞产量与细胞生长能力有关;高浓度微载体的培养中可以得到最大单位表面积细胞产量,但需要频繁地更换培养基。本研究中,当微载体密度为1 g·L-1时,由于微载体不能提供足够的表面积,细胞受到严重的接触抑制,生长缓慢。微载体密度为3和5 g·L-1时,后期pH下降迅速,需频繁更换培养液才能保证细胞正常生长;选择2 g·L-1满足了细胞生长所需的贴壁面积,细胞增殖快且培养基消耗量少,对大规模工业化细胞培养的成本控制有重要意义。此外,1×105个·mL-1和2 g·L-1的接种比例可以实现大多数研究得到的每个微载体上贴附8~20个细胞可获得最好生长曲线的效果[29-30]。
培养基作为细胞生长的营养来源,是影响微载体培养最直接的环境因素。其中血清可以在低细胞密度的条件下促进细胞粘附和生长;但在细胞进入指数生长期后,需要用最低血清既保证细胞生长,同时保持细胞单层状态[31-32]。本研究中第3天更换血清浓度为5%时,可使细胞达到最大产量同时保持细胞的稳定生长。在补料方式的选择上,分批培养由于培养过程中营养成分不断消耗,代谢物累计,因此效果不理想[33-34];第3天一次性更换50%培养基效果优于每天更换10%培养基,可能是由于每天置换10%的补料方式特定时间内更换量少,代谢物更易累积,抑制了细胞进一步增殖所致[35-36]。
微载体扩大培养一般采用消化放大工艺,利用胰酶消化微载体上的细胞并接入更大规模反应器,补加新微载体和培养基进行新一轮的培养[37],而胰酶37℃时活性最好[38]。本实验中利用预热的含0.02%EDTA的0.5%胰酶消化3min后微载体上细胞基本能够成功脱离,无粘连、结团现象。按照125 mL体系中优化好的参数在1 L双侧壁培养瓶中培养,细胞生长曲线良好。
由于Ⅱ型GCRV病毒接种细胞后不产生明显CPE[39],显微镜下无法观察到CiSB细胞产生特征性的CPE,因此只能通过测定拷贝数的变化观察Ⅱ型GCRV的增殖动态。病毒增殖后检测结果表明,利用微载体培养,病毒感染第2天进入对数生长期,第5天达到峰值,较贴壁细胞瓶中拷贝数升高3倍,表明该工艺适合于Ⅱ型草鱼呼肠孤病毒的扩增。
本研究通过对CiSB细胞微载体悬浮培养工艺中的各项参数进行优化并进行1 L放大培养,初步建立了基因Ⅱ型草鱼呼肠孤病毒的微载体规模化培养工艺,细胞最大浓度可达1.98×106个·mL-1,接种GCRVⅡ型拷贝数最大达6.2×105拷贝数·μL-1。研究结果可以为草鱼出血病流行基因型疫苗的规模化制备奠定前期基础。
