欧洲鳗鲡RIG-I基因的克隆、序列特征分析与原核表达
2022-11-11李英英杨金先宋铁英葛均青
李英英,陈 曦,杨金先,陈 强,宋铁英,葛均青
(1.福建省农业科学院生物技术研究所,福州 350003;2.福建省养殖动物营养与新型饲料企业工程技术研究中心,福州 350003)
维甲酸基因I(retinoic acid-inducible gene I,RIG-I)与黑色素瘤分化相关基因5(melanoma differentiation-associated gene 5,MDA5)、实验遗传和生理基因2(laboratory of genetics and physiology 2,LGP2)都属于RIG-I样受体(RIG-I like receptors,RLRs),是DExD/H box RNA解旋酶家族的成员[1],可识别病原微生物表面的病原相关分子模式(pathogen associated molecular patterns,PAMPs),与下游接头分子结合,产生信号级联放大效应,激活宿主的天然免疫信号通路,诱导干扰素(IFN)和促炎因子等抗病毒效应分子的表达[2-3]。RIG-I和MDA5的结构和功能类似,N端都有两个串联的半胱天冬酶富集结构域(CARD),是病毒RNA的胞质传感器,在病毒入侵时识别病毒mRNA并启动RIG-I样受体与其特定的配体结合,诱导机体产生IFN和炎症因子,抵御病毒侵袭[4];LGP2的N端缺少CARD结构域,不能传递病毒识别信号,但其对RLR信号通路有调控作用[5-8]。尽管RIG-I和MDA5的结构和功能都类似,但RIG-I偏向于识别短链dsRNA和5'PPP dsRNA[9],未被dsRNA刺激时处于自抑制状态[10];而MDA5偏向于识别长链dsRNA,未发现其存在自我抑制的状态[11]。RIG-I既可识别RNA病毒,也可识别DNA病毒;而MDA5仅可识别RNA病毒[12]。因此,在DNA病毒侵染宿主的过程中,RIG-I及其介导的免疫反应在宿主抗病毒免疫应答中发挥重要作用。
鳗鲡属(Anguilla)鱼类是我国重要的经济鱼类,其产值在水产品出口贸易中占有重要地位。随着集约化养殖的发展,鳗鲡养殖期间病害频发,给业者造成巨大的经济损失,严重阻碍行业的健康发展。鳗鲡“脱黏败血综合征”是养殖鳗鲡幼鳗期高发的传染性疫病,病鳗主要出现“红头”、“脱黏”和“败血”等症状。前期研究中,利用鳗鲡卵巢细胞系(eel ovary cell line,EO)从患“脱黏败血综合征”病鳗体内分离出鳗鲡疱疹病毒(Anguillid herpesvirus,AngHV)[13],证 实 了AngHV是鳗鲡“脱黏败血综合征”的致病病原[14]。
AngHV是疱疹病毒目(Herpesvirales)鱼蛙疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)的线性双链DNA病毒。前期的蛋白质组学分析和进一步的qPCR验证结果表明,感染AngHV后,鳗鲡皮肤黏液的RIG-I基因及其介导的RLRs信号通路上的多个基因被激活。本研究设计引物,从欧洲鳗鲡(Anguilla anguilla)体内克隆出RIG-I基因,对其进行生物信息学分析,并在大肠杆菌内表达了RIG-I基因,以期为后期制备RIG-I多克隆抗体和进一步探索RIG-I介导的天然免疫在鳗鲡抵御AngHV侵染过程中的作用机制提供研究基础。
1 材料与方法
1.1 材料
实验鳗鲡为福建省农业科学院生物技术研究所实验室内养殖群体。2×Phanta Max Master Mix、5min TA/Blunt-Zero Cloning Kit购自南京诺唯赞生物科技股份有限公司,PrimeScriptTMII 1stStrand cDNA Synthesis Kit、DNA Marker购自宝日医生物技术(北京)有限公司,胶回收试剂盒、质粒抽提试剂盒购自生工生物工程(上海)股份有限公司;引物均由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 组织总RNA提取及cDNA合成
取欧洲鳗鲡的内脏组织(肝脏、脾脏和肾脏),Trizol法提取总RNA,超微量紫外分光光度计测定其浓度和纯度;每个样品取500 ng RNA,用PrimeScriptTMII1stStrand cDNA Synthesis Kit反转录合成cDNA,-20℃保存备用。
1.2.2RIG-I基因的克隆
根据前期转录组测序获得的欧洲鳗鲡RIG-I基因mRNA序列,用DNASTAR lasergene V7.1设计特异性扩增欧洲鳗鲡RIG-I基因的引物对:RIG-I RW(ACCGGGGACGCGTTGAGTAAGC)和RIG-I FW(TATCCAAAGCGACGAGTGTGAAGC)。以反转录得到的cDNA为模板,进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳检测,切胶纯化回收目的片段。将目的片段克隆至pCE2-TA/Blunt-Zero载体,用PCR鉴定后选取阳性菌株,进行测序验证。
1.2.3RIG-I基因序列的生物信息学分析
用DNASTAR lasergene V7.1分析查找扩增片段中的ORF序列,利用NCBI的BLAST在线工具对扩增获得的序列进行同源性分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome);用Protparam分析核苷酸及氨基酸序列的组成成分和理化性质(http://web.expasy.org/protparam/);用TMHMM2.0分析预测蛋白质跨膜结构域(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0);用SignalP-5.0分析预测蛋白信号肽结构(http://www.cbs.dtu.dk/services/SignalP/);用PSORT IIPrediction进行亚细胞定位(http://psort.hgc.jp/form2.html);用HNN预 测 蛋 白 质 二 级 结 构(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html);用CDD分析基因蛋白保守功能结 构 域(https://www-ncbi-nlm-nih-gov.frodon.univ-paris5.fr/Structure/cdd/wrpsb.cgi)。
1.2.4 表达质粒的构建
根据测序得到的欧洲鳗鲡RIG-I基因序列(GenBank序列号:ON873727),在其ORF序列前端添加NdeⅠ酶切位点、ATG起始密码子和His tag,在末端添加终止密码子及HindⅢ酶切位点(NdeⅠ--ATG--His tag--RIG-I--Stop codon--HindⅢ,Protein Length=947),合成该序列后克隆至pET-30a载体,提取质粒后双酶切鉴定,获得30a-RIG-I表达质粒。
1.2.5RIG-I基因的诱导表达
将质粒30a-RIG-I转化至感受态E.coliBL21(DE3)细胞,挑选阳性克隆,接种于LB液体培养基中。37℃、200 r·min-1培养至OD为0.6~0.8时,加入终浓度为0.5 mmol·L-1的IPTG,置于15℃培养16 h。离心收集细菌菌体,超声破碎后分别取细胞裂解液、裂解液上清和裂解液沉淀进行SDS-PAGE分析。
1.2.6 表达RIG-I的western blot验证
取诱导后的裂解液上清液进行SDS-PAGE电泳[设置Multiple Tag(Purified)(南京金斯瑞生物科技有限公司)作为His-Tag阳性对照],半干法转移至PVDF膜,用含5%脱脂奶粉的TBST缓冲液37℃封闭1 h,TBST缓冲液洗膜后,置于1∶3 000倍稀释于TBST中的鼠抗His-Tag单克隆抗体(英国艾博抗生物技术有限公司)室温孵育1 h,TBST缓冲液洗膜后,置于1∶15 000倍稀释于TBST缓冲液中的HRP标记的羊抗鼠IgG(美国Cell Signaling Technology,CST)室温孵育1.5 h,TBST洗膜后,采用Super ECL Plus化学发光液(北京兰博利德生物技术有限公司)显色,用ChemiScope 6000 Touch成像系统(上海勤翔科学仪器有限公司)拍照。
2 结果与分析
2.1 欧洲鳗鲡RIG-I基因的克隆
设计引物对RIG-IRW/RIG-IFW,利用PCR从合成的欧洲鳗鲡cDNA中扩增出约3 361 bp的条带(图1),克隆至pCE2-TA/Blunt-Zero载体后测序,经BLAST比对分析,证实成功克隆了欧洲鳗鲡的RIG-I基因。

图1 欧洲鳗鲡RIG-I基因的PCR扩增Fig.1 PCR amp lification of Anguilla anguilla RIG-I
2.2 欧洲鳗鲡RIG-I基因的生物信息学分析
DNASTAR lasergene V7.1分析表明,欧洲鳗鲡RIG-I基因的ORF序列长度为2 823 bp碱基,编码940个氨基酸;Blast的结果表明,欧洲鳗鲡RIG-I基因与GenBank中日本鳗鲡(A.japonica)RIG-I基因的序列(MK838769.1)同源性为96.71%,有93 bp碱基发生点突变,对应52个氨基酸发生点突变(图2)。

图2 欧洲鳗鲡RIG-I的基因和氨基酸序列Fig.2 Gene and am ino acid sequence of Anguilla anguilla RIG-I
Protparam分析显示,欧洲鳗鲡RIG-I蛋白分子量约为108 kDa,等电点为6.31,属酸性蛋白;不稳定系数为42.58,较不稳定;总平均亲水性系数为-0.487,属亲水性蛋白;不存在跨膜结构;无信号肽。亚细胞定位显示,65.2%位于细胞质,21.7%位于细胞核,8.7%位于细胞骨架,4.3%位于过氧化物酶体。HNN预测结果显示,RIG-I蛋白的二级结构中α-螺旋(alpha helix)占47.55%,延伸链(extended strand)占15.11%,无规则卷曲(random coil)占37.34%。CDD分析结果表明,RIG-I蛋白有6个保守功能区,其在氨基酸序列上的位置及所属蛋白家族如表1所示,2~91 aa和102~190 aa属于DD超家族,254~456 aa属于DEAD-like_helicase_N超家族;621~755 aa属于DEAD-like_helicase_C超家族;471~604 aa和819~932 aa属于不同的RIG-I_C家族。

表1 欧洲鳗鲡RIG-I蛋白的CDD分析结果Tab.1 CDD analysis of Anguilla anguilla RIG-I
2.3 欧洲鳗鲡RIG-I基因的原核表达
将添加了酶切位点和His-tag的RIG-I基因的ORF序列克隆至pET-30a载体,用NdeⅠ/HindⅢ进行双酶切(图3),结果出现约2 844 bp的特异性条带,表明成功构建表达质粒30a-RIGI。将质粒30a-RIG-I转化至E.coliBL21,IPTG诱导表达后进行SDS-PAGE分析,结果显示,与未经诱导的载体相比,经15℃诱导16 h后在全菌、裂解液上清和裂解液沉淀约108 kDa处均出现明显的蛋白条带,与预期欧洲鳗鲡RIG-I蛋白大小一致,且在细胞裂解液沉淀中的蛋白含量明显高于上清,说明该蛋白可溶性较差,主要分布于包涵体内(图4-a)。进一步的western blot分析显示,含原核表达质粒30a-RIG-I的诱导菌体可被His-Tag单克隆抗体特异性检测出约108 kDa的蛋白条带,这与表达蛋白的预期大小一致,而His-Tag对照检测到的蛋白大小约为40 kDa(图4-b),表明实现了欧洲鳗鲡RIG-I基因在E.coliBL21(DE3)中的表达。
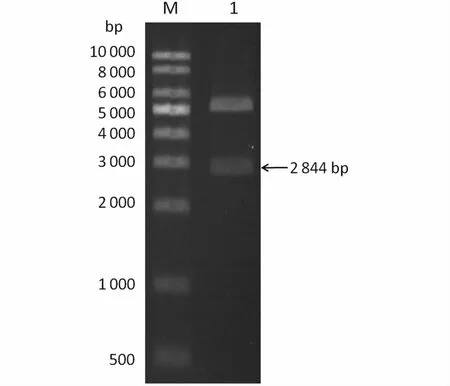
图3 质粒30a-RIG-Ⅰ的酶切鉴定Fig.3 Restriction enzyme digestion of plasm id 30a-RIG-Ⅰ

图4 SDS-PAGE和western blot分析欧洲鳗鲡RIG-I基因在大肠杆菌中的表达Fig.4 SDS-PAGE and western blot analysis of the expression of Anguilla anguilla RIG-I in E.coli
3 讨论
相较于哺乳动物,鱼类的获得性免疫系统分化不完全[15],其抵御病原侵袭更依赖其天然免疫系统。大量研究表明,病毒侵染时,RIG-I介导的天然免疫在鱼类抵御病毒侵袭的过程中发挥着重要作用[12],CHEN等[16]的研究发现,在神经坏死病毒(nervous necrosis virus,NNV)侵染斑马鱼的过程中,RIG-I被激活并特异性的介导II型IFN-I的产生;LIU等[17]通过转录组和蛋白质组联合分析发现,Ⅱ型鲤疱疹病毒(Cyprinid herpesvirus 2,CyHV-2)感 染 银 鲫(Carassius auratus gibelio)后,RIG-I及其介导的信号通路内的调节因子会被激活。前期研究中,通过蛋白质组分析发现,感染AngHV的欧洲鳗鲡体内RIG-I蛋白表达量显著上调,其介导的天然免疫信号通路上的多个基因也被激活,表明鳗鲡抵御AngHV侵染的过程中,RIG-I介导的天然免疫发挥着重要作用。FENG等[18]和HUANG等[19]均克隆鉴定了日本鳗鲡的RIG-I基因,但二者鉴定到的两个日本鳗鲡RIG-I基因亚型AjRIG-I和AjRIG-Ib同源性仅为39%,本文鉴定到的欧洲鳗鲡RIG-I基因与AjRIG-Ib的同源性达到96.71%,仅部分碱基发生点突变,而与AjRIG-I的同源性较低,该结果可为研究鳗鲡RIG-I基因提供参考资料。
生物信息学分析结果表明,RIG-I蛋白主要位于细胞质中,较不稳定,该结果与此前报道的RIG-I是病毒RNA胞质传感器[4],未被dsRNA刺激时处于自抑制状态[10]相一致。哺乳动物RIG-I蛋白一般有4个保守功能区,从N端到C端依次为:两个串联的CARD结构域,DEx D/H-box类RNA解旋酶结构域和C端结构域(CTD)。CDD预测结果中,欧洲鳗鲡RIG-I蛋白有6个保守功能区,从N端开始,前两个均属于DD超家族,第三和第五个分别属于DEAD-like_helicase_N超家族和DEAD-like_helicase_C超家族,第四个和第六个属于不同的RIG-I_C家族。DD超家族是蛋白质互作模块中最大的一类,在细胞凋亡、坏死和免疫细胞信号通路中发挥着关键作用,包含4个亚科:DD,death effector domain(DED),CARD和pyrin domain(PYD)[20]。CARD_RIG-I_r1(cd08816)和CARD_RIG-I_r2(cd08817)两个结构域均属于DD超家族中的CARD亚科,表明欧洲鳗鲡RIG-I蛋白与哺乳动物的RIG-I蛋白类似,在N端也有两个串联的CARD。欧洲鳗鲡RIG-I蛋白的C端具有CTD结构域,属于RIG-I_C家族;但预测的结果中,欧洲鳗鲡RIG-I蛋白DEAD-like_helicase_N端结构域和一个DEADlike_helicase_C端结构域之间还有一个结构域属于RIG-I_C家族,该结构域与C端的CTD结构域属于不同的RIG-I_C家族,该结构对欧洲鳗鲡RIG-I蛋白的功能有何影响,有待进一步的研究验证。
