使用不同胰酶消化PK15细胞对比试验
2018-03-01张小兰
张小兰
福州大北农生物技术有限公司 福州 350014
PK15 细胞(Porcine Kidney Eplithelial cells),也称PK15或PK(15)。来源于猪肾,中文名为猪肾上皮细胞,父母代源自1955年美国Stice提供的成年猪肾细胞 PK-2a,被 ATCC 收藏(CCL-33)[1]。 PK15细胞对猪圆环病毒、猪细小病毒、猪瘟病毒等多种病毒比较敏感,已广泛应用于兽用疫苗的研究和生产[2]。PK15细胞是已经癌变了的细胞,具有很强的生长和增殖能力,正常情况下可以无限地传代[3]。但在实际培养中,细胞常常会出现不稳定的生长情况,反复传代后,随着传代次数的增多,可能出现细胞慢慢表现为生长不良、细胞变老、状态变差直至不能继续传代等情况。在实际生产传代中发现,细胞消化是影响细胞生长状态好坏的关健因素之一。胰蛋白酶是细胞原代培养和传代过程中经常用到的水解酶[4],其通过在特定位置上降解蛋白,使细胞间结合处蛋白降解,这时细胞在自身内部细胞骨架的张力作用下成为球形,从而使细胞分开。不同组织或细胞对胰酶的作用反应不一样,且胰酶分散细胞的活性与其种类、浓度、温度和作用时间、消化程度、消化液残留量等都有关。所以,为了给生产疫苗提供更好细胞状态的PK15细胞,提高疫苗质量,本试验通过对比胰酶A与胰酶B的消化效果及对细胞的影响,目的在于寻找一种对细胞更温和、损伤更小的消化液,为生产疫苗提供优良状态的细胞。
1 材料与方法
1.1 细胞 PK15细胞株,大北农集团北京动物医学研究中心提供。
1.2 培养基 MEM购自gibco公司。
1.3 细胞消化液 0.25%胰酶A与0.25%胰酶B均购自某公司。
1.4 试验方法
1.4.1 细胞制备 取一瓶处于对数生长期、细胞状态良好的PK15细胞进行消化传代,按一定的分种比例分出8瓶等量的T75细胞。随机分为a、b、c、d四组,每组2瓶T75细胞。
1.4.2 细胞消化 各组细胞培养72 h后,使用胰酶A对a、b组细胞进行消化,即弃去细胞培养液,用37℃预热处理的PBS清洗细胞两遍,每遍25 mL,再用胰酶A 4 mL消化细胞,待细胞出现圆缩分离时,a组细胞消化完弃去消化液,加6 mL含5%血清的营养液终止消化并进行吹打细胞,分种后进行培养,b组细胞消化后不弃去消化液直接加入营养液终止消化,分种后进行培养。使用胰酶B对c、d组细胞进行消化即弃去细胞培养液,用37℃预热处理的PBS清洗细胞两遍,每遍25 mL,再用胰酶B 4 mL消化细胞,待细胞出现圆缩分离时,c组细胞消化完弃去消化液,加6 mL含5%血清的营养液终止消化并进行吹打细胞,分种后进行培养,d组细胞消化后不弃去消化液直接加入营养液终止消化,分种后进行培养。
1.4.3 观察记录 记录各组细胞消化终止时间、细胞分散效果,以及培养24 h、48 h、72 h时细胞的生长状态等。
2 结 果
2.1 胰酶A与B对细胞消化的影响 胰酶A的消化终止时间为5~6 min,胰酶B的消化终止时间为1~2 min,消化终止时间上相差较大。细胞消化后,胰酶A的分散效果均较好,呈大部分几个细胞状态,24 h细胞分裂也明显,细胞状态较好。胰酶B消化细胞,消化液弃去的细胞消化后基本处于单个状态,24 h细胞分裂也明显;但消化液不弃的团块较大,24 h生长不均匀,细胞分裂不明显,细胞生长较慢。见表1。
2.2 胰酶A与B对细胞生长状态的影响 使用胰酶A消化PK15细胞,无论消化液弃去还是不弃去,细胞生长情况与细胞状态都较理想。使用胰酶B消化细胞时,消化液弃去,细胞生长状态好,与胰酶A差异不明显;而消化液不弃去,细胞状态变差、生长变缓慢,到72 h时,细胞才长到约80%密度,细胞有圆缩脱落现象。见表2。
3 小结与讨论
1)试验结果表明,使用0.25%胰酶A消化PK15细胞,无论消化液是否弃去,消化终止时间较0.25%胰酶B更长,细胞分散效果均处于几个细胞状态,细胞生长状态好。使用0.25%胰酶B消化PK15细胞,当消化液弃去时,细胞分散情况与细胞生长状态都较好;而消化液不弃时,细胞消化后团块大,生长变缓慢、状态变差,这应该与胰酶B对细胞的毒性有关,当胰酶残留量大时,对细胞有一定的损伤,导致细胞状态变差、生长缓慢。而胰酶A比较温和,即使有残留,对细胞损伤不大,细胞仍能稳定生长。所以,0.25%胰酶A较0.25%胰酶B温和,消化液弃去与否,细胞的消化与生长都理想。
2)胰酶B为动物源性的消化酶,而胰酶A是利用微生物生产的一种比较温和的非动物源性消化酶,其动力学性质和裂解特异性均与胰酶B类似[5]。但胰酶A纯度更高,室温保存稳定性高,对细胞损伤更小。本试验使用0.25%胰酶A、0.25%胰酶B消化PK15细胞,通过对比了解两种胰酶对PK15细胞消化和生长的影响,为实际生产提供参考依据。

表1 胰酶A与B对细胞消化的影响
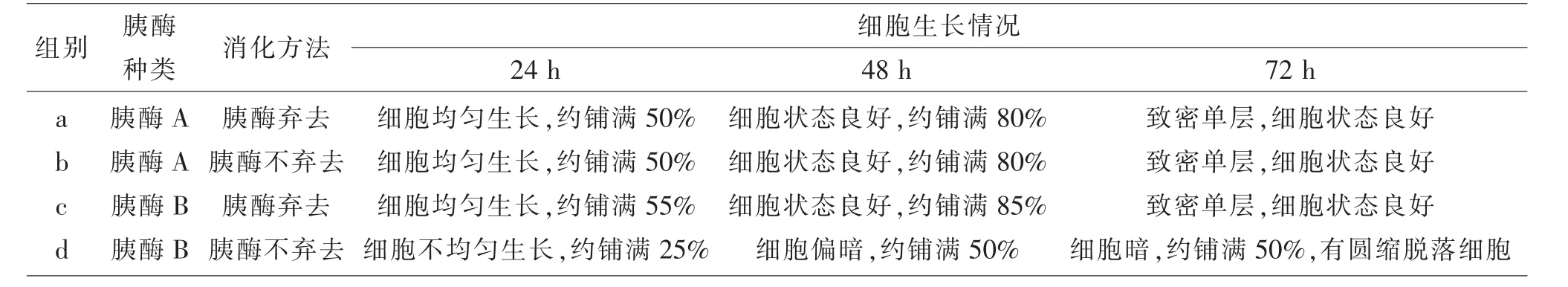
表2 胰酶A与B对细胞生长的影响
[1]周利锋.V1-2灭活疫苗生产用PK15细胞库和PCV1-2种毒库的建立及鉴定[D].扬州:扬州大学,2011.
[2]魏园园,马忠仁,王家敏,等.PK15细胞的生物学特性和质量评价研究[J].黑龙江农业科学,2015(5):61-65.
[3]陆有飞,高永锐.不同浓度胰蛋白酶对PK15细胞传代消化的影响[J].广西畜牧兽医,2004,20(2):56-57.
[4]靳辉,杨蓬勃,冯改丰,等.胰蛋白酶消化强度优化获得高纯度体外的星形胶质细胞[J].生理学报,2015,67(1):103-109.
[5]周新华,张在军,于沛.大脑皮层神经元原代培养方法的改良及一种体外缺氧缺糖简易模型的建立 [J].中南药学,2014,12(5):439-442.
