三疣梭子蟹P-gp蛋白在氟苯尼考代谢中的功能研究
2022-11-11邵慧鑫高保全蔡月凤任宪云
徐 垚,邵慧鑫,高保全,李 健,蔡月凤,任宪云
(1.江苏海洋大学海洋科学与水产学院,江苏省海洋生物资源与环境重点实验室/江苏省海洋生物技术重点实验室,江苏连云港 222005;2.中国水产科学研究院黄海水产研究所,农业农村部海洋渔业可持续发展重点实验室,山东青岛 266071;3.青岛海洋科学与技术试点国家实验室-海洋渔业科学与食物产出过程功能实验室,山东青岛 266237;4.水产科学国家级实验教学示范中心,上海 201306)
三疣梭子蟹(Portunus trituberculatus)是我国北部省份产量最高的一种海产食用蟹类[1],据《中国渔业统计年鉴》统计[2],2020年我国三疣梭子蟹的养殖面积有206.71 km2,产量达10.089 5万t。然而,随着三疣梭子蟹养殖业的发展,也出现养殖环境日趋恶化、水体中病原大量滋生、病害频发等问题,给三疣梭子蟹养殖业造成了严重的经济损失,严重阻碍其持续、健康发展。近年来,三疣梭子蟹在人工育苗-养成-商品蟹出池的各个时期均有病害发生,严重时死亡率高达80%以上,其中危害较严重的是细菌性疾病和寄生虫病[3-4]。目前,水产药物因其疗效显著、生产使用简便、成本低等特点成为水产动物病害防治的主要手段之一。我国作为水产养殖大国,抗菌药物使用量占全球抗菌药物使用量的1/4[5]。
氟苯尼考(florfenicol,FLR)是水产养殖中最常用的抗菌药物之一,为一种氯霉素的含氟抗菌类似物[6],具有广谱性、易吸收、用药后体内分布广泛且低残留等药理学特性,可与细菌70S核糖体的50S亚基紧密结合[7],有效抑制细菌蛋白质的合成来发挥杀灭作用,被广泛用于预防或治疗由弧菌引起的感染[8]。在海水养殖环境中,FLR的主要来源包括养殖过程中的直接使用和随地表径流汇入两类[9]。据监测,我国近岸海域中FLR的含量可达42 ng·L-1[10]。在实际养殖过程中,存在不合理用药甚至滥用药物现象。进入养殖环境的抗菌药物会诱发养殖生物本身的条件致病菌;养殖水环境中的微生物和养殖沉积物中的微生物产生耐药性;FLR还会在养殖对象体内残留,引发机体产生一系列不良反应,如引起氧化应激[11]、抑制机体的新陈代谢和生长过程[12]、扰乱机体行为和免疫反应[13],以及改变相关代谢通路的关键基因转录表达等[14-16],最终破坏养殖生态平衡[17]。同时,长期或高剂量的使用抗菌药物还会影响水产养殖动物的生理机能,并引发一系列水产养殖动物食品安全问题[18]。因此,解析养殖动物对药物的代谢特征,优化渔药的使用方案和消解路径,尽量减少药物在机体内的残留,从而降低渔药对水环境和人类健康的潜在危害,对我国海水养殖业持续健康发展具有重要意义。
腺苷三磷酸结合盒(adenosine triphosphatebinding cassette,ABC)转运体是一类跨膜转运蛋白超家族,参与磷脂、固醇、胆汁酸、肽类及各类药物的跨膜转运。P-糖蛋白(P-glycoprotein,Pgp)是第一个被发现的人类ABC转运蛋白,能够在多药抗性肿瘤细胞系中过度表达[19]。在人类癌细胞中,P-gp蛋白过度表达能够逆浓度梯度将药物从细胞内转运到细胞外,降低细胞内药物浓度,使人类癌细胞对药物的耐药性增强[20];但同时,作为环境毒物的外排泵,P-gp蛋白通过和ATP结合后水解产生的能量,将外源性环境毒物排至胞外。据网站https://go.drugbank.com统计,目前已知的转运底物已经超过350种。研究表明,药物在生物体内的代谢过程可分为3大阶段,即Ⅰ相反应、Ⅱ相反应和Ⅲ相代谢。其中Ⅲ相代谢是由ABC转运蛋白家族中的ABCB、ABCC、ABCG等药物代谢相关蛋白将Ⅰ相和Ⅱ相反应的代谢产物转运出体外的过程[21]。目前,胡鲲 等[22]发 现,P-gp蛋 白 在 尼 罗 罗 非 鱼(Oreochromis niloticus)体内参与恩诺沙星的转运代谢过程;于旋等[23]发现,三疣梭子蟹ABCG蛋白参与氟苯尼考的转运代谢过程,提供了一种从分子水平揭示水产动物体内药物代谢的思路。另外,P-gp蛋白的外排功能可被多种化合物诱导或抑制[24-25],诱导剂处理可上调P-gp蛋白的表达并增强其转运活力,从而减少胞内外源性有害物质累积,对维持细胞内环境稳态有重要作用[26];而维拉帕米(verapamil,VER)、环孢素A(cyclosporin A)、长春新碱(vincristine)等作为Pgp蛋白的抑制剂,可以通过破坏ATP的水解、竞争结合位点等方式来抑制P-gp蛋白的转运功能[27-33]。于旋等[23]通过有无注射ABCG蛋白特异性抑制剂(FTC)对三疣梭子蟹组织中FLR累积及消除的变化,进一步证明三疣梭子蟹ABCG转运蛋白对FLR的转运作用。
为研究三疣梭子蟹P-gp蛋白的转运功能,本研究首次克隆Ptabcb1基因并分析其结构特征和细胞亚定位;采用肌肉注射不同浓度的FLR以及联合注射VER和40 mg·kg-1FLR给药的方法,研究FLR处理下PtP-gp蛋白外排活性的响应变化,旨在为进一步了解P-gp蛋白介导甲壳类动物解毒的分子防御机制提供参考。
1 材料与方法
1.1 实验材料
实验用三疣梭子蟹采自山东潍坊昌邑海丰水产养殖有限公司。三疣梭子蟹的养殖水泥池面积为30 m3(4.0 m×5.0 m×1.5 m),养殖密度为每池30只,水深为(35.0±0.5)m,水温为(25.0±0.5)℃,溶解氧为(5.5±0.2)mg·L-1,盐度31,pH 8.2。选取三疣梭子蟹体质量为(32.66±6.27)g的健康个体,养殖池暂养一周,日换水量为总池水的1/3,定时投喂新鲜饵料,投喂量为蟹体质量的1/10。通过对三疣梭子蟹的尾足检查,选择处于蜕皮间期的个体进行后续实验。
1.2 PtP-gp蛋白编码基因Ptabcb1的cDNA全长扩增与生物信息学分析
通过查找自建三疣梭子蟹转录组文库(SRA ID:7632672)中Ptabcb1基因的序列信息,对获得的Ptabcb1基因的部分序列进行PCR验证后,再进 行5'-和3'-cDNA末 端 快 速 扩 增(rapidamplification of cDNA ends,RACE),以 获 取Ptabcb1基因的全长cDNA序列。RACE扩增条件为:94℃,预变性3 min;94℃,变性30 s,68℃,退火30 s,72℃,延伸3 min,共进行35个循环;最后在72℃下延伸10 min,12℃保存。PCR产物经电泳检测,切胶回收后,与PMD18-T载体(宝生物,大连)连接克隆后,送至生工生物工程(上海)有限公司进行菌液测序。实验中所有使用的引物均由Primer Premier 5.0软件设计,具体序列信息见表1。
利用TMpred软件[34]和SMART软件[35-36]进行蛋白信号肽预测。使用Clustal Omega软件对三疣梭子蟹和其他物种的P-gp蛋白的氨基酸序列进行比对分析,并用MEGA 6.0软件以邻接法(neighbour-joining,NJ)构建系统进化树,10 000次Bootstrap重复检验进化树的置信度。
1.3 Ptabcb1基因的组织特异性表达和荧光原位杂交分析
采用实时荧光定量PCR(qRT-PCR)方法检测三疣梭子蟹Ptabcb1基因在鳃、肝胰腺、肌肉、心脏、胃、肠和血淋巴组织中的相对表达量。取30~50 mg新鲜组织样品,按照Trizol一步法提取总RNA,按照PrimeScriptTMRT Reagent试剂盒(含有gDNA去除剂)(Perfect Real Time)(宝生物,大连)说明进行cDNA模板的制备。按照ChamQTMSYBR®Color qPCRMaster Mix试剂盒说明书进行实验,以β-actin作为内参,采用2-ΔΔCt方法确定相对表达量,所用荧光定量引物的扩增效率均在1.8~2.2之间,序列详见表1。
根据Ptabcb1基因的保守结构域序列设计RNA荧光探针Ptabcb1-ISH(表1),由上海Generay公司合成。用冷冻切片机(THERMO,美国)将三疣梭子蟹的肝胰腺切成8μm的组织切片。将组织切片在25℃条件下静置10 min风干待用,之后放入4% PFA-10×PBS(pH 7.2)中固定10 min。将组织切片在1×PBS(pH 7.2)中洗涤2次后,在0.2% Triton 100-1×PBS中浸泡30min。用稀释后的探针Ptabcb1-ISH(1μm)在25℃的耐光容器中孵育2 h,用1×PBS(pH7.2)冲洗3次,每次冲洗5min,并用4,6-二氨基-2-苯基吲哚(DAPI,CAS号:28718-90-3)(Beyotime,上海)对细胞核进行染色。最后,在载玻片上添加抗荧光淬灭封片液(Beyotime,上海)。用双光子激光共聚焦显微镜(LSM710 NLO,德国)观察组织切片,分别用Zen 2009 Light Edition软件(Carl Zeiss,德国)和Photoshop CS5.0软件(Adobe,美国)输出和分析荧光图像。

表1 实验中所用引物序列Tab.1 Sequence of primers used in this study
1.4 FLR和VER注射对Ptabcb1基因的转录表达和PtP-gp蛋白的转运活力影响
实验用FLR原粉购于德邦制药公司(CAS号:73231-34-2,含量98%),PtP-gp蛋白的特异性抑制剂VER购于sigma公司(CAS号:152-11-4)。参照GIACOMINI等[37]的方法,将FLR原粉溶于盐溶液,盐溶液成分包含NaCl(468.0 mM)、KCl(11.5 mM)、CaCl2(11.0 mM)、MgSO4(18.0 mM)、2.0 NaHCO3、HEPES(10.0 mM),pH为7.4。
采用肌肉注射的方式,对三疣梭子蟹分别注射20 mg·kg-1、40 mg·kg-1和80 mg·kg-1浓度的FLR溶液。将上述剂量的FLR溶液用25号无菌注射器注射到三疣梭子蟹第四步足与体壁关节膜处的肌肉中,注射剂量为1 mL·kg-1。同时,在40mg·kg-1的FLR注射试验组中,使用Pgp蛋白抑制剂VER探究PtP-gp蛋白的转运活性,于注射FLR前1 h,将10μM剂量的VER盐溶液注射到三疣梭子蟹体内。注射后,分别于0、1、3、6、12、24、48 h和72 h取样,每组设3个平行,每个平行组取6个蟹,选取处于蜕皮间期的个体,取出血淋巴、肝胰腺、鳃和肌肉组织,用4℃生理盐水洗涤后,各组织分成两等份,在液氮中快速冷冻,-80℃保存,分别用于FLR含量测定和总RNA提取。
采用FANG等[38]的方法进行组织中FLR的提取和分析。取适量各组织样品,解冻后称重,充分研磨。加入2 mL乙酸乙酯后,震荡2 min,5 000 r·min-1离心10 min后取上清,重复上述步骤两次对残渣再提取。将上清液移至干净的离心管中,混合上清液用涡流蒸发器蒸发干燥。将蒸发器中残留物溶解在1 mL流动相和1 mL正己烷的液体混合物中,充分溶解后转移到5 mL离心管中。5 000×g离心5 min后,用0.22μm一次性针头式过滤器过滤底层液体,然后进行高效液相色谱分析。采用Agilent Tc-C18色谱柱(5 mm×250 mm×5μm),用A:乙腈和B:磷酸盐(pH 3.42)为溶剂梯度洗脱。梯度为:82% A/18% B,持续20 min,柱温30℃,流速0.8 mL·min-1,荧光检测(激发波长278 nm,发射波长460 nm),进样量:20μL。
P-gp蛋白转运活性的定义如下:

式中,CFLR为40 mg·kg-1FLR肌注在三疣梭子蟹的血淋巴、肝胰腺、鳃和肌肉中的FLR含量。CFLR+VER为抑制剂VER联合40 mg·kg-1FLR肌注在三疣梭子蟹的血淋巴、肝胰腺、鳃和肌肉中的FLR含量。
将各处理组的新鲜组织样品参照1.3方法制备成cDNA模板,采用qRT-PCR方法检测Ptabcb1基因的相对表达量。
1.5 数据处理与统计分析
所有数据以3组独立实验的平均值±标准差(mean±SD)表示,使用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),利用Duncan’s多重比较进行差异显著性检验,P<0.05认为差异显著,确定对照组与试验组个体之间的显著差异。
2 结果与分析
2.1 PtP-gp蛋白基因的全长cDNA序列与系统进化树分析
通过RACE克隆获得PtP-gp蛋白编码基因的cDNA序列,命名为Ptabcb1,该基因cDNA序列长度为4 942 bp,开放阅读框(open reading frame,ORF)为3 522 bp,共编码1 173个氨基酸,命名为PtP-gp蛋白,预测分子量为127.96 kDa(图1)。Ptabcb1基因序列已提交至NCBI核酸数据库(GenBank ID:KY487995)。
采用Clustal Omega多序列比对(ClustalW 2.1)分析表明,PtP-gp蛋白与人(Homo sapiens)、褐家鼠(Mus musculus)、黑腹果蝇(Drosophila melanogaster)和脊尾白虾(Exopalaemon carinicauda)的同源蛋白P-gp的相似度分别为51.83%、51.31%、45.29%和73.46%(图1)。对PtP-gp蛋白的跨膜结构域进行TMpred[34]预测和SMART[35-36]预测,PtP-gp蛋白包含两个典型的ABC转运蛋白跨膜结构域,14个跨膜螺旋,以及保守的Walker A区、Q-loop环、ABC信号肽、Walker B区、D-loop环和H-loop环(图2)。

图1 物种P-gp同源蛋白氨基酸序列比对分析Fig.1 M ultiple sequence alignment analysis of P-gp homologous proteins from five species

图2 PtP-gp蛋白跨膜结构域的预测Fig.2 Prediction ofmembrane spanning domains of P-gp homologous proteins from P.trituberculatus
采用NJ法对PtP-gp蛋白和NCBI数据库中20个物种的同源蛋白P-gp的氨基酸序列构建系统进化树,PtP-gp蛋白与脊尾白虾P-gp蛋白聚为一支(BP=100),节肢动物门物种聚为一大支(BP=97),为单系群;软体动物门物种进化地位多样,分布于进化树的基部;鱼类两物种聚为一支(BP=100),脊椎动物聚为一大支(BP=100),位于进化树的最顶层(图3)。

图3 基于21个物种的P-gp同源蛋白氨基酸序列构建的系统进化树Fig.3 Phylogenetic tree based on P-gp am ino acid sequences from 21 species
2.2 Ptabcb1基因在不同组织中的转录表达水平
Ptabcb1基因在三疣梭子蟹各组织中均有表达,在心脏组织中表达量最低,在肝胰腺和肠组织中表达量相对较高,分别为心脏组织中表达量的7.49倍和5.89倍,Ptabcb1基因在肌肉和血淋巴组织中的转录表达水平与心脏相近(3.65倍和2.12倍)(图4)。
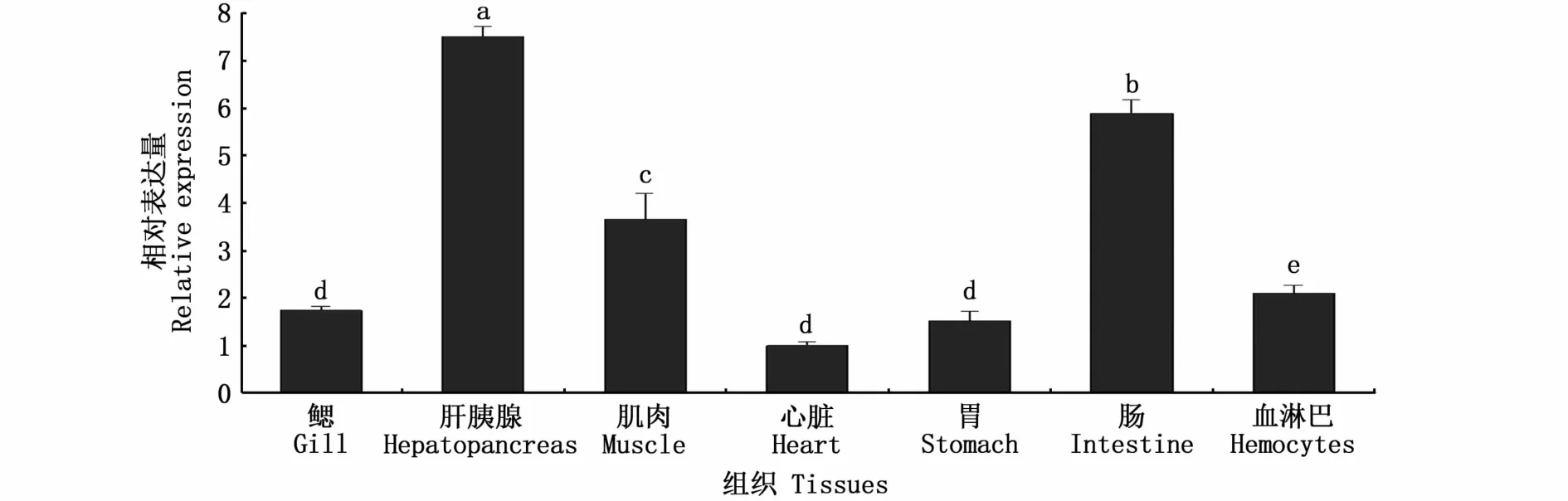
图4 Ptabcb1基因在三疣梭子蟹不同组织中的相对表达量Fig.4 Relative expression levels of Ptabcb1 gene in different tissues of P.trituberculatus
2.3 Ptabcb1基因在三疣梭子蟹肝胰腺中的原位杂交
采用荧光原位杂交法检测Ptabcb1基因在三疣梭子蟹的肝胰腺组织中的主要表达位点,结果如图5所示。DAPI标记细胞核为蓝色,荧光素异硫氰酸酯异构体(FITC)标记mRNA为绿色。绿色荧光主要分布在肝胰腺的细胞质中,说明Ptabcb1基因的特异性荧光探针(绿色荧光)多与肝胰腺的细胞质发生杂交,表明PtP-gp蛋白主要在肝胰腺的细胞质中表达。
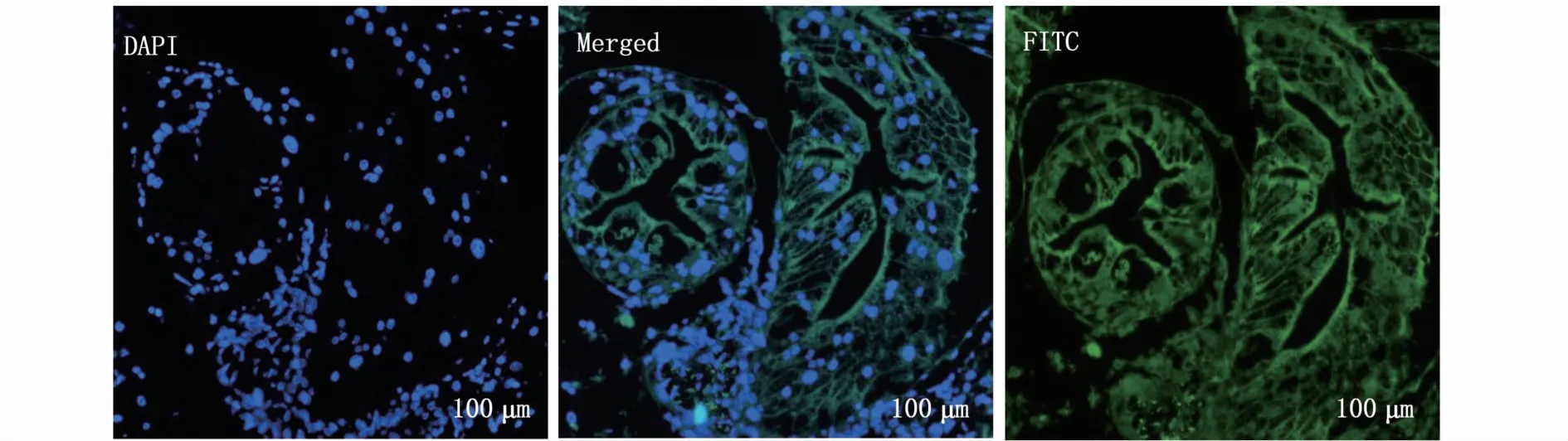
图5 Ptabcb1基因在三疣梭子蟹肝胰腺组织中的原位杂交Fig.5 In situ m RNA hybridization(ISH)of Ptabcb1 gene in P.trituberculatus hepatopancreas
2.4 PtP-gp蛋白在三疣梭子蟹中的累积/外排实验
由表2可知,给药注射后的1~24 h期间内,与单独注射40 mg·kg-1FLR处理组相比,10 μM的VER与40 mg·kg-1的FLR联合给药处理组中,三疣梭子蟹血淋巴、肌肉和鳃组织中FLR的含量显著增加(表2);24 h之后,各组织中FLR含量逐渐下降;在给药后48~72 h期间,各组织中的FLR含量接近单独注射40 mg·kg-1的FLR处理组水平。
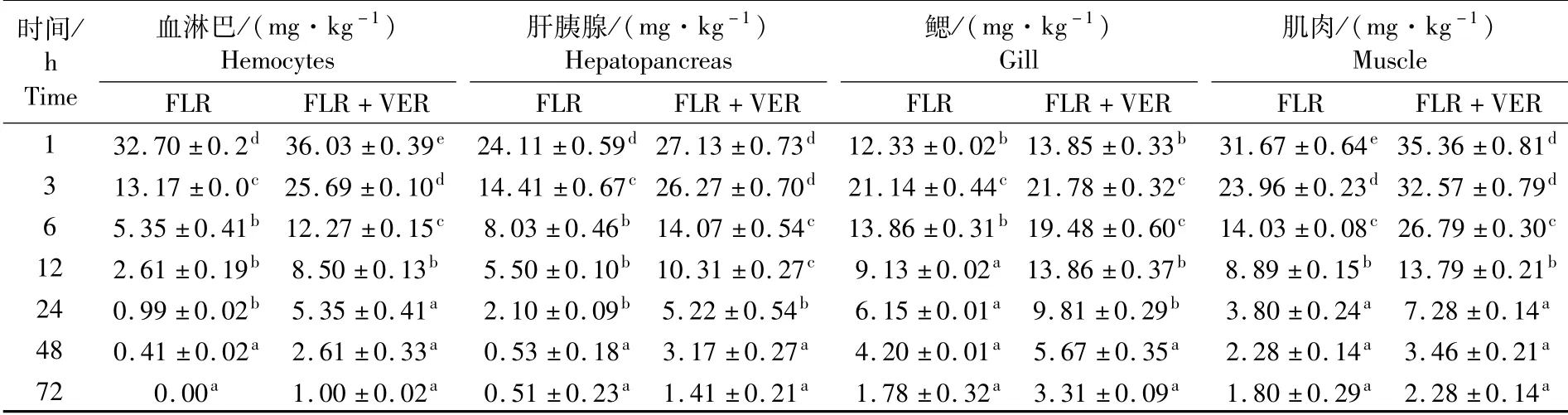
表2 单独和联合给药处理后FLR在三疣梭子蟹组织中的含量对比Tab.2 Concentration of florfenicol in P.trituberculatus tissues after single and combined adm inistration
由表3可知,各浓度FLR给药注射后,能够显著抑制三疣梭子蟹血淋巴、肝胰腺、肌肉和鳃组织中PtP-gp蛋白的转运活力。在血淋巴和肌肉组织中的PtP-gp蛋白的转运活力变化趋势相近,注射FLR初期(1~3 h),PtP-gp蛋白的转运活力显著降低(P<0.05),之后抑制作用随时间延长逐渐变小,48 h后抑制作用消失(P>0.05);在肝胰腺组织中,FLR注射对PtP-gp蛋白的转运活力的抑制作用稍滞后,在注射后3~12 h期间抑制作用最大(P<0.05),24 h后抑制作用随时间延长逐渐变小,72 h后抑制作用消失(P>0.05);FLR注射对三疣梭子蟹鳃组织中PtP-gp蛋白的转运活力影响相对较小,仅在注射后的6~12 h内存在显著抑制作用(P<0.05),其他时间内均无显著影响(P>0.05)。

表3 三疣梭子蟹各组织中PtP-gp蛋白的转运活性Tab.3 PtP-gp activities in P.trituberculatus tissues
2.5 不同浓度FLR注射对三疣梭子蟹Ptabcb1基因的转录表达的影响
不同浓度FLR注射后,能够显著影响三疣梭子蟹肝胰腺、鳃和肌肉组织中的Ptabcb1基因的转录表达,肌肉组织中的诱导作用较强烈,均呈现时间-剂量效应(图6)。80 mg·kg-1的FLR注射1 h后,各组织中Ptabcb1基因的转录水平显著升高(P<0.05),3~12 h期间维持相对较高的诱导作用,12 h后诱导作用显著降低,实验结束时(72 h)各组织中Ptabcb1基因的转录水平仍显著高于对照组水平(P<0.05)。40 mg·kg-1的FLR注射能够立即(1 h内)引起肝胰腺和肌肉组织中Ptabcb1基因的上调表达;鳃组织中诱导作用稍滞后(3 h),在注射后3~12 h内诱导作用较高,12 h后逐渐减小,48 h后恢复到对照组水平,诱导作用消失;注射后1~24 h内肌肉组织中Ptabcb1基因的转录表达被诱导最显著,实验结束时(72 h)肌肉组织中Ptabcb1基因的转录水平仍显著高于对照组水平(P<0.05)。20 mg·kg-1的FLR注射后,能够引起三疣梭子蟹肝胰腺组织中Ptabcb1基因的转录水平在短时间内(3~6 h)上调表达(P<0.05),然后恢复到对照组水平;在鳃组织中诱导作用持续时间略长(3~24 h)(P<0.05);肌肉组织在整个实验周期内能够持续显著诱导Ptabcb1基因的转录表达(P<0.05)。

图6 不同浓度FLR对三疣梭子蟹组织中Ptabcb1基因转录表达的影响Fig.6 Effect of different concentrations of florfenicol on expression levels of Ptabcb1 in P.trituberculatus tissues
2.6 FLR与VER联合注射给药对三疣梭子蟹Ptabcb1基因的转录表达的影响
FLR与VER联合注射给药对三疣梭子蟹组织中Ptabcb1基因的转录表达的影响如图7所示。与单独注射10μM的VER或40 mg·kg-1的FLR相比,VER和FLR联合注射给药能够显著增加Ptabcb1基因在肝胰腺组织中的转录诱导作用(P<0.05),3~24 h期间诱导作用较大。而在鳃组织和肌肉组织中,分别在FLR注射后1~3 h和6~12 h期间能够显著抑制FLR对Ptabcb1基因的转录诱导作用(P<0.05)。实验周期内,10μM的VER单独注射均未显著影响三疣梭子蟹各组织中Ptabcb1基因的转录表达水平(P>0.05)。

图7 FLR和VER单独和联合注射给药对三疣梭子蟹组织中Ptabcb1基因转录表达的影响Fig.7 Effect of single and combined florfenicol and verapam il adm inistration on expression levels of Ptabcb1 in P.trituberculatus tissues
3 讨论
在甲壳动物中,关于abcb1基因的研究是比较少的,目前发现并克隆该基因的物种只有斑节对虾(Penaeusmonodon)(NC_051420.1)、鹅颈藤壶(Pollicipes pollicipes)(NW_023596225.1)、大型蚤(Daphnia magna)(NC_046174.1)和鲑鱼虱(Lepeophtheirus salmonis)(NC_052131.1)。本研究首次克隆获得三疣梭子蟹的Ptabcb1基因序列,其ORF为3 522 bp,共编码1 173个氨基酸,具有2个核苷酸结合结构域(nucleotide-binding domains,NBDs)和2个跨膜结构域(membrane spanning domains,MSDs),其中NBD结构域的组成为Walker A区、Q-loop环、ABC信号肽、Walker B区、D-loop环和H-loop环,符合ABC跨膜转运蛋白的基本结构特征[39-40],推测这些保守结构域对于PtP-gp蛋白在跨膜传递底物时的能量获取和特异性识别转运底物中必不可少[41]。同时ABC信号肽是ABC膜转运蛋白超家族的特征标签序列,存在于Walker A区和Walker B区之间,PtP-gp蛋白的ABC信号肽序列相对保守,为[411MSGGQKQRVAIARAL425]和 [1074LSGGQKQRVAIARAL1088],与脊尾白虾的P-gp同源蛋白序列相比,ABC信号肽序列高度保守,推测该结构域与ABC膜转运蛋白的功能发挥有重要作用[42]。多序列比对分析发现,三疣梭子蟹Ptabcb1编码的蛋白氨基酸与甲壳动物中的脊尾白虾同源性最高,在系统进化树中也与脊尾白虾聚为一支(BP=100),亲缘关系最近,因而表明Ptabcb1基因为ABC膜转运蛋白的编码基因。目前,SHUKLE等[43]发现,ABC膜转运蛋白含有的保守跨膜结构域,与其宿主植物内源性或外源性有毒底物的代谢和解毒有关,同时LUCKENBACH等[40]在关于ABC膜转运蛋白的基因表达、蛋白定位和功能的研究中,也证实ABC膜转运蛋白在加州贻贝(Mytilus californianus)鳃组织中作为一道生理屏障,可以清除异源物质,抵抗外源物的侵犯。根据Ptabcb1基因序列和结构的生物学分析,推测PtP-gp蛋白可能具有与其他物种的同源蛋白相同或相似的外排作用。
研究表明,各种化合物暴露均会引起P-gp蛋白活性或相关基因的转录表达水平的变化[44]。多 环 芳 烃(polycyclic aromatic hydrocarbons,PAHs)、多 氯 联 苯(polychlorinated biphenyls,PCBs)和多溴联苯醚(poly brominated diphenyl ethers,PBDEs)等持久性有机污染物暴露,能够显著改变鱼类、软体动物和甲壳动物体内P-gp蛋白基因的转录表达水平。FRANZELLITTI等[44]研究了氟西汀(fluoxetine)对贻贝(Mytilus edulis)P-gp蛋白基因的转录表达水平的影响,发现30 ng·L-1和300 ng·L-1的氟西汀处理后,贻贝P-gp蛋白基因的转录表达水平显著下调。在本研究中,对三疣梭子蟹注射不同浓度的FLR后,其Ptabcb1基因的转录表达被显著诱导,表明FLR为Ptabcb1基因的潜在转录诱导剂,在对鱼类、软体动物和其他甲壳动物的外源污染物毒理响应研究中,也得到类似结果[45-47]。迄今为止,P-gp蛋白的底物、抑制剂和诱导剂已被广泛应用于各种外源污染物毒理学研究中[48],如异源性生物制剂、重金属和油脂分散剂等,均会上调P-gp蛋白基因的转录表达[49]。而VER是P-gp蛋白的一种外排活性抑制剂[44]。对多种水生无脊椎动物如海洋贻贝的研究发现,外源污染物和P-gp蛋白抑制剂联合处理会导致P-gp蛋白底物即外源污染物积累成倍增加[44]。在本研究中,FLR与VER联合注射以剂量依赖性显著抑制了PtP-gp蛋白活性,导致VER注射处理组三疣梭子蟹体内FLR含量升高,此现象是由于抑制剂VER与PtP-gp蛋白的特异性结合,使得FLR与转运蛋白的结合受阻,因而FLR难以排出体外而累积。实验结果初步证实了PtP-gp蛋白对FLR具有转运活性,转运活力的大小与组织中FLR的累积量相对应,表明在FLR的细胞解毒过程中发挥着重要作用。另外,Ptabcb1基因在三疣梭子蟹各组织中的转录表达结果显示,该基因在三疣梭子蟹的肝胰腺组织中高表达。肝胰腺是三疣梭子蟹解毒代谢的最主要的器官,Ptabcb1在肝胰腺中的高表达进一步也说明了PtP-gp蛋白在三疣梭子蟹肝胰腺组织可以作为机体抵御外源污染物的第一道防线,能够直接将底物或其代谢终产物转运出细胞外[50]。
