特立帕肽通过Wnt3a/β-catenin通路对高糖环境下成骨细胞分化的影响
2022-11-02谷营营秦雅芝温国琛毕文娟
谷营营,侯 甜,秦雅芝,张 妍,温国琛,毕文娟,董 伟
糖尿病性骨质疏松症(diabetic osteoporosis,DOP)是糖尿病常见并发症,其发病因素包括成骨细胞功能降低[1]和糖基化终末产物积累[2],目前临床上主要通过降糖药配合抗骨质疏松药进行治疗,尚无更具有针对性的治疗药物,临床治疗效果仍待提高。Wnt信号通路是多种骨质疏松症发生发展的重要通路,通过影响骨稳态平衡调控骨质疏松的发生[3]。研究[4]表明,Wnt/β-catenin信号通路可通过调节细胞胞质内β-catenin表达量影响成骨细胞増殖分化。高糖状态下Wnt/β-catenin通路表达异常后会干预成骨细胞分化,影响DOP的骨形成及代谢[5]。
特立帕肽(teriparatide,TPTD)与甲状旁腺激素[PTH(1-84)]的前34个氨基酸分子相同,是一种用于治疗重度骨质疏松症的促骨形成类首选药物,能够促进骨形成,提高骨量[6]。临床上,TPTD多用于绝经后重度骨质疏松症及伴发骨折的治疗,治疗效果理想[7],但尚未发现其影响DOP的分子学及临床实验研究。该实验通过诱导MC3T3-E1细胞在高糖条件下成骨分化,同时加入TPTD及Wnt3a抑制剂,观察TPTD对高糖环境下成骨细胞分化的影响及Wnt3a/β-catenin通路在其中的调控作用,以期为临床上TPTD成为DOP的潜在治疗药物提供细胞学理论研究基础。
1 材料与方法
1.1 细胞小鼠MC3T3-E1细胞,为成骨细胞前体细胞,可诱导分化为成骨细胞(中科院上海细胞库)。
1.2 实验方法
1.2.1细胞培养和实验分组 实验分为5组:低糖组(5.5 mmol/L葡萄糖)、低糖+TPTD组(5.5 mmol/L葡萄糖+10 nmol/L TPTD)、高糖组(16.5 mmol/L葡萄糖)、高糖+TPTD组(16.5 mmol/L葡萄糖+10 nmol/L TPTD)、高糖+TPTD+G244-LM组(16.5 mmol/L葡萄糖+10 nmol/L TPTD+0.1 μmol/L G244-LM)。MC3T3-E1细胞培养至含15%胎牛血清的DMEM完全培养基中,在细胞接种且贴壁后,更换为含有成骨诱导液(10 nmol/L地塞米松溶液+50 μmol/L抗坏血酸溶液+10 mmol/Lβ-甘油磷酸钠溶液)的新鲜培养基,并按照分组加入TPTD溶液及Wnt3a抑制剂G244-LM。
1.2.2细胞增殖实验 5组细胞于96孔板中培养24、48、72 h后,加入CCK-8溶液,37 ℃恒温培养4 h后,测定490 nm处的吸光度值,并按照数据绘制5组细胞的生长曲线图。5组细胞培养3d后,PBS冲洗3次,加入钙黄绿素乙酰氧基甲酯(calcein acetoxymethyl ester,Calcein-AM)染色工作液,室温避光孵育20 min,荧光显微镜观察细胞染色情况并进行细胞计数。
1.2.3成骨分化检测 5组细胞培养7 d后,4%多聚甲醛溶液室温固定15 min,NBT/BCIP碱性磷酸酶(alkaline phosphatase,ALP)试剂避光染色30 min,PBS冲洗3次,观察各组细胞ALP染色情况。ALP试剂盒检测各组细胞蛋白活性,酶标仪读取各组数据。5组细胞培养21 d后,每孔加入4%多聚甲醛溶液于室温固定15 min,1%茜素红s染色20 min,PBS洗涤3次后观察钙化沉积情况。使用Image J软件分析茜素红阳性面积占总面积百分比。
1.2.4免疫荧光分析 5组细胞培养5 d后,4%多聚甲醛固定15 min,0.5% Triton X-100溶液透化细胞15 min,室温下加入FITC-phalloidin孵育3 h后,用5 μg/ml DAPI室温孵育5 min后,观察各组细胞肌动蛋白形成情况。
1.2.5实时荧光定量PCR分析 将各组细胞总RNA逆转录为cDNA,SYBR®Green Realtime PCR Master Mix进行Real-time PCR,PCR产物用StepOnePlus实时PCR系统(美国赛默飞世尔科技公司)检测。选用GAPDH作为内参基因。反应程序:95 ℃、1 min,95 ℃、15 s,60 ℃、15 s,72 ℃、45 s,共40个循环。以2-ΔΔCT法分析测定基因表达水平,引物序列见表1。

表1 实时定量PCR目的基因引物序列
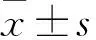
2 结果
2.1 TPTD对高糖条件下MC3T3-E1细胞增殖活性的影响应用CCK-8法测定5组细胞培养24、48、72 h后各组细胞增殖情况。结果显示,各组细胞增殖活性结果差异无统计学意义(F=0.985,P>0.05)。见图1、表2。提示TPTD对高糖环境下各组细胞增殖活性无影响。

图1 CCK-8实验检测细胞培养24、48、72 h后各组细胞的生长增殖曲线
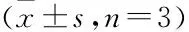
表2 CCK-8检测高糖环境下MC3T3-E1细胞增殖活性
5组细胞培养3 d后,进行Calcein-AM染色观察细胞增殖趋势。各组细胞计数结果分别为:低糖组(437.43±37.19)个,低糖+TPTD组(494.13±66.04)个,高糖组(401.20±44.42)个,高糖+TPTD组(409.90±79.08)个,高糖+TPTD+G244-LM组(342.06±53.42)个。各组细胞计数结果差异无统计学意义(F=2.742,P>0.05)。见图2。提示各组细胞增殖趋势无明显差异。

图2 各组细胞培养3 d后Calcein-AM染色观察细胞增殖 Calcein-AM染色 ×40 A:低糖组;B:低糖+TPTD组;C:高糖组;D:高糖+TPTD组;E:高糖+TPTD+G244-LM组
2.2 TPTD对高糖条件下成骨细胞分化的影响5组细胞培养7 d后,进行ALP染色及蛋白活性检测。ALP染色结果显示:各组细胞都存在不同程度的成骨分化现象,其中,低糖+TPTD组细胞染色区域高于其他四组,细胞分化状态较好(P<0.05);高糖组细胞分化较少,明显低于高糖+TPTD组和低糖组细胞的分化结果(P<0.05);高糖+TPTD组染色区域高于高糖组和高糖+TPTD+G244-LM组(P<0.05),见图3。蛋白定量检测结果(U/g)为:低糖组(0.508±0.006),低糖+TPTD组(0.767±0.026),高糖组(0.382±0.019),高糖+TPTD组(0.449±0.022),高糖+TPTD+G244-LM组(0.213±0.008)(F=449.804,P<0.05)。结果提示高糖抑制成骨细胞ALP分化及蛋白活性,TPTD促进成骨细胞ALP分化及蛋白活性;高糖+TPTD组加入Wnt3a抑制剂后,成骨细胞分化量减少,蛋白活性降低。

图3 各组细胞培养7 d后ALP染色后观察A:低糖组;B:低糖+TPTD组;C:高糖组;D:高糖+TPTD组;E:高糖+TPTD+G244-LM组;1:×40;2:×100
5组细胞培养21 d后,进行茜素红s染色。结果显示,低糖组(16.82%±0.98%)、低糖+TPTD组(32.40%±1.09%)、高糖组(11.79%±1.28%)、高糖+TPTD组(19.26%±0.78%)、高糖+TPTD+G244-LM组(7.51%±1.15%)各组细胞染色阳性区域比组间差异有统计学意义(F=235.692,P<0.05)。见图4。低糖+TPTD组细胞染色阳性区域比最高(P<0.05);高糖组细胞染色阳性区域比低于低糖组(P<0.05),高糖+TPTD组细胞染色阳性区域比高于高糖+TPTD+G244-LM组(P<0.05)。以上结果表明:高糖抑制成骨细胞分化;TPTD的加入促进成骨细胞分化;在高糖+TPTD组加入Wnt3a抑制剂后,成骨细胞分化水平降低。
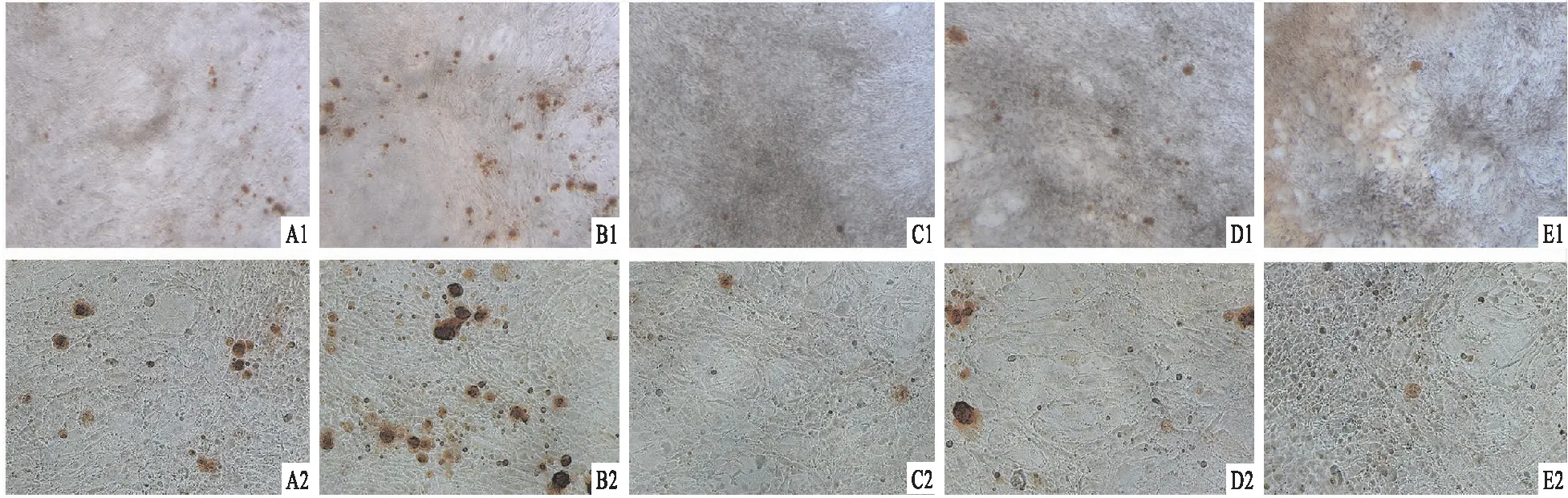
图4 细胞培养21 d后进行茜素红s染色结果A:低糖组;B:低糖+TPTD组;C:高糖组;D:高糖+TPTD组;E:高糖+TPTD+G244-LM组;1:×40;2:×100
2.3 TPTD对高糖条件下成骨细胞肌动蛋白的影响5组细胞培养5 d后,免疫荧光染色结果显示,低糖+TPTD组细胞骨架最清晰;高糖组和高糖+TPTD+G244-LM组细胞骨架清晰程度均低于高糖+TPTD组。见图5。结果表明,高糖降低MC3T3-E1细胞细胞骨架清晰程度;TPTD的加入提高了细胞骨架清晰程度;Wnt3a抑制剂明显降低高糖+TPTD组细胞骨架清晰程度。
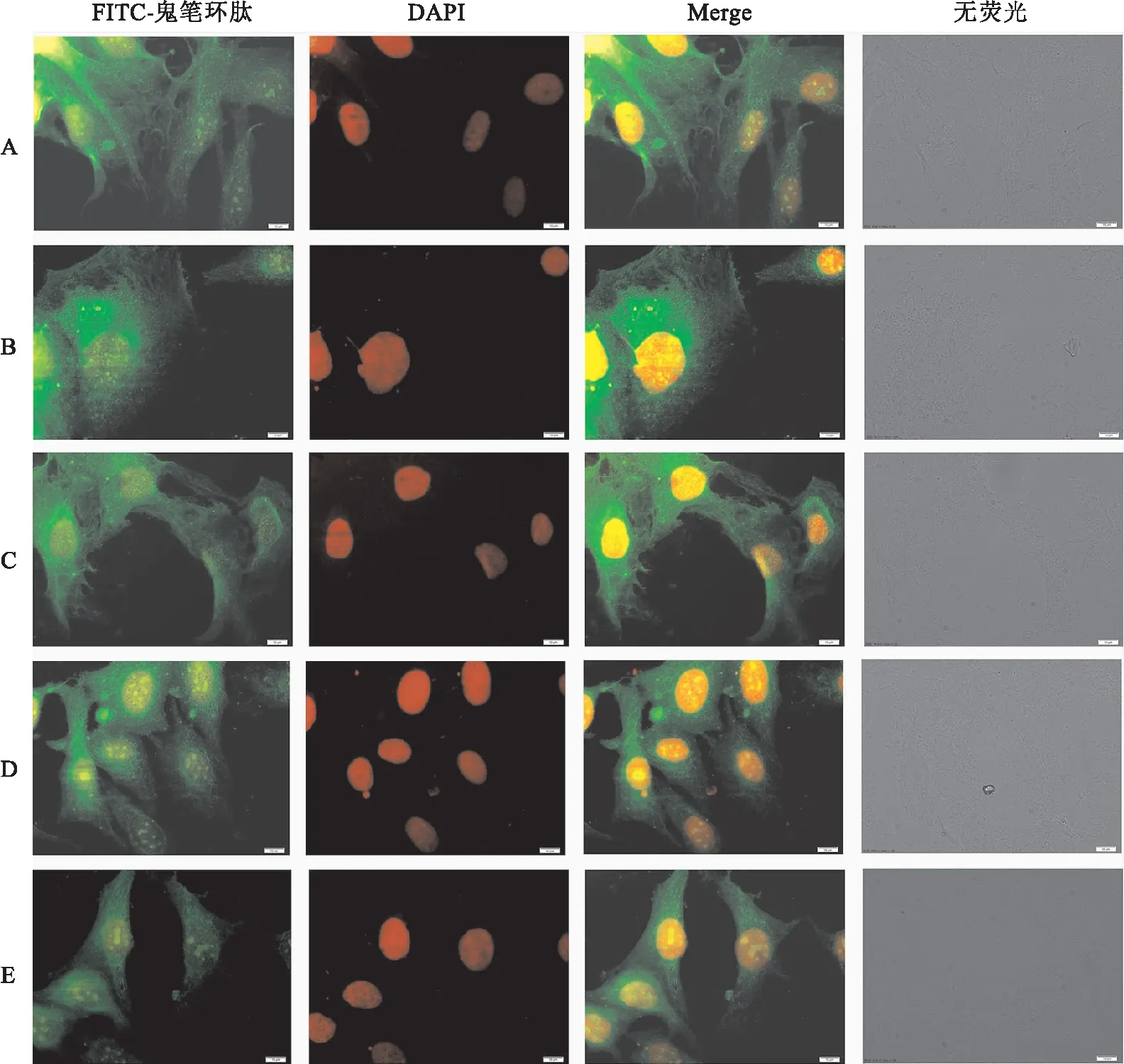
图5 5组细胞细胞骨架FITC-phalloidin染色及细胞核DAPI染色观察 ×400A:低糖组;B:低糖+TPTD组;C:高糖组;D:高糖+TPTD组;E:高糖+TPTD+G244-LM组
2.4 TPTD对高糖条件下成骨相关基因mRNA表达的影响5组细胞进行Real-time PCR检测结果显示:低糖+TPTD组细胞Wnt3a、β-catenin、Tcf1、OPG、COLⅠ mRNA水平最高;低糖组各基因mRNA水平均高于高糖组;高糖+TPTD组细胞各基因mRNA水平均高于高糖组和高糖+TPTD+G244-LM组。见图6。结果表明,高糖抑制成骨细胞Wnt3a、β-catenin、Tcf1、OPG、COLⅠ mRNA表达;加入TPTD后促进成骨细胞上述各基因mRNA表达;加入Wnt3a抑制剂后各基因mRNA表达均降低。
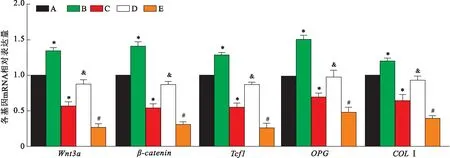
图6 5组细胞进行Real-time PCR分析结果A:低糖组;B:低糖+TPTD组;C:高糖组;D:高糖+TPTD组;E:高糖+TPTD+G244-LM组;与低糖组比较:*P<0.05;与高糖组比较:&P<0.05;与高糖+TPTD组比较:#P<0.05
3 讨论
该研究表明高糖抑制成骨细胞分化,同时抑制Wnt/β-catenin通路相关基因Wnt3a、β-catenin、Tcf1、OPG、COLⅠ mRNA表达;TPTD可促进高糖环境下成骨细胞分化,提高上述各基因mRNA表达。
有研究[8]通过检测糖尿病模型中细胞焦亡相关因子的表达,表明高血糖可通过细胞焦亡途径抑制成骨细胞的增殖和分化;同时研究ME3T3-E1细胞显示,高血糖可通过Caspase-1/GSDMD/IL-1β途径抑制成骨细胞增殖分化。Wu et al[9]在糖尿病小鼠模型中发现,高血糖小鼠体内成骨分化相关基因ALP和Runx2蛋白的表达明显降低,成骨分化受到抑制。研究[10]表明,高糖抑制MC3T3-E1细胞向成骨分化,抑制成骨标志物Runx2、COL Ⅰ表达。但目前高糖抑制成骨细胞分化的具体分子机制尚在研究。该实验通过高糖培养基与低糖培养基分别培养成骨细胞前体MC3T3-E1细胞,观察在高糖水平下成骨细胞增殖活性及分化矿化水平是否受到影响,结果显示,高糖水平下各组细胞增殖活性不具有统计学差异,但高糖会降低成骨细胞分化及矿化结节形成水平。Wnt/β-catenin通路在成骨微环境中起重要作用[11],Wnt3a是Wnt/β-catenin通路的重要组成部分,通过调控β-catenin的表达量参与多项成骨分化相关研究。Deshmukh et al[12]研究表明,Wnt3a可通过调控其下游β-catenin因子影响Wnt3a/β-catenin通路下游靶基因,参与间充质细胞向成骨细胞和软骨细胞分化的平衡。Feng et al[13]研究发现,胰岛素生长因子-1(IGF-1)可通过Wnt/β-catenin途径,经Wnt3a、β-catenin、cyclinD1、Runx2、OPN等因子促进骨髓间充质干细胞增殖及骨质发生分化。那么,Wnt3a是否可以通过干预β-catenin表达量在高糖环境下对成骨细胞发挥作用尚未可知。该实验通过加入Wnt3a抑制剂,探究了其是否参与了高糖环境下成骨细胞分化作用,结果显示抑制Wnt3a表达后,β-catenin及其下游Tcf1表达量随之降低,成骨分化相关基因OPG及COLⅠ表达亦受到抑制,说明Wnt3a/β-catenin通路参与了高糖环境下成骨细胞分化过程。
研究[14]表明,PTH(1-84)可以通过与Wnt配体共用一个受体β-catenin信号发挥作用。小鼠体内PTH(1-84)受体过表达,会导致Wnt/β-catenin通路下游基因表达增加,促进成骨细胞增殖,减少其凋亡[15];但TPTD作为治疗骨质疏松症的PTH(1-34)的重组骨代谢药物,能否通过Wnt/β-catenin通路参与MC3T3-E1细胞成骨分化过程尚未有明确报道。该实验通过在高糖环境下加入药物TPTD及Wnt3a抑制剂进行干预,观察MC3T3-E1细胞成骨分化及细胞骨架情况。ALP染色及蛋白活性定量、茜素红s染色和免疫荧光实验结果显示,高糖+TPTD组细胞成骨分化水平及细胞骨架清晰度优于高糖组及高糖+TPTD+Wnt3a抑制剂组;Real-time PCR结果显示高糖+TPTD组细胞Wnt3a、β-catenin、Tcf1、OPG、COLⅠ 各基因mRNA表达量高于高糖组和高糖+TPTD+Wnt3a抑制剂组,提示TPTD可通过Wnt3a/β-catenin通路调控成骨细胞分化。
综上所述,该研究表明,高糖降低成骨细胞分化水平及细胞骨架清晰程度,抑制Wnt3a及其下游β-catenin、Tcf1、OPG及COLⅠ表达;TPTD可通过调控Wnt3a/β-catenin信号通路促进高糖环境下MC3T3-E1细胞成骨分化,提高细胞骨架清晰程度,提高上述通路相关基因表达。该研究为临床上TPTD成为DOP潜在治疗药物提供了理论基础,并说明Wnt3a/β-catenin信号通路有潜力成为治疗DOP的新靶点。
