结直肠息肉切除术后复发的临床特点及相关因素
2022-11-02蒯亚仙徐建华
蒯亚仙,李 杨,徐建华,王 旭,孙 斌
2021年全球结直肠癌新发病例占恶性肿瘤发病率10.0%,位列第3位;结直肠癌病死率例占恶性肿瘤病死率9.4%,位列第2位[1]。在我国,最新发布的全国癌症统计数据显示,结直肠癌的发病率位列第2位,病死率位列第4位,发病率逐年上升[2]。结直肠息肉是结直肠癌最重要的癌前病变,结肠镜检查中对息肉的切除可以减少结肠直肠癌(colo-rectal carcinoma,CRC)总病死率[3]。息肉最常见的类型是腺瘤,腺瘤的数量是结直肠癌的重要风险因素,因此患有多发息肉的人群是临床工作中重点关注的对象。结肠息肉漏诊是导致间期结肠癌的风险因素[4-5],对于已经行结肠镜检查及息肉切除治疗的患者,第2次结肠镜检查中如何降低漏诊概率、识别息肉复发的高风险因素尤为重要。该文旨在对结直肠息肉切除后复发的特点进行研究,为息肉复发的临床风险评估工作提供依据。
1 材料与方法
1.1 病例资料选取2016年10月—2021年11月在安徽医科大学第一附属医院消化内镜中心接受结肠镜检查的患者370例。记录患者性别、年龄、内窥镜图像特征及病理资料等数据,所有结肠镜检查及治疗均由有经验的内窥镜医师(具有5年以上工作经验,结肠镜检查工作量>500次/年)进行。
1.1.1纳入标准 ① 至少进行过2次结肠镜检查,2次检查的时间间隔至少6个月,且第2次结肠镜检查发现至少一处息肉复发;② 结肠镜检查中发现的所有息肉都应通过内镜治疗完全切除,且患者病历资料记录完整;③ 首次结肠镜检查并行内镜下切除术之前6月内患者至少在该院或者外院进行过1次结肠镜检查,确认存在结肠息肉;④ 每次检查及治疗均行完整结肠镜检查,完整的结肠镜检查指所有到达盲肠的结肠镜检查;⑤ 结肠镜下息肉切除术应获得所切息肉组织病理学的完整资料。
1.1.2排除标准 ① 有家族或个人有遗传性息肉综合征病史、炎症性肠病、缺血性肠病或个人CRC病史;② 结肠外科手术史;③ 新发现CRC患者;④ 未完成完整的结肠镜检查。
1.2 研究内容将每次术前6个月内完成的结肠镜检查定义为初筛,作为高质量结肠镜检查的依据。将行内镜下切除治疗的两次结肠镜检查定义为首次和第2次结肠镜检查。依据第2次结肠镜复查复发息肉数量是否超过3枚,分为多发性复发组(复发息肉数量≥3枚)和非多发性复发组(复发息肉数量<3枚)[6],在本研究过程中,回顾所有的结肠镜检查资料和病理报告,并收集有关息肉的颜色、数量、大小、位置、形状、切除方式和病理以及患者的年龄、性别和检查时间、肠道准备情况的资料,并分别进行统计分析。
1.3研究方法① 用打开的活检钳(6 mm)估计息肉的大小,或在切除后测量,大小单位为cm;② 位置分为近端结肠(盲肠、升结肠、肝曲、横结肠和脾曲),远端结肠(降结肠、乙状结肠和直肠);③ 根据Paris内镜分类将息肉的形状分为隆起型(Ⅰp、Ⅰs、Ⅰsp)和表浅型(0-Ⅱa、0-Ⅱb、0-Ⅱc);④根据世界卫生组织推荐的结肠直肠癌分级标准,将病理分类为腺瘤型(管状腺瘤、绒毛状腺瘤)和非腺瘤型(传统锯齿状息肉、炎性或增生性息肉及其他类型),以及是否存在绒毛状组织;⑤切除方式分为冷切除和热切除,其中冷切除包括活检钳夹除和圈套器切除,热切除包括电凝、内镜下黏膜切除术(EMR)、内镜下黏膜剥离术(ESD);⑥多发性息肉患者的大小、位置和组织学类型分别根据最大、最近端和最晚期病变进行分类;⑦色泽分为发红与非发红。
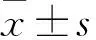
2 结果
2.1 基本资料筛选出15 627例完整结肠镜检查有结直肠息肉的患者资料,已行内镜下结直肠息肉切除术的有6 176例患者,仅1 551例患者接受2次及以上的内镜下结肠息肉切除术,其中31例患者结肠镜检查间隔不足半年,138例患者患有炎症性肠病、家族性腺瘤性息肉病或Peutz-Jeghers综合征,300例患者有结直肠癌病史,20例患者有结直肠外科手术史,110例患者在复查中新发现了癌性病变,582例患者病理资料不全,最终在370例符合条件的患者中,依据第2次结肠镜结果,复发息肉数量是否超过3枚,分为多发性复发组(复发息肉数量≥3枚,)和非多发性复发组(复发息肉数量<3枚)。
2.2 两组患者基本特征统计分析非多发性复发组314例,其中男性245例,女性69例,结肠镜检查时年龄为22~82(53.50±10.87)岁,两次检查时间间隔477(359,760)d,首次检查和第2次检查息肉个数分别是2(1,2)、1(1,2)个,波士顿肠道评分(the Boston bowel preparation scale,BBPS)分别为(6.28±1.54)分和(6.54±1.32)分;多发性复发组56例,其中男性47例,女性9例,结肠镜检查时的平均年龄为28~75(56.38±10.25)岁,两次检查时间间隔490(375,997)d,首次检查和第2次检查息肉个数分别是2(1,4)、3(3,4)个, BBPS分别为(6.43±1.49)、(6.46±1.32)分。对两组总特征统计分析,其中非多发性复发组首检息肉数2(1,2),多发性复发组首检息肉数2(1,4),P=0.001,即多发性复发与首次结肠镜检查时息肉数量有关,首次检查中发现并切除的息肉数量越多,越容易出现多发性复发。见表1。
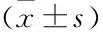
表1 非多发性复发组和多发性复发组基本特征的比较
2.3 首次结肠镜检查结果统计分析首次结肠镜检查中非多发性复发组与多发性复发组息肉数量分别为582、143个,两组息肉大小分别为0.6(0.4,1.0)、0.6(0.5,1.0) cm,息肉部位分析中左半结肠占比分别为0.70、0.59,两组腺瘤占比分别为0.68、0.71,存在绒毛状成分的占比分别为0.06、0.06,热切除占比分别为0.05、0.60,隆起型息肉占比分别为0.09、0.08,发红息肉占比分别为0.81、0.89。在单因素统计分析中,息肉大小(P=0.033)、息肉部位(P=0.002)、息肉色泽(P=0.032)是息肉多发性复发的风险因素,在左半结肠、较大的息肉、颜色发红的息肉更容易出现多发性复发。在多因素回归分析中,息肉的部位是多发性复发的独立风险因素,P=0.001,左半结肠更容易出现多发性复发,其中乙状结肠发生多发性复发的比例最高。见表2。

表2 非多发性复发组和多发性复发组首次结肠镜检查结果的比较(n)
2.4 第2次结肠镜检查结果统计分析第2次结肠镜检查中非多发性复发组的息肉数量为405个,多发性复发组的息肉数量为189个,息肉大小分别为0.5(0.4,0.6)、0.5(0.4,0.7) cm,息肉部位分析中左半结肠占比两组分别为0.62、0.60,腺瘤占比分别为0.53、0.59,存在绒毛状成分的占比分别为0.02、0.04,热切除占比分别为0.21、0.36,隆起型息肉占比分别为0.16、0.15,发红息肉占比分别为0.71、0.74。在单因素统计分析中,分别采用Mann-WhitneyU检验及皮尔森卡方检验统计结果显示,息肉大小(P=0.008)、切除方式(P<0.001)是息肉多发性复发的相关因素;在多因素回归分析中,切除方式是多发性复发的独立相关因素(P=0.001),说明多发性复发组的息肉直径较大,而治疗息肉时更多地采用热切除方法。见表3。

表3 非多发性复发组和多发性复发组第2次结肠镜检查结果的比较(n)
3 讨论
定期检查发现结直肠息肉复发是预防结直肠癌发生的关键,2020年发表的美国最新共识中提示,息肉切除后的监测和检查要根据息肉患者所检出息肉的组织学、数量、位置和大小进行风险分层,其中腺瘤数量≤2的小腺瘤为低危组,而根据不同的风险分层,结肠镜检查的监测间隔各不相同,其中最短的监测间隔为6个月,故本研究中以此作为纳入和分组的标准[4]。比较两组患者在两次结肠镜检查中的腺瘤占比,虽然复查中都有所降低,但腺瘤性息肉依旧占据主导地位,近年来发表的研究表明,在随访中,多个腺瘤患者发生进展期腺瘤的风险增加,甚至发生结直肠癌的风险增加[7-8],这就使得对结直肠息肉切除后的多发性复发研究更具有意义。
通过统计分析,本研究得出首次结肠镜检查中息肉的数量是息肉切除后多发性复发的独立风险因素。首次结肠镜检查中发现并切除的息肉数量越多,越容易发生多发性复发,这与Pommergaard et al[7]研究结果一致。Pommergaard指出息肉切除术后多发性复发除了与患者的个人体质、生活饮食习惯相关外,还与息肉的不完全切除率有关。近来高质量研究[9-10]也表明,随着息肉切除数量的增加,由不完全切除导致的复发风险也在增加,成为多发性复发的风险因素之一。本研究在对首次结肠镜检查的单因素分析中提示,多发性复发与首次检查中息肉的大小和色泽也具有相关性,Hao et al[6]研究指出越大的息肉不完全切除率越高,且可能含有的进展期腺瘤可能性越大,而发红的息肉也更容易被发现,这与本研究结果相一致,但是在多因素回归分析中,息肉大小和色泽的相关风险因素没有统计学意义。本研究另一个结果是息肉切除后的多发性复发与息肉的位置有关,在第2次结肠镜检查中,两组息肉部位分析中左半结肠占比都达半数以上,而多发性复发组的左半结肠息肉占比0.62以上,故左半结肠息肉更容易出现多发性复发,这与Alecu et al[11]研究结果一致。该结论与其他研究中右半结肠容易出现息肉复发的结论并不矛盾,右半结肠因其解剖位置及息肉类型的特殊,更容易发生漏诊和息肉的复发,而本研究中两次治疗前均予以至少一次的结肠镜检查,因而减少了右半结肠的漏诊,乙状结肠、直肠更容易出现增生性息肉,故发生多发性复发的可能性更大。
本研究还对其他P>0.05的因素进行了统计分析,两组中具有绒毛状组织的息肉占比相当,但是在第2次结肠镜复查中多发性复发组中绒毛状组织的占比明显高于非多发性复发组,虽然P=0.077,由于具有绒毛状组织的腺瘤被认为是具有进展期腺瘤特征[4],因此在临床工作中更应对其做出妥善处理,防止复发,甚至导致结直肠癌的发生。近年来研究[9、12-15]表明男性、≥60岁、基线结肠镜检查中进展期腺瘤、切除方式等与复发相关,但本研究的结果没有发现这些相关性,除了研究主题有区别外,还可能因本研究是单中心的回顾性研究,存在选择偏倚,数据量不够大、时间间隔短等原因,后期应继续扩大研究的数量和范围,用大量的队列研究来阐明息肉切除后复发的特点,得出更加科学的结论。
总之,首次结肠镜检查中息肉的数量和息肉的部位是息肉切除后多发性复发的独立风险因素,结肠镜下发现并切除的息肉数量越多,越容易发生息肉的多发性复发,左半结肠也更容易出现息肉的多发性复发。因此,对于多发性息肉患者,尤其是息肉数量≥3的患者,应当为其提供个体化的结肠镜复查方案。
