PLAU和AKT1在口腔鳞癌中的表达
2022-11-02孙二灿肖巧玲夏飞飞黎昌学
孙二灿,肖巧玲,夏飞飞,刘 喆,徐 江,黎昌学
口腔鳞癌(oral squamous cell carcinoma, OSCC)是以组织浸润和淋巴结转移倾向为特征的恶性肿瘤,其发病率在所有癌症中排名第六,全球每年新增OSCC病例超过20万例[1]。手术联合化疗可以提高OSCC患者的总生存期,术前化疗可缩小肿瘤,术后化疗可预防肿瘤复发转移。因此,进一步研究OSCC的发病机制,寻找OSCC预后和靶向治疗的有效分子标志物,具有重要的临床意义。
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路调节许多不同的细胞过程。该通路的异常激活常见于肺癌、结肠癌、胰腺癌、前列腺癌、乳腺癌、胃癌和卵巢癌[2]。尿激酶纤溶酶原激活剂(urokinase plasminogen activator,PLAU)编码一种丝氨酸蛋白酶,该蛋白酶与其受体结合后促进蛋白质水解,促进肿瘤细胞间质的降解[3]。因此,PLAU在肿瘤细胞的迁移、侵袭和转移中发挥关键作用。然而,关于PLAU和蛋白激酶B1(v-akt murine thymoma viral oncogene homolog 1,AKT1)在OSCC中的关系的报道较少。该研究通过检测AKT1和PLAU在OSCC及正常组织中的表达,探讨其与OSCC临床病理及预后特征的关系。
1 材料与方法
1.1 病例资料收集2008—2012年在石河子大学医学院第一附属医院治疗的106例OSCC和73例正常组织(对照组)。课题组选取术前未接受任何治疗和不存在其他癌症的患者,最终获取临床病理资料和随访信息完整的70例OSCC组织(OSCC组)和50例正常组织制成组织(对照组)芯片,随访截止日期为2020年7月30日。本研究经石河子大学第一附属医院伦理委员会批准。
1.2 免疫组织化学染色采用EnVision两步法,将组织芯片切成4 μm吸附在载玻片上去脂水合,在EDTA缓冲液中热诱导提取抗原,在3%过氧化氢中阻断内源性过氧化物酶活性,用3%的牛血清阻断非特异性抗原的染色,孵育一抗PLAU(1 ∶50,货号ab133563)和AKT1(1 ∶100,货号ab81283)(英国Abcam公司)在4 ℃下培养过夜,DAB显色液显色1 min后苏木精复染封片。免疫组织化学染色结果由2名病理医师采用双盲方法进行评价,免疫反应总分(immunoreactive score,IRS)计算为阳性细胞百分比乘以细胞着色强度(表1)。根据IRS值,结果分为两组,其中≤6分为低表达组,>6分为高表达组。
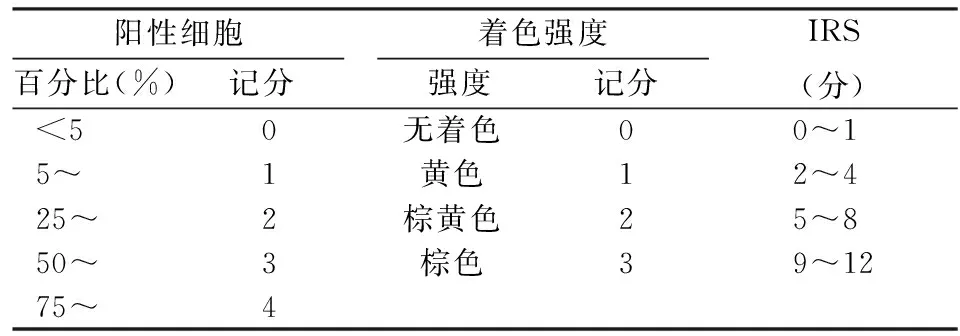
表1 免疫组织化学评分表
1.3 统计学处理采用SPSS 23.0软件对数据进行分析,采用χ2检验分析PLAU和AKT1的表达水平与患者临床病理特征的相关性,使用Kaplan-Meier法进行生存分析,采用Spearman秩和检验分
总分=阳性细胞所占百分比分值×着色强度分值
别确定PLAU和AKT1在OSCC和正常组织表达的关系。P<0.05为差异有统计学意义。
1.4 生物信息学数据库验证为了提高实验的可信度,使用生物信息学数据库进行验证。GEPIA数据库(http://gepia.cancer-pku.cn/detail.php)是一个在线分析网站,其包含数据来自TCGA和GTEx数据库的9 736个肿瘤样本和8 587个正常样本的数据[4]。课题组首先使用GEPIA来研究OSCC和正常组织中PLAU和AKT1的表达差异,随后课题组评估PLAU和AKT1在OSCC中高低表达与患者预后之间的联系。最后使用GEPIA数据库分别验证PLAU和AKT1的表达在OSCC和正常组织的相关性。
2 结果
2.1 PLAU和AKT1在OSCC中表达情况及与临床病理特征的关系PLAU主要分布在OSCC细胞胞质或(和)细胞膜上,AKT1主要分布在OSCC细胞细胞核或(和)细胞胞质,均呈棕黄色或黄褐色(图1)。PLAU和AKT1在OSCC组织阳性表达率高于正常组织,差异有统计学意义(P<0.01,P<0.05),见表2,PLAU和AKT1表达与OSCC患者年龄、性别、TNM分期、T分期、淋巴结转移、分化程度、吸烟史、饮酒史等均无关(P>0.05),见表3。

表2 OSCC及正常组织中PLAU和AKT1的表达(n)

表3 OSCC中PLAU和AKT1表达与临床病理特征的关系(n)

图1 PLAU和AKT1在OSCC和正常组织中表达情况A1、A2:PLAU在OSCC组织中表达;A3、A4:PLAU在正常组织中表达;B1、B2:AKT1在OSCC组织中表达;B3、B4:AKT1在正常组织中表达;A1、A3、B1、B3:×100;A2、A4、B2、B4:×400
2.2 OSCC中PLAU和AKT1表达与患者的预后关系采用Kaplan-Meier分析PLAU和AKT1表达是否可以作为预测OSCC预后的指标,并绘制生存曲线检测了70例有完整随访资料的OSCC患者的PLAU和AKT1表达水平与预后的关系。分析结果显示PLAU和AKT1高表达组患者术后生存时间短于低表达组患者,差异有统计学意义(P<0.05),见图2。
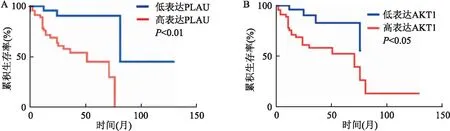
图2 PLAU和AKT1表达与OSCC患者预后的生存分析
2.3 OSCC中PLAU和AKT1表达的关系相关性分析显示,在OSCC组织样本中PLAU和AKT1呈明显相关性(r=0.357,P=0.002),见表4。在正常组织样本中PLAU和AKT1无明显相关性(r=0.24,P=0.094),其中r为相关系数,见表5。

表4 OSCC织中PLAU与AKT1表达的关系

表5 正常组织中PLAU与AKT1表达的关系
2.4 PLAU和AKT1在生物信息学数据库中验证结果生物信息学数据库验证结果显示PLAU和AKT1在OSCC中表达高于正常组织(P<0.05),见图3A、B。同样,在OSCC中,PLAU和AKT1高表达的生存时间短于PLAU和AKT1低表达患者生存时间(P<0.05),见图3C、D。最后,PLAU和AKT1相关性分析显示,在OSCC中,PLAU和AKT1表达有明显相关性(r=0.35,P<0.001),在正常组织中,PLAU和AKT1表达之间没有相关性(r=0.26,P=0.088),见图3E、F。

图3 GEPIA数据库对实验结果验证A、B:OSCC和正常组织中PLAU和AKT1的表达差异;T:OSCC组织;N:正常组织;与正常组织比较:*P<0.05;C、D:PLAU和AKT1的表达与OSCC患者预后的生存分析;E、F:OSCC和正常组织中PLAU和AKT1表达的关系
3 讨论
OSCC是一种常见的发生于口腔部位的恶性肿瘤,约90%的口腔恶性肿瘤都是OSCC[5]。PI3K/AKT信号通路在细胞增殖、生长和凋亡等具有不同的作用,特别是在促进细胞存活和抑制细胞凋亡方面发挥着重要作用[6]。AKT蛋白家族是PI3K/AKT信号通路的关键蛋白,其包括AKT1、AKT2和AKT3三个亚型[7],虽然各亚型在结构上有显著的相似性,但其功能却存在很大差异[8]。研究[9]显示AKT1在细胞存活、增殖、肿瘤发育、血管生成和肿瘤转移中发挥重要作用。PLAU是一种能将纤溶酶原转化为纤溶酶的丝氨酸蛋白酶,其在喉癌、胃癌和肝癌表达升高,同时PLAU的表达升高与其不良预后有关[10-11]。此外,PLAU可促进纤维蛋白溶解和细胞外基质降解,从而导致癌细胞扩散和转移与PLAU表达密切相关。然而,PLAU和AKT1在OSCC中的功能和机制依然需要进一步探讨。
本研究结果显示,PLAU和AKT1在OSCC中表达高于正常组织,表明PLAU和AKT1高表达在OSCC的发生发展起重要作用。随后课题组对PLAU和AKT1在OSCC中的表达与肿瘤分化、TNM分期、淋巴结转移、性别、年龄、肿瘤大小、饮酒史和吸烟史等临床资料进行相关性分析,结果显示与上述临床资料无明显相关性,这可能与课题组收集样本过少和随访时间较短有关,需要继续收集病例和不断随访。另外,PLAU和AKT1单独不能影响OSCC的发展和分化,需和其他分子一起作用,这可以做进一步研究探索。Kaplan-Meier法对患者生存分析显示PLAU和AKT1高表达组的术后生存时间明显短于低表达组,证明了PLAU和AKT1可以用来判断OSCC患者预后。
课题组还研究了OSCC中PLAU和AKT1之间的关系。PI3K/AKT信号通路参与肿瘤生长和血管生成,并能反映肿瘤的恶性程度[12]。此外,有研究[13]表明PLAU可通过调节PI3K/AKT信号通路促进血管内皮细胞生成。这些表明PI3K/AKT通路与PLAU存在相关性。与报道一致,课题组发现在OSCC中PLAU和AKT1之间存在显著关联。这些结果提示PLAU和AKT1共同促进了OSCC的发生,PLAU和PI3K/AKT信号通路在OSCC中存在着某种联系。
为了提高本研究的可信度,使用生物信息学数据库对PLAU和AKT1在OSCC和正常组织的差异性表达进行验证,在OSCC中,PLAU和AKT1表达明显升高,且高表达PLAU和AKT1患者生存时间明显缩短,PLAU和AKT1在OSCC和正常组织中相关性分析进行验证,生物信息学数据库验证结果与实验结果一致,提示着PLAU和AKT1在OSCC中具有潜在的研究价值。
