梅花草提取物对幽门螺杆菌小鼠胃黏膜定植的影响及其机制
2022-10-18王儒帅王朝阳何占彪田复明王睿君
金 昭,王儒帅,王朝阳,何占彪,田复明,王睿君
(1.内蒙古医科大学附属医院影像诊断科,内蒙古 呼和浩特 010050;2.内蒙古医科大学附属医院胃肠外科,内蒙古 呼和浩特 010050;3.内蒙古医科大学附属医院神经外科 内蒙古自治区神经系统疾病临床医学研究中心,内蒙古 呼和浩特 010050)
在我国,幽门螺杆菌(Helicobacter pylori,Hp)感染率始终居高不下,其为引发慢性胃炎、消化性溃疡、胃癌和胃黏膜淋巴瘤的主要原因。Hp为Ⅰ类致癌因子,与多种消化道疾病有密切关联,同时其致病机理复杂而多样,其感染引发胃黏膜病变的机制主要包括Hp的黏附定植、毒力因子的释放和引发免疫炎症反应[1-3]。蒙药梅花草(Parnassia palustris Linn)(乌力地格)系虎耳草科梅花属植物梅花草的干燥花朵,为蒙古族历代和民间常用的特色蒙药,其味甘、苦,无明显毒性,具有破痞去滞、抑协日(清热解毒)等功效。目前,关于梅花草对Hp作用的相关研究尚未见报道。本研究探讨梅花草作为一种潜在应用于Hp根除和胃黏膜保护的蒙药在体内外的抑菌消炎和黏膜保护作用,为其临床应用提供实验依据。
1 材料与方法
1.1 实验动物、菌株、药物、主要试剂和仪器117只6周龄雄性昆明小鼠,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006,实验动物使用许可证号:SYXK(京)2017-0033。Hp菌株(Hp SS1)由北京大学第一医院消化内科实验室保存并惠赠。梅花草采集于内蒙古自治区赤峰市赛汗乌拉地区,采集后将整株药品置于室内自然阴干。经内蒙古医科大学蒙医药学院蒙药鉴定教研室伊丽娜教授鉴定为虎耳草科梅花草属植物梅花草,委托内蒙古医科大学药学院制剂室处理制备用于实验。
Hp抗 体(MA5-36068)(美 国Invitrogen公司),白细胞介素2(interleukin-2,IL-2)(北京达科为生物技术股份有限公司),白细胞介素8(interleukin-8,IL-8)(上海烜雅生物科技有限公司),肿 瘤 坏 死 因 子α(tumor necrosis factor-α,TNF-α)(英国Abcam公司),雷贝拉唑钠肠溶片[卫材(中国)药业有限公司,规格10 mg×7粒]、克拉霉素片(上海雅培制药有限公司,规格250 mg×8粒),阿莫西林胶囊(珠海联邦制药公司,规格500 mg×48粒),胶体果胶铋胶囊(山西安特生物制药有限公司,规格100 mg×48粒),尿素酶(上海惠泰医疗科技公司),RNA prep pure Cell/Bacteria Kit(北京天根生化科技有限公司),cDNA合成试剂盒(SYBR@primeScriptTMRTPCR Kit)(上海爱必信生物科技有限公司),HE染色试剂盒(C0105S)(上海碧云天生物技术有限公司),免疫组织化学试剂盒(深圳达盟生物科技有限公司)。
透射电镜(Tecnai G2 20 S-TWIN)(美国FEI公司),ZN-1000A高速万能粉碎机(中南制药机械厂),Bruker AVAIVCEm-500型核磁共振波谱仪(北京布鲁克科技有限公司),液相色谱仪(LC-20A)(日本岛津公司),超纯水机(GYJ1/2-40L-S)(重庆华创责任有限公司),旋转蒸发仪(德国Heidolph公司),电热套(98-1B型)(天津市秦斯特仪器有限公司),超声波清洗器(KQ-100型)(江苏省昆山市超声仪器有限公司),循环水式多用真空泵(SHZ-DⅢ)(郑州长城仪器有限公司),1 100高效液相色谱议(美国Agilent公司),电子分析天平(AB135-S)(瑞士梅特勒托利多公司),SG1200H超声波清洗器(上海冠特超声仪器厂),DL-1溶剂过滤器(天津市东康科技有限公司)。
1.2 梅花草提取物制备梅花草水提物:称取30 g干燥梅花草,打粉机粉碎后,注入200 mL去离子水,于95℃水浴中浸提1 h后过滤,过滤后60℃减压浓缩并量取浓缩液。浓缩液在75℃烘箱中烘干备用,作为梅花草水提物,水提物使用0.22 μm滤器除菌,备用。梅花草乙醇提取物:采用95%乙醇对梅花草加热回流提取时,梅花草与乙醇的料液比为30 g∶150 mL,加热温度为95℃,每次提取4 h,共提取3次,合并3次所得的提取液为梅花草乙醇提取物。将上述梅花草乙醇提取物于喷雾干燥塔内干燥,喷雾干燥塔进风温度为120℃~150℃,出 风 温 度 为90℃~95℃,雾 化 频 率为220~300 Hz,加料频率为4.0~6.5 Hz,引风频率为20~50 Hz,可较好保留梅花草固有的芳香物质和热敏活性成分。梅花草提取物:梅花草乙醇提取物与梅花草水提物等质量混合,用于后期实验。
1.3 Hp菌株培养采用微需氧培养法,气体达到微需氧条件(85%氮气,10%二氧化碳,5%氧气)。Hp SS1菌株接种于含7%马血清固体平板上,每100 mL固体Hp培养基中添加1 mL微生物添加剂,37℃恒温培养48 h,经快速尿素酶试验(rapid urease test,RUT)、涂片革兰染色和触酶鉴定为阳性后,于上述条件下传代增菌,接种至脑心浸液中,比浊法调整菌悬浊液浓度为4麦氏浊度,即12×108CFU·mL-1,所得菌株浓度为本研究灌胃所用的实验浓度。
1.4 琼脂稀释法测定最小抑菌浓度(minimal inhibitory concentration,MIC)采用琼脂稀释法测定梅花草提取物的MIC。刮取培养48~72 h的Hp接种于液体培养基中,采用无菌生理盐水将其稀释至1.5×108CFU·mL-1。滴加200 μL菌液于培养基表面,涂布棒均匀接种于含有不同浓度(1.25、2.50、5.00、10.00,20.00和40.00 g·L-1)梅花草提取物的平板上,37℃微需氧培养72 h后观察,以未检测出Hp生长的最低药物浓度为MIC。MIC测定根据美国临床实验室标准化委员会(NCCLS)标准判读结果。
1.5 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测Hp定植黏附相关基因mRNA表达水平采用纯水溶解梅花草水提物至终浓度为20 g·L-1。将培养的Hp菌液用PBS缓冲液重悬至1×107CFU·mL-1,取0.1 mL Hp PBS混悬液加入配好的梅花草溶液中,37℃震荡微氧孵育24 h,离心弃上清,采用PBS缓冲液冲洗3次后,采用RNA prep pure Cell/Bacteria Kit分离总RNA。cDNA合成按试剂盒操作说明。引物序 列 见 表1。PCR反 应 体 系:cDNA 2 μL,UltraSYBR mixture 25 μL,10 μmol·L-1上 下 游 引物各1 μL,以去离子水补足至50 μL。反应条件:95℃、10 min;95℃、10 s,60℃、1 min,40个循环。采用2-△△Ct法计算目的基因mRNA表达水平。

表1 Hp定植相关基因引物序列Tab.1 Primer sequences of genes related to Hp colonization
1.6 小鼠体内Hp定植模型设计和干预93只小鼠用于造模,隔1 d灌胃1次,灌胃前禁食12 h,禁水0.5 h,以200 μL浓度为12×108CFU·mL-1Hp活菌,共灌胃6次;生理盐水组12只,等量灭菌生理盐水灌胃,隔1 d灌胃1次,每次200 μL,共灌胃6次;空白对照组12只,自然饲养,无任何干预。
在接种Hp 4周后,随机处死3只小鼠,行RUT快速判断Hp的感染情况,分析整体感染率;将剩余90只感染小鼠分为6组,分别为Hp组、三联组、四联组、梅花草组、三联+梅花草组和四联+梅花草组,每组15只。药物干预参照临床标准和成人与昆明小鼠体质量换算,包括雷贝拉唑0.02 mg·d-1、阿 莫 西 林1 mg·d-1和 克 拉 霉 素0.5 mg·d-1的三联疗法和四联疗法(外加胶体果胶铋0.3 mg·d-1),梅花草提取物灌胃20 mg·d-1,每天禁食禁水12 h后灌胃给药200 μL,给药后30 min给水进食。连续灌胃5 d。停药后第2天,对小鼠实施安乐死,留取血清和胃组织进行相关检测。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测各组小鼠血清中IL-2、IL-8和TNF-α水平。
Hp感染率检测:对小鼠连续灌胃Hp 5 d,感染4周后,随机选取3只,采用颈椎脱位法处死,解剖小鼠,沿幽门-贲门线由胃大弯侧将胃剪开,参照桐城会议共识[4],均为Hp阳性,计算Hp感染率。Hp感染率=HP检测阳性小鼠数/处死小鼠数×100%。感染率>85%即可满足实验要求。
Hp根除率检测:在上述药物治疗后的第2天,各组处死3只小鼠,检测感染情况,计算Hp根除率。Hp根除率=(Hp组感染率-治疗组感染率)/Hp组感染率×100%。
1.7 透射电镜观察各组小鼠胃黏膜上皮组织超微结构将各组小鼠胃黏膜组织于2.5%磷酸盐缓冲液-戊二醛(pH=7.4)和4℃预冷的1%四氧化锇固定后迅速嵌入环氧树脂中,制备超薄切片,乙酸铀酰和柠檬酸铅染色,采用透射电镜观察小鼠胃黏膜上皮超微结构。
1.8 HE染色和免疫组织化学染色观察各组小鼠胃黏膜组织病理形态表现及Hp感染情况按照HE染色试剂盒说明书进行HE染色,光学显微镜下观察各组小鼠胃黏膜组织病理形态表现。Hp免疫组织化学染色采用En vision法,Hp菌体阳性着色为黄色。
1.9 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组小鼠Hp定植黏附相关基因mRNA表达水平和小鼠血清中炎症因子水平均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验;Hp感染率和Hp根除率以百分率(%)表示,组间比较采用Fisher精确检验法。以P<0.05为差异有统计学意义。
2 结 果
2.1 梅花草的MIC琼脂稀释法测定MIC结果显示:于10和20 g·L-1梅花草含药平板中均未检测出Hp,即10 g·L-1为梅花草的MIC值。
2.2 Hp中定植黏附相关基因mRNA表达水平与Hp组比较,梅花草组Hp中Bab A、Cag A和Vac A mRNA表达水平降低(P<0.05或P<0.01)。见表2。
表2 Hp定植黏附相关基因mRNA表达水平Tab.2 Expression levels of Hp colonization-and adhesionrelated gene mRNA (n=15,±s)

表2 Hp定植黏附相关基因mRNA表达水平Tab.2 Expression levels of Hp colonization-and adhesionrelated gene mRNA (n=15,±s)
*P<0.05,**P<0.01 vs Hp group.
Group Hp Parnassia palustris Linn Bab A 15.6±0.61 5.93±2.21*Cag A 35.2±2.46 8.50±3.65**Vac A 22.4±0.92 8.14±3.37**
2.3 2组小鼠胃黏膜大体表现和免疫组织化学染色情况大体观察,Hp组小鼠可见部分胃黏膜糜烂和溃疡,出血和充血明显,见图1A;梅花草组小鼠胃黏膜表面光滑,未见糜烂、出血和溃疡,胃体和胃窦部腺体完整,无萎缩及上皮瘤内变,见图1B。免疫组织化学染色,Hp组小鼠胃黏膜上皮细胞表面定植Hp,为棕褐点棒状或杆状颗粒;梅花草组小鼠胃黏膜上皮细胞表面无Hp定植,Hp感染为阴性。见图1C和D。

图1 2组小鼠胃黏膜大体和组织病理形态表现Fig.1 Gross morphology and pathomorphology of gastric mucosa tissue of mice in two groups
2.4 各组小鼠Hp感染率和根除率RUT检测结果显示:与Hp组比较,梅花草组小鼠Hp感染率降低(P<0.05);与Hp组比较,三联组和四联组小鼠Hp感染率也均有不同程度的降低(P<0.05)。梅花草组小鼠Hp根除率与三联组或四联组比较差异无统计学意义(P>0.05)。与三联组比较,三联+梅花草组小鼠Hp根除率升高(P<0.01);与四联组比较,四联+梅花草组小鼠Hp根除率升高(P<0.01)。见表3。

表3 各组小鼠胃黏膜的RUT结果Tab.3 Results of RUT of gastric mucosa of mice in various groups (n=3,η/%)
2.5 各组小鼠胃黏膜组织病理形态表现和超微结构空白对照组小鼠胃黏膜结构清晰。Hp组可见小鼠胃黏膜脱落、糜烂,黏膜层变薄,结构不完整,有炎性细胞浸润。三联组和四联组小鼠胃黏膜组织病理变化有一定改善。梅花草组小鼠胃黏膜组织厚度增加,三联+梅花草组和四联+梅花草组小鼠胃黏膜组织厚度明显增加。见图2。
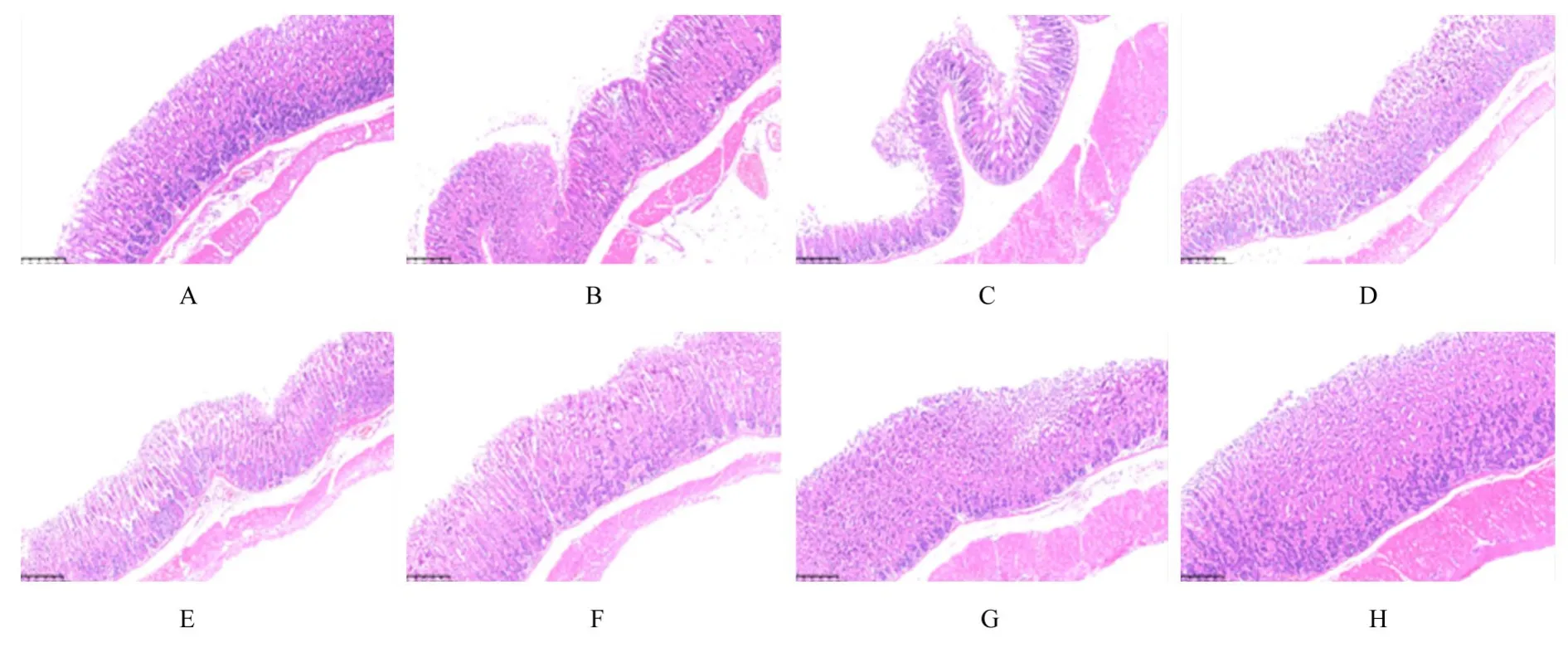
图2 各组小鼠胃黏膜组织病理形态表现(HE,×200)Fig.2 Pathomorphology of gastric mucosa tissue of mice in various groups(HE,×200)
透射电镜观察:空白对照组小鼠胃黏膜上皮细胞中线粒体结构完整,内嵴清晰;Hp组小鼠胃黏膜上皮细胞中线粒体结构破裂,内嵴紊乱;三联组和四联组小鼠胃黏膜上皮细胞中线粒体结构在一定程度上修复,梅花草组小鼠胃黏膜上皮细胞中线粒体结构得到改善,三联+梅花草组和四联+梅花组小鼠胃黏膜上皮细胞中线粒体功能得到有效保护。见图3。空白对照组小鼠胃黏膜上皮细胞微绒毛排列整齐,结构较长;Hp组小鼠胃黏膜上皮细胞微绒毛断裂且消失;三联组和四联组小鼠胃黏膜上皮细胞微绒毛损伤均不同程度恢复;梅花草组小鼠胃黏膜上皮细胞微绒毛结构恢复较好,三联+梅花草组和四联+梅花组小鼠胃黏膜上皮细胞微绒毛结构整体较好。见图4。
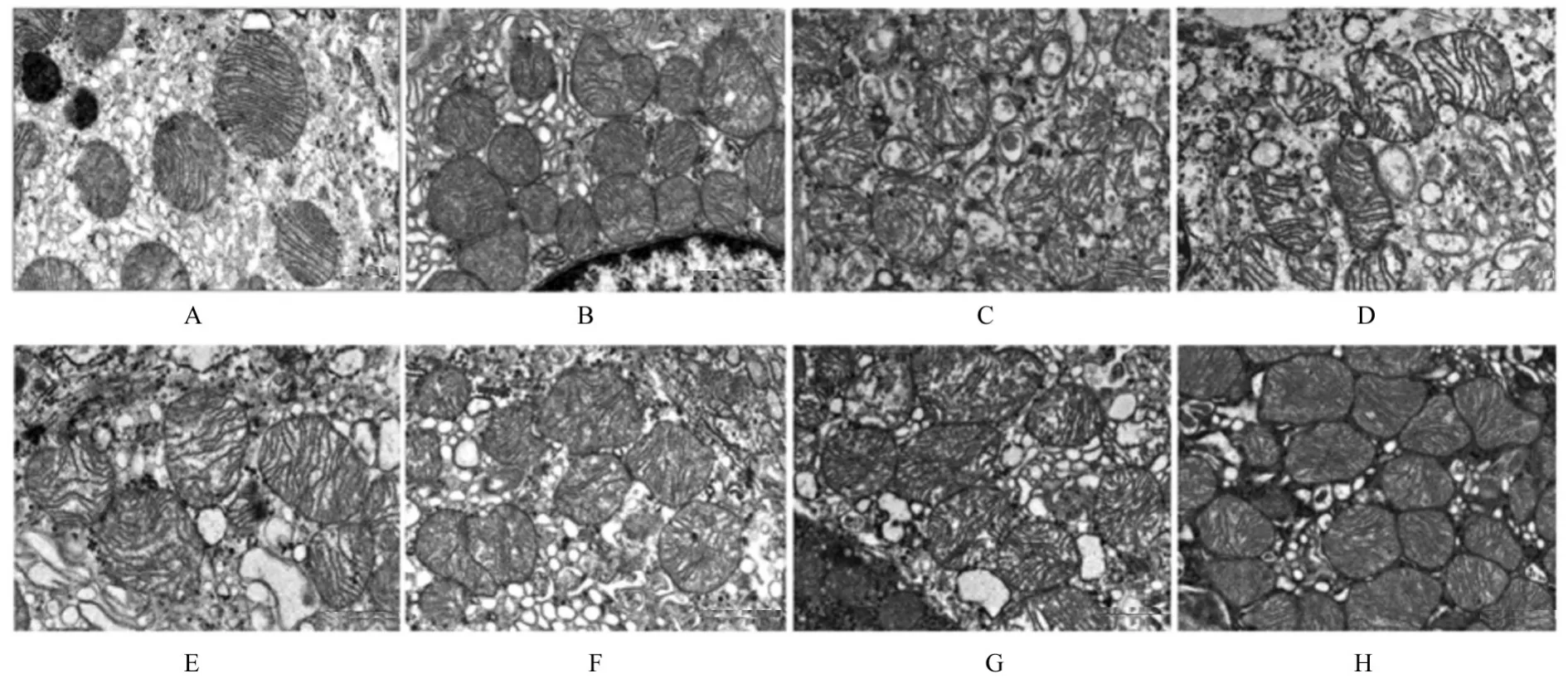
图3 各组小鼠胃黏膜上皮细胞中线粒体结构(×10 000)Fig.3 Mitochondrial structures of gastric mucosal epithelial cells of mice in various groups(×10 000)
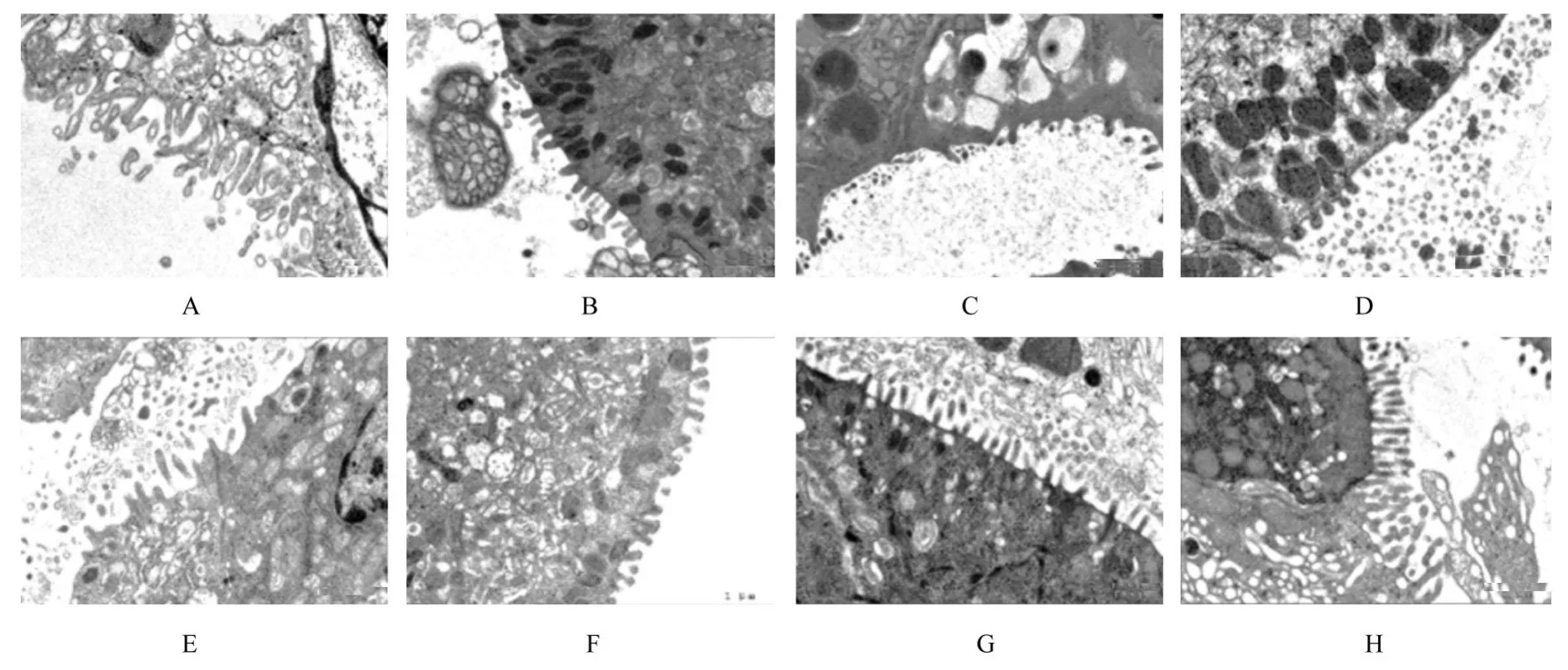
图4 各组小鼠胃黏膜上皮细胞微绒毛结构(×10 000)Fig.4 Microvilli structures of gastric mucosal epithelial cells of mice in various groups(×10 000)
2.6 各组小鼠血清中炎症因子水平与空白对照组和生理盐水组比较,Hp组小鼠血清中IL-2水平降低(P<0.01),IL-8和TNF-α水平均升高(P<0.01);与Hp组比较,三联组、四联组、梅花草组、三联+梅花草组和四联+梅花草组小鼠血清中IL-2水平均升高(P<0.05),IL-8和TNF-α水平降低(P<0.05或P<0.01);与三联组和四联组比较,三联+梅花草组和四联+梅花草组小鼠血清中TNF-α水平明显降低(P<0.01)。见表4。
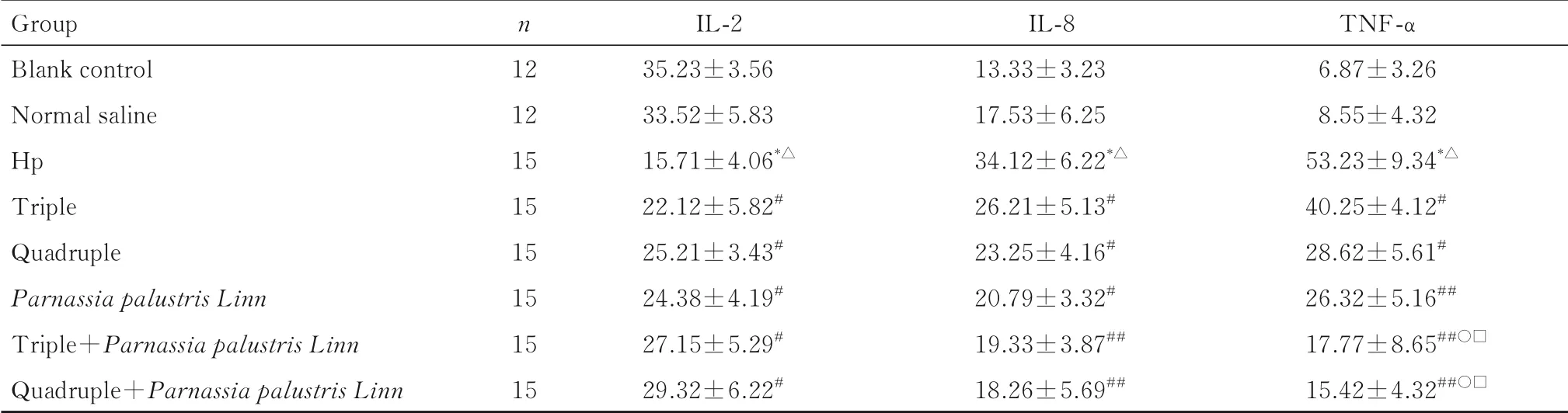
表4 各组小鼠血清中炎症因子水平Tab.4 Levels of inflammatory factors in serum of mice in various groups [x±s,ρB/(ng·L-1)]
3 讨 论
目前临床治疗Hp感染的方法为四联疗法,包括质子泵抑制剂加2种抗生素(如克拉霉素和阿莫西林)与胶体果胶铋组合。近年来随着Hp对抗生素的耐药率不断升高,Hp根除率在不断降低。单纯通过增加抗生素剂量和延长疗程的方法已逐渐暴露出瓶颈,寻求一种安全、高效的抗Hp新药,已成为现在临床亟待解决的问题[5-7]。
梅花草在蒙医临床实践中用于治疗肝血痞、间热痞、内热痞、脉痞、肠协日痞和脏腑协日症,在临床上治疗黄疸型肝炎、咽喉炎、腮腺炎、脉管炎和肺结核等。目前开展了梅花草提取物在多种实体瘤中的抗肿瘤效果评估[8-10],采用常规柱色谱法由梅花草的抗肿瘤活性成分-二氯甲烷和乙酸乙酯萃取物中分离得到11个单体化合物,如槲皮素、绿原酸、山奈酚、金丝桃苷、没食子酸和山奈酚-3-O-β-云香糖苷[10]。上述成分均有不同程度抗炎、抗氧化、抗肿瘤和抗病原微生物的作用,也为梅花草提取物抗Hp的治疗新途经提供了理论依据[11-14]。但其在抗菌消炎和胃黏膜保护中的作用尚未见相关报道。
中西医结合抑制Hp感染的模式在临床中可使患者受益最大化。Hp感染作为病因,基本等同于中医学理论中的“火邪”和“热邪”的概念。有研究[15-16]显示:脾胃湿热证的Hp感染患者与Hp阴性患者比较,其胃黏膜损伤程度明显加重。脾胃湿热证的人群由于湿热邪交阻于中焦,病邪难以祛除,正气日渐虚弱,久而久之滋生虫邪,该病理过程类似于现代医学中Hp定植和侵袭。Hp感染首先通过表达Bab A等外膜蛋白黏附于胃黏膜细胞上,通过表达Vac A和Cag A等蛋白诱发炎症和细胞损伤,进而增加胃黏膜通透性,利于其迁移。Bab A是Hp外膜蛋白基因,可特异性结合宿主细胞受体,赋予Hp持久定植能力;高毒力Hp菌株参与Cag A转运和宿主的炎症反应。Vac A能够破坏细胞内吞作用,抑制免疫细胞,导致免疫耐受和慢性感染。脾胃湿热作为病理基础,易于Hp感染,又可作为病理因素,进一步加剧胃黏膜的炎症反应,因此在治疗中注重除湿清热的中医思路,以观察具有清热除湿作用的梅花草对于Hp体内和体外的治疗效果。
Hp可诱发多种胃部疾病,其机制可能与Hp产生多种酶、破坏黏膜结构、分泌毒素和损伤免疫等有关。临床常采用铋剂四联对Hp感染者进行治疗,但近年来随着Hp耐药性增加,疗效逐渐降低。现阶段联合中医治疗可提高疗效,如传统三联或四联联用荆花胃康、半夏泻心汤和香砂六君子汤等,均呈现了一定的组合优势[17-20]。本研究结果显示:梅花草可协同Hp根除和具有保护胃黏膜的作用,归结为清热解毒之效,可有效提高Hp的根除率。证实梅花草提取物可在体内外有效抑制Hp生长、定植和侵袭能力,保护和修复胃黏膜,降低Hp感染后IL-8和TNF-α水平,保护胃黏膜亚细胞器结构的完整性,如线粒体和微绒毛结构,当联合三联或四联时,Hp根除和胃黏膜修复效果更佳。
综上所述,梅花草提取物可以作为抗Hp治疗的候选药物,配合传统三联或四联疗法,可提高Hp根除效果,同时有效改善胃黏膜的炎症状态,促进黏膜修复,具有潜在的临床转化应用价值。
