黄芪甲苷对低氧诱导小鼠血管损伤的保护作用及其机制
2022-10-18鲁美丽王洪新
王 玥,鲁美丽,王洪新
(锦州医科大学 辽宁省心脑血管药物重点实验室,辽宁 锦州 121001)
健康人在高海拔地区或其他低氧环境中会出现缺氧的状况。人们对低氧的适应能力存在差异,无法迅速适应高海拔低氧可导致肺水肿、中风和心血管功能障碍,甚至死亡[1-4]。因此,对于暴露于高海拔缺氧的正常人和患有心血管系统、呼吸系统及溶血性疾病的患者,缺氧是一种非常危险的状况。而内皮功能障碍和炎症在因缺氧导致血管损伤中发挥重要作用。目前针对适应缺氧分子机制的研究尚不多见,对抗缺氧的策略尚未完全阐明。
骨膜蛋白(periostin,POSTN)是发现于小鼠成骨细胞MC3T3-E1cDNA文库中的特异性表达基因,该cDNA编码由811个氨基酸组成,被指定为骨细胞特异性因子2(osteoblast-specific factor 2,OSF-2),后 更 名 为POSTN[5]。研 究[6]表 明:POSTN可增加上皮-间质转化,并通过激活细胞外调节蛋白激酶 (extracellular regulated protein kinase,ERK)/血 管 内 皮 生 长 因 子(vascular endothelial growth factor,VEGF)信号促进血管生成。缺氧是刺激血管生成的因素之一,在缺氧诱导的肺动脉高压小鼠模型中,肺血管中POSTN表达增加,过表达POSTN使内皮细胞中内皮素1(endothelin-1,ET-1)和VEGF生成增加[7]。核因子κB(nuclear factor-kappa B,NF-κB)广泛存在于体内多种细胞中。研究[8]表明:间歇性缺氧可激活NF-κB。在颞下颌关节骨关节炎软骨中POSTN可 诱 导NF-κB抑 制 因 子α(inhibitory subunit of NF-κB alpha,IκBα)磷 酸 化 及 其 降 解,导致p65核移位。因此推测POSTN/NF-κB可能参与了缺氧引起的血管损伤发病机制。
黄芪甲苷(astragalosideⅣ,ASⅣ)来源于黄芪,是黄芪的主要活性成分之一。ASⅣ具有多种药理作用,具有保护心血管、调节免疫、抗肿瘤、抗氧化、抗炎和抗衰老等功能,其对内皮功能障碍的改善作用也逐渐被证实[9-12],但其具体作用机制尚未完全阐明。本研究探讨ASⅣ对低氧诱导小鼠血管损伤的保护作用,阐明其POSTN/NF-κB信号通路机制。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器健康雄性昆明种小鼠60只,体质量25~35 g,4~6周龄,由锦州医科大学动物实验中心提供,动物使用许可证号:SYXK(辽)2019-007。ASⅣ(纯 度≥98.0%),购自南京景竹生物科技有限公司。去甲肾 上 腺 素 (phenylephrine,PE)和 乙 酰 胆 碱(acetylcholine,Ach)购 自 美 国Sigma-Aldrich公司,BCA蛋白定量试剂盒购自北京鼎国昌盛生物技术有限公司,β-actin、POSTN、磷酸化NF-κB(phosphorylated NF-κB,p-NF-κB)p65一 抗、鼠抗兔二抗、细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)和血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)一抗购自武汉爱博泰克生物科技有限公司,NF-κB p65一抗购自沈阳万类生物技术有限公司,免疫组织化学染色试剂盒购自北京中杉金桥生物公司,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自上海酶联生物科技有限公司。低温高速离心机购自美国Thermo Fisher公司,DMT 720M离体微血管张力测定仪购自丹麦Myotechnology公司,凝胶成像仪和半干转印仪购自美国Bio-Rad公司,Leica DMI 3000B倒置显微镜购自德国Leica公司。
1.2 实验动物分组和造模60只昆明种雄性小鼠随机分为对照组、低氧组、低剂量(40 mg·kg-1)ASⅣ组、中剂量(80 mg·kg-1)ASⅣ组和高剂量(120 mg·kg-1)ASⅣ组,每组12只。低氧组和各剂量ASⅣ组小鼠均于低氧舱(氧浓度10%)中饲养,连续4周。ASⅣ采用0.5%羧甲基纤维钠稀释至所需浓度,各剂量ASⅣ组小鼠于低氧第2天灌胃给予相应剂量ASⅣ。其余各组小鼠给予相同容积的羧甲基纤维钠灌胃,造模期间密切观察小鼠的健康状况。
1.3 各组小鼠一般状况观察观察各组小鼠的饮食情况、皮肤状况和是否死亡,若死亡及时取出小鼠并解剖,分析小鼠死因。
1.4 离体血管环实验检测各组小鼠血管张力按照参考文献[13]中的方法,采用无菌20%乌拉坦溶于PBS缓冲液麻醉各组小鼠,无菌环境中取出胸主动脉并迅速置于PSS溶液中,持眼科剪将血管剪为2 mm左右长度。将准备好的血管环固定于DMT浴槽内张力传感器上,检测血管张力变化并记录。浴槽内添加10-5μmol·L-1PE,当收缩达平台时,依次累计添加不同浓度(10-5、10-6、10-7、10-8和10-9μmol·L-1)Ach建立剂量反应曲线,计算Ach最大舒张率,作为血管张力变化评估依据。
1.5 ELISA法检测各组小鼠血清中白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平小鼠眼眶取血,3 600 r·min-1离心5 min,吸取上清,-80℃保存。按照ELISA试剂盒说明书检测各组小鼠血清中IL-6和TNF-α水平。
1.6 免疫组织化学法检测各组小鼠胸主动脉组织中POSTN阳性细胞率小鼠胸主动脉组织切片预热约2 h,二甲苯脱蜡,梯度乙醇复水,抗原修复,3%过氧化氢室温氧化15 min,PBS缓冲液漂洗3次,每次4 min,山羊血清常温封闭10 min后滴加POSTN一抗(1∶100),冰箱4℃过夜,PBS缓冲液漂洗3次,每次4 min,滴加二抗(1∶200)于37℃水浴30 min,PBS缓冲液漂洗3次,每次4 min,DAB显色,苏木素复染,脱水,透明,封片。光学显微镜下观察胸主动脉组织中阳性染色区域,采用Image J软件计算POSTN阳性细胞率。
1.7 Western blotting法检测各组小鼠胸主动脉组织中POSTN、ICAM-1、VCAM-1和p-NF-κB p65蛋白表达水平取约50 mg小鼠胸主动脉组织,加入RIPA+1%PMSF裂解液裂解,于冰上剪碎,超声粉碎30 s,4℃离心机静置30 min,12 000 r·min-1离心20 min,取上清,采用BCA法测定蛋白浓度。聚丙烯酰胺凝胶电泳,杂交转膜后将PVDF膜置于含5%脱脂奶粉TBST溶液封闭1.5 h,分别加入ICAM-1(1∶800)、VCAM-1(1∶1 000)、POSTN(1∶1 000)、p-NF-κB p65(1∶800)、NF-κB p65(1∶800)和β-actin抗体(1∶1 000),4℃孵育过夜,TBST洗膜3次,每次5 min,加入二抗,室温孵育1 h,TBST洗膜3次,每次5 min,ECL显色液显影,以β-actin为内参,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 统计学分析采用SPSS 26.0统计软件进行统计学分析。各组小鼠Ach最大舒张率,血清中IL-6和TNF-α水 平,胸 主 动 脉 组 织 中ICAM-1、VCAM-1、POSTN和p-NF-κB p65蛋 白 表 达 水 平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠Ach最大舒张率与对照组比较,低氧组小鼠Ach最大舒张率明显降低(P<0.01);与低氧组比较,低剂量ASⅣ组小鼠Ach最大舒张率差异无统计学意义(P>0.05),中和高剂量ASⅣ组小鼠Ach最大舒张率明显升高(P<0.01)。见图1。

图1 各组小鼠血管张力Fig.1 Vascular tension of mice in various groups
2.2 各组小鼠血清中IL-6和TNF-α水平与对照组比较,低氧组小鼠血清中IL-6和TNF-α水平明显升高(P<0.01);与低氧组比较,低、中和高剂量ASⅣ组小鼠血清中IL-6和TNF-α水平明显降低(P<0.05或P<0.01)。见表1。
表1 各组小鼠血清中IL-6和TNF-α水平Tab.1 Levels of IL-6 and TNF-α in serum of mice in various groups [n=6,±s,ρB/(ng·L-1)]
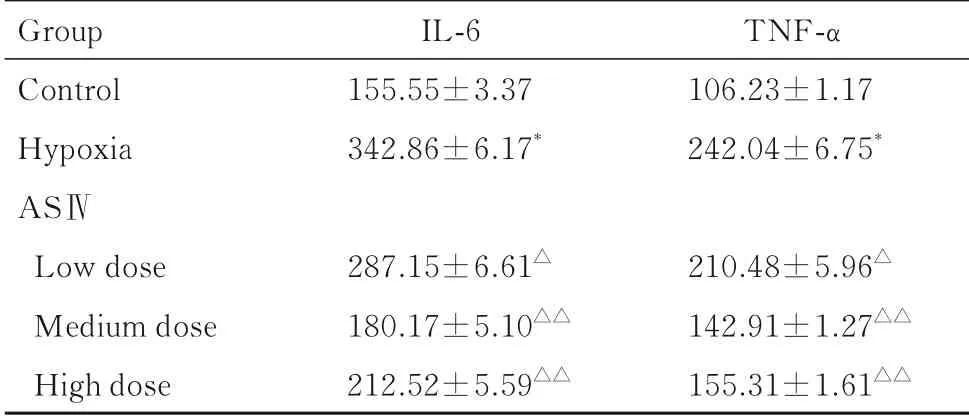
表1 各组小鼠血清中IL-6和TNF-α水平Tab.1 Levels of IL-6 and TNF-α in serum of mice in various groups [n=6,±s,ρB/(ng·L-1)]
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with hypoxia group.
Group Control Hypoxia ASⅣLow dose Medium dose High dose IL-6 155.55±3.37 342.86±6.17*287.15±6.61△180.17±5.10△△212.52±5.59△△TNF-α 106.23±1.17 242.04±6.75*210.48±5.96△142.91±1.27△△155.31±1.61△△
2.3 各组小鼠胸主动脉组织中POSTN阳性细胞率对照组小鼠胸主动脉组织中POSTN阳性细胞率极低;与对照组比较,低氧组小鼠胸主动脉组织中POSTN阳性细胞率明显升高(P<0.01);与低氧组比较,低剂量ASⅣ组小鼠胸主动脉组织中POSTN阳性细胞率差异无统计学意义(P>0.05),中和高剂量ASⅣ组小鼠胸主动脉组织中POSTN阳性细胞率明显降低(P<0.01)。见图2和3。

图2 各组小鼠胸主动脉组织中POSTN表达情况(免疫组织化学,×400)Fig.2 Expressions of POSTN in aorta tissue of mice in various groups(Immunohistochemistry,×400)
2.4 各组小鼠胸主动脉组织中POSTN蛋白表达水平与对照组比较,低氧组小鼠胸主动脉组织中POSTN蛋白表达水平明显升高(P<0.01);与低氧组比较,低剂量ASⅣ组小鼠胸主动脉组织中POSTN蛋白表达水平差异无统计学意义(P>0.05),中和高剂量ASⅣ组小鼠胸主动脉组织中POSTN蛋白表达水平明显降低(P<0.01)。见图4。
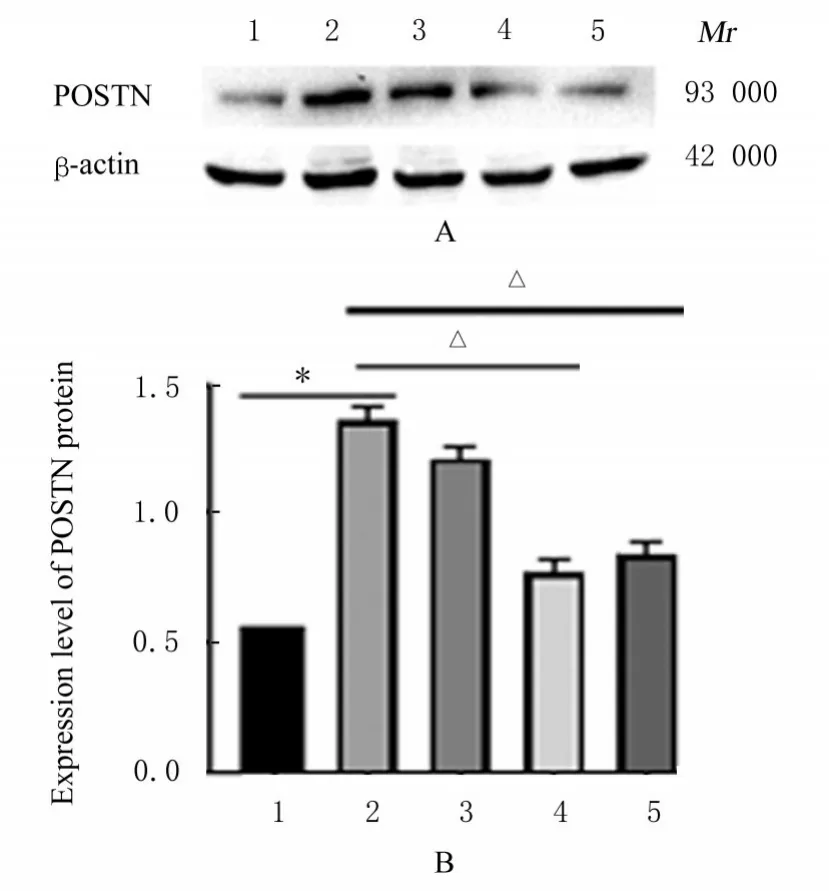
图4 各组小鼠胸主动脉组织中POSTN蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram(A)and histogram(B)of expressions of POSTN protein in aorta tissue of mice in various groups
2.5 各组小鼠胸主动脉组织中ICAM-1和VCAM-1蛋白表达水平与对照组比较,低氧组小鼠胸主动脉组织中ICAM-1和VCAM-1蛋白表达水平明显升高(P<0.01);与低氧组比较,低剂量ASⅣ组小鼠胸主动脉组织中ICAM-1和VCAM-1蛋白表达水平差异无统计学意义(P>0.05),中和高剂量ASⅣ组小鼠胸主动脉组织中ICAM-1和VCAM-1蛋白表达水平明显降低(P<0.01)。见图5。
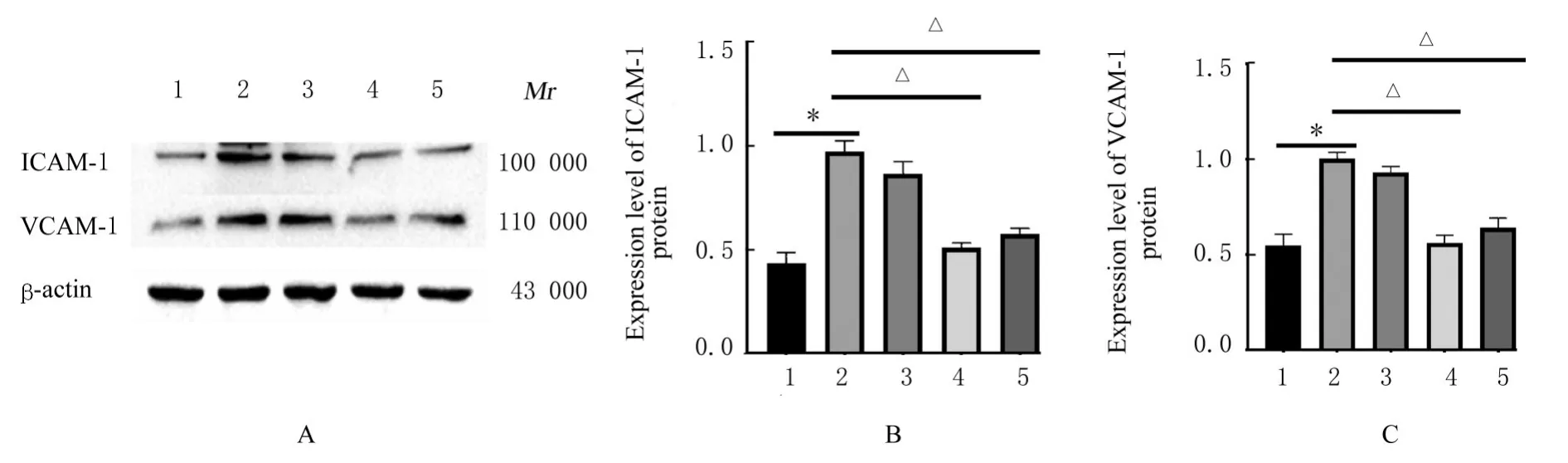
图5 各组小鼠胸主动脉组织中ICAM1和VCAM1蛋白表达电泳图(A)和直条图(B,C)Fig.5 Electrophoregram(A)and histogram(B,C)of expressions of ICAM1 and VCAM1 proteins in aorta tissue of mice in various groups
2.6 各组小鼠胸主动脉组织中p-NF-κB p65蛋白表达水平与对照组比较,低氧组小鼠胸主动脉组织中p-NF-κB p65蛋白表达水平明显升高(P<0.01);与低氧组比较,低剂量ASⅣ组小鼠胸主动脉组织中p-NF-κB p65蛋白表达水平差异无统计学意义(P>0.05),中和高剂量ASⅣ组小鼠胸主动脉组织中p-NF-κB p65蛋白表达水平明显降低(P<0.01)。见图6。
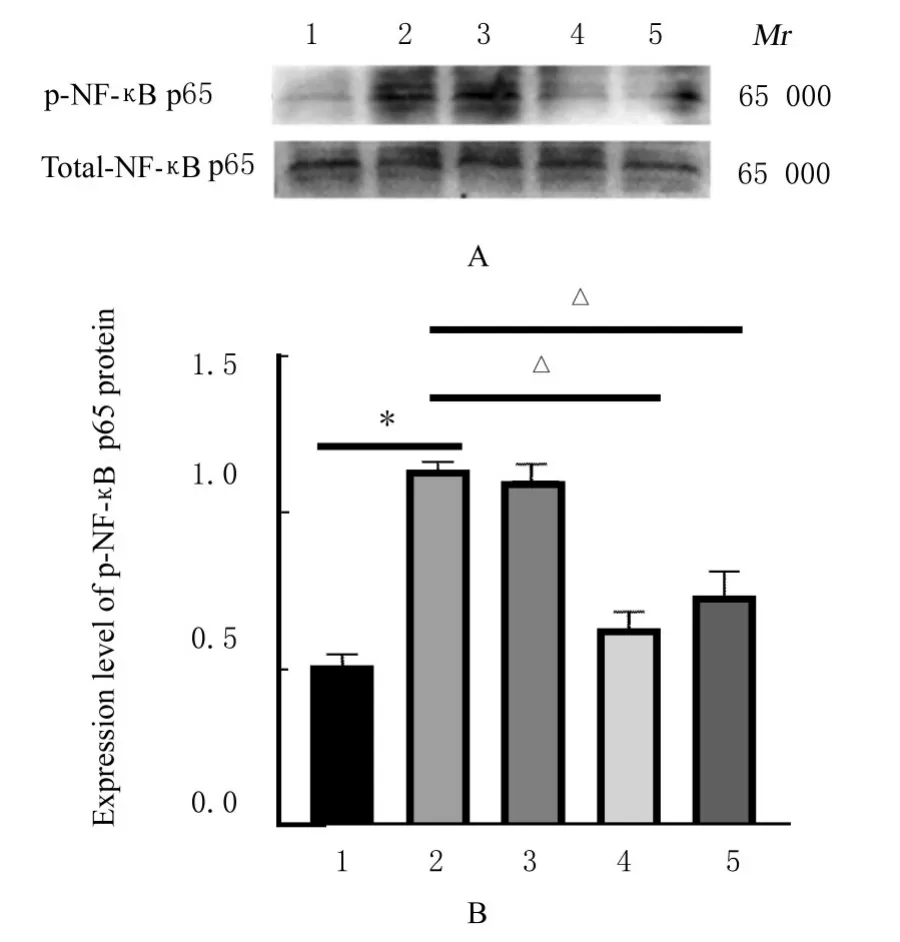
图6 各组小鼠胸主动脉组织中p-NF-κB p65蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram(A)and histogram(B)of expressions of p-NF-κB p65 protein in aorta tissue of mice in various groups
3 讨 论
血管内皮组织在维持心血管稳态中起着关键作用,可生成并分泌多种物质,其中一氧化氮(nitricoxide,NO)用于调节血管张力和结构。在缺氧刺激下,由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)磷酸化改变引起的eNOS活性降低可导致NO生物利用度受损,使血管发生内皮功能障碍[14-16]。本课题组近期研究[13,17]证实:ASⅣ对血管损伤有一定保护作用,但其具体机制尚未完全阐明。本研究结果显示:与低氧组比较,中和高剂量ASⅣ组小鼠Ach最大舒张率明显升高,中和高剂量ASⅣ组小鼠胸主动脉组织中ICAM-1和VCAM-1蛋白表达水平降低,提示ASⅣ对低氧诱导小鼠血管内皮功能障碍有保护作用;同时,经ASⅣ治疗后,小鼠血清中IL-6和TNF-α水平明显降低,表明ASⅣ具有潜在的抗炎作用。
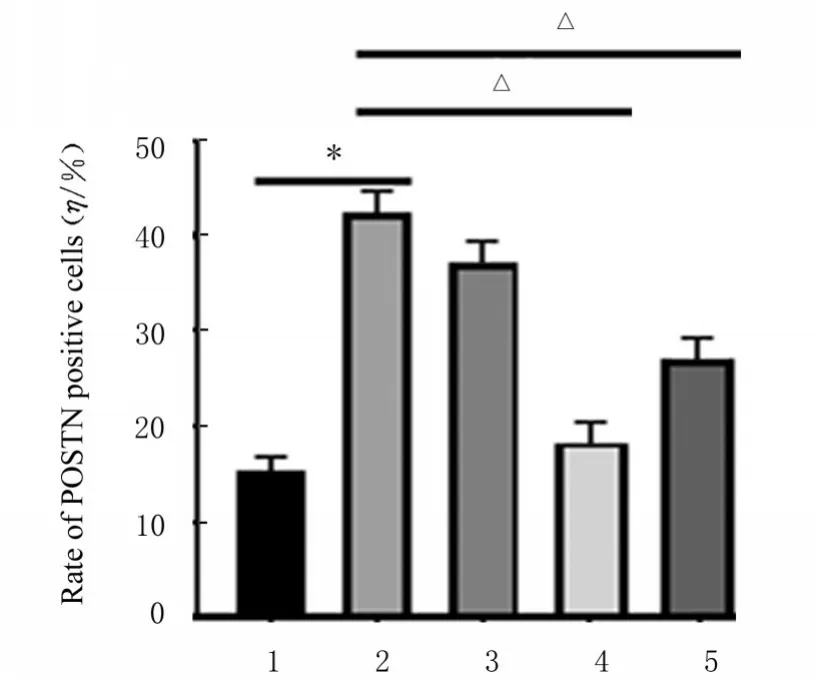
图3 各组小鼠胸主动脉组织中POSTN阳性细胞率Fig.3 Rates of POSTN positive cells in aorta tissue of mice in various groups
POSTN可以促进肿瘤转移时血管生成,促进肿瘤细胞在远处组织定植后的生存和增殖[18]。POSTN由细胞黏附分子整合素αvβ3和αvβ5分泌并传递信号[19-20]。POSTN诱导血管生成,通过血管内皮细胞整合素信号通路上调血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,FLK-1/KDR)。VEGF和FLK-1/KDR也被证实参与实体肿瘤发展过程中血管生成的诱导[21]。血管内皮通透性的改变发生在动物模型和人的肺动脉高压发病的早期。研究[7]显示:过表达POSTN影响内皮细胞存活和血管生成能力。在缺氧条件下,血管内皮细胞核中累积的POSTN导致血管内皮细胞功能障碍,而胞质中分泌的POSTN进入肺动脉平滑肌细胞(pulmonary vascular smooth muscle cells,PASMCs)外间隙可能促进PASMCs增殖和迁移进而诱导血管重构。最近研究[7,22]显示:缺氧诱导的PAH模型大鼠发生缺氧应激后,肺组织和分离PASMCs中POSTN表达水平升高,且重组POSTN升高了大鼠右心室成纤维细胞中细胞外调节蛋白激酶1/2(extracelluar regulated protein kinase 1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和NF-κB磷 酸 化 水 平。本研究结果显示:与低氧组比较,中和高剂量ASⅣ组小鼠胸主动脉组织中POSTN和p-NF-κB p65蛋白表达水平降低,表明ASⅣ对低氧诱导血管损伤模型小鼠的保护作用与POSTN/NF-κB信号通路有关。本研究尚未证实POSTN与p-NF-κB p65之间的关系,这也是本研究的不足之处,后续会进行更深一步研究验证。
综上所述,ASⅣ会改善低氧诱导的小鼠血管内皮功能障碍和炎症反应,其潜在分子机制可能与抑制POSTN/NF-κB信号通路有关。本研究结果为ASⅣ在血管损伤等心血管疾病中的临床应用提供了理论依据。
