基于血清代谢组学研究牛蒡苷元对大鼠脑缺血-再灌注损伤的保护作用及其分子机制
2022-10-18王文杰徐珊珊徐煜彬
王文杰,舒 升,徐珊珊,徐煜彬
(1.浙江省台州市中心医院 台州学院附属医院神经内科,浙江 台州 318000;2.浙江省台州市中心医院 台州学院附属医院科研处,浙江 台州 318000;3.浙江省台州市中心医院 台州学院附属医院药剂科,浙江 台州 318000)
脑卒中是由脑血管闭塞导致流向脑组织血流量减少而引起,是严重危害人类健康的常见病之一,具有发病率高、死亡率高、致残率高和复发率高的特点,是全球可预防性死亡的第二大原因和长期致残的第三大原因,减少脑缺血-再灌注损伤是治疗脑卒中的关键[1-4]。本课题组前期研究[5]显示:菊科草本植物牛蒡重要药理活性成分牛蒡苷元(100 mg·kg-1)可以通过改善脑缺血-再灌注损伤模型大鼠脑局灶性缺血,提高缺血半暗带脑组织中超氧化物歧化酶(superoxide dismutase,SOD)活性,抑制丙二醛(malondialdehyde,MDA)、乳酸脱氢酶(lactate dehydrogenase,LDH)、白细胞介素1β(interleukin-1β,IL-1β)、白 细 胞 介 素6(interleukin-6,IL-6)和 肿 瘤 坏 死 因 子α(tumor necrosis factor-α,TNF-α)释放,发挥抗脑缺血-再灌注损伤作用。然而,关于牛蒡苷元抗脑缺血-再灌注分子代谢机制尚未见研究报道。本研究通过非靶向代谢组学技术对牛蒡苷元抗脑缺血-再灌注损伤大鼠的血清代谢物进行分析,探讨牛蒡苷元抗脑缺血-再灌注损伤的分子机制,为脑缺血-再灌注损伤机制及牛蒡苷元作为脑缺血-再灌注损伤治疗药物的潜在应用研究提供参考依据。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器SD大鼠18只,SPF级,雌性,体质量(300±20)g,购自浙江维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(浙)2019-0001,以常规颗粒饲料喂养,自由饮水,12 h昼夜节律;大鼠购入后在SPF动物房适应性饲养1周。
牛蒡苷元(纯度>98%)(北京索莱宝科技有限公司)。苏木素染液(北京中杉金桥生物技术有限公司),伊红染色液(北京索莱宝科技有限公司),甲醇和乙腈等试剂均为色谱纯。-80℃冰箱(BDF-86V348)(山东博科控股集团有限公司),微型离心机(D1008E)(美国SCJLOGEX公司),旋涡混合器(XH-C)(常州越新仪器制造有限公司),全自动样品快速研磨仪(Tiss-12)(上海净信实业发展有限公司),超高效液相色谱仪(ExionLC)和高分辨质谱仪(Triple TOF 5600)(美国AB SCIEX公司),天平(BSA124S-CW)(德国Sartorius公司)。
1.2 局灶性脑缺血模型的制备和分组处理18只大鼠随机分为假手术组、模型组和牛蒡苷元组,每组6只。牛蒡苷元组大鼠灌胃给予100 mg·kg-1牛蒡苷元,假手术组和模型组大鼠灌胃给予相同剂量的生理盐水,灌胃量为10 mL·kg-1,连续灌胃给药14 d。最后1次给药干预后模型组和牛蒡苷元组大鼠采用改良线栓法造模,造模方法见参考文献[6],假手术组大鼠采用相同方式进行手术,但钓鱼线的插入深度仅为0.5~1.0 cm,不对大鼠造成实质性栓塞。再灌注24 h后,采用戊巴比妥钠对大鼠麻醉,腹主动脉穿刺采集动脉全血5 mL,静置30 min,分离血清,-80℃保存备用,之后迅速于冰面上取出完整大脑组织,分离大脑皮层脑梗死周围半暗带组织,固定于4%多聚甲醛溶液保存待检测。假手术组大鼠取相应部位的脑组织进行检测。造模24 h期间如有大鼠死亡,则取大鼠重新补齐,保证每组6只大鼠。
1.3 大鼠神经功能缺损评分再灌注24 h后,参照Longa评分法[7]对各组大鼠的神经功能缺损进行评分。评分标准如下:正常无症状记为0分;对侧前爪完全伸展记为1分;行走时向对侧转圈记为2分;行走时向对侧倾倒记为3分;不能自主行走,丧失意识记为4分。
1.4 HE染色观察各组大鼠脑组织病理形态表现将固定于4%多聚甲醛溶液的缺血半暗带组织切为2~3 mm厚切片,采用自动脱水机进行脱水后常规石蜡包埋并制作3 μm石蜡切片,干燥后的切片采用二甲苯脱蜡,依次采用100%酒精、90%酒精、80%酒精和蒸馏水进行水化,之后将切片依次用水和酒精洗涤2~3次,采用伊红和苏木素染色,二甲苯透明和封片,采用普通光学显微镜观察大脑皮层脑梗死周围半暗带组织的形态学改变。
1.5 代谢组学分析将血清样品200 μL,加入600 μL乙腈中,涡旋30 s混匀,4℃、12 000 r·min-1离心15 min沉淀蛋白,取上清400 μL,真空干燥;加入200 μL 50%乙腈复溶,4℃、12 000 r·min-1离心15 min,取50 μL上清液于进样瓶中上机检测;所有样品另取10 μL上清混合为质控(quality control,QC)样品上机检测。
通过ExionLC超高效液相色谱仪使用Waters ACQUITY UPLC BEH Amide(2.1×100 mm,1.7 μm)色谱柱对样品进行色谱分离。流动相为含25 mmol·L-1乙 酸 铵 和25 mmol·L-1氨 水 的水(A)和 乙 腈(B)。梯 度 洗 脱 条 件 如 下:0~0.5 min,5% A、95% B;0.5~7.0 min,5%~35% A、95%~65% B;7.0~8.0 min,35%~60% A、65%~40% B;8.0~9.0 min,60% A、40% B;9.0~9.1 min,60%~5% A、40%~95% B;9.1~12.0 min,5% A、95% B。流 动 相 流 速为0.5 mL·min-1,柱温设置为25℃,进样体积为2 μL。
质谱分析在Triple TOF 5 600高分辨质谱仪中进行,采用正离子和负离子模式,通过IDA模式进行高分辨质谱数据采集。每个循环选取12个强度最强且大于100的离子进行二级质谱扫描,碰撞诱导解离的能量为30 eV,循环时间为0.56 s,离子源参数如下:GS1:60 psi;GS2:30 psi;CUR:35 psi;TEM:600℃;DP:60 V;ISVF:5 000 V(Pos)/-4 000(Neg)。
使用ProteoWizard软件将质谱原始数据转为mzXML格式。再使用XCMS做保留时间矫正、峰识别、峰提取、峰积分和峰对齐等工作。同时通过R程序包和二级质谱数据库对峰进行物质鉴定。然后使用Simca v.14.1软件包(瑞典Umetrics公司)导出处理后的数据列表,对数据进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),通过GraphPad Prism 6.0软件对各组之间峰积分的显著差异进行t检验并进行聚类分析,使用MetaboAnalyst 4.0软件对差异代谢物进行代谢通路分析。取各代谢物的平均峰强度作为定量依据。
1.6 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠神经功能缺损评分和血清中代谢物峰强度数据均符合正态分布,以-x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经功能缺损评分与假手术组(0.00分±0.00分)比较,模型组大鼠神经缺损功能评分(2.87分±0.51分)明显升高(P<0.05);与模型组比较,牛蒡苷元组大鼠神经功能缺损评分(1.17分±0.41分)明显降低(P<0.05)。
2.2 各组大鼠脑组织病理形态表现假手术组大鼠脑组织中神经元胞体椭圆,有突起,胞核圆形,核仁清晰,位于细胞中心,细胞质染色为浅蓝色,无明显病理改变。模型组大鼠脑组织中神经元多数呈三角形,固缩红染,部分神经元脱失,组织稀疏,可见少量胶质细胞增生。牛蒡苷元组大鼠缺血半暗带组织中神经元损伤较模型组明显减轻。见图1。
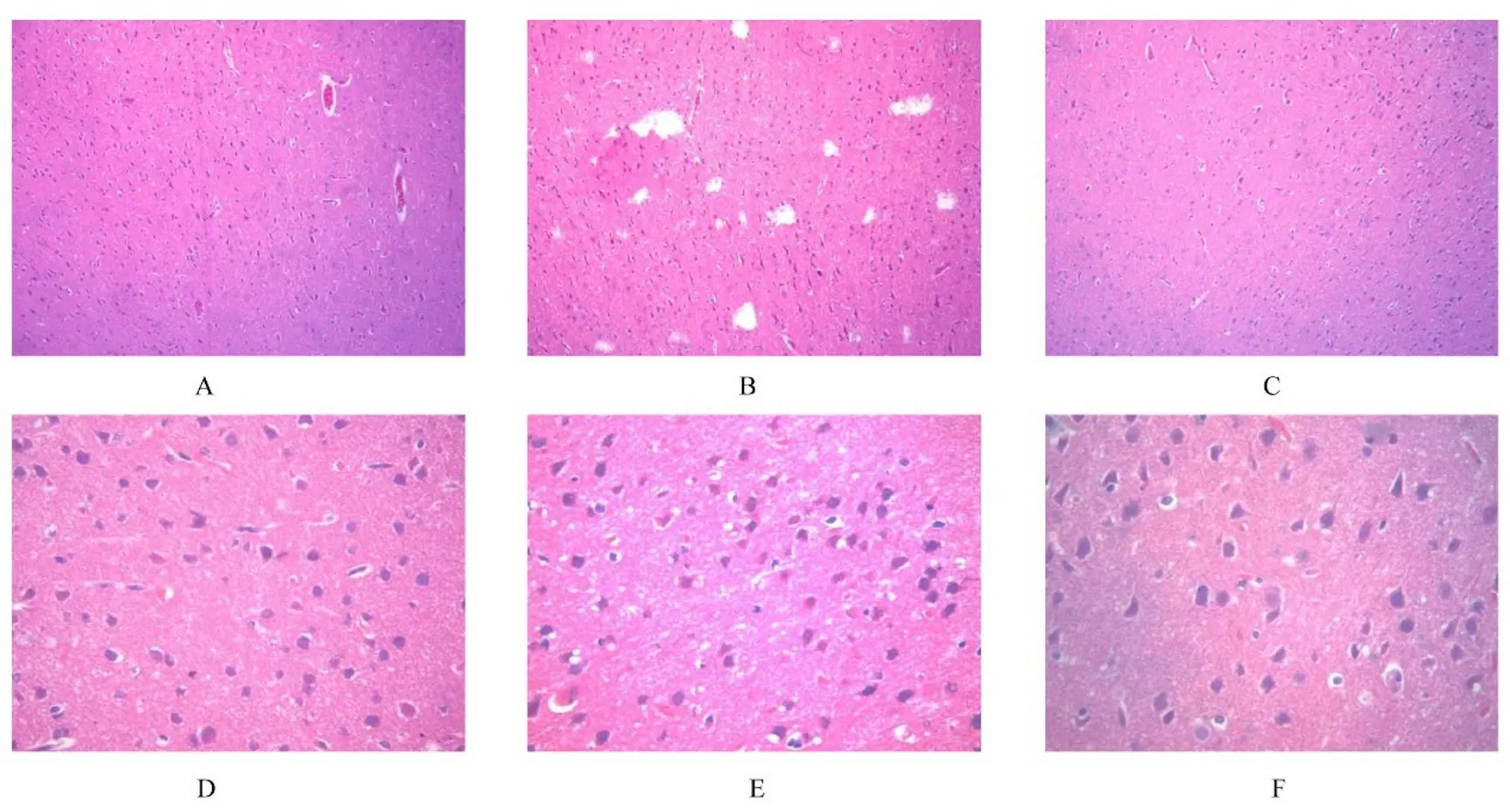
图1 各组大鼠缺血半暗带组织病理形态表现(HE)Fig.1 Pathomorphology of ischemic penumbra tissue of rats in various groups(HE)
2.3 各组大鼠血清PCA对各组大鼠血清代谢组学正离子和负离子模式下代谢物峰强度数据进行PCA,发现3次重复的QC样品紧密地聚合在一起,有良好的稳定性和再现性,证明模型比较可靠。假手术组、模型组和牛蒡苷元组组间数据分离,组内数据紧密靠拢在一起,表明3组间大鼠血清代谢物水平有明显变化。见图2。
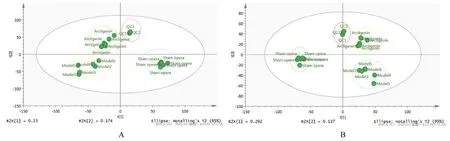
图2 正离子(A)和负离子(B)模式下样品PCAFig.2 PCA of samples in positive(A)and negative(B)ion modes
2.4 各组大鼠OPLS-DA在OPLS-DA中,对于正离子模式,R2X(cum)=0.452,R2Y(cum)=0.994,Q2(cum)=0.900;对于负离子模式,R2X(cum)=0.482,R2Y(cum)=0.988,Q2(cum)=0.909;2种模式下R2Y和Q2均超过0.5,说明该统计模型具有良好的拟合性和预测能力。见图3。

图3 正离子(A)和负离子(B)模式下样品OPLS-DAFig.3 OPLS-DA of samples in positive(A)and negative(B)ion modes
2.5 血清差异代谢物筛选根据OPLS-DA处理后生成的可变重要性阈值(variable importance in the projection,VIP)对代谢物进行筛选,将其设置为VIP>1.2。显著差异代谢物的P值设置为0.05。根据上述标准,本研究通过二级质谱鉴定并选择了26个有显著差异的代谢物进行进一步研究,与假手术组比较,模型组大鼠血清中14个代谢物包括卵磷脂(38∶7)、6-氨基嘧啶-2(1H)-酮盐酸盐、γ-谷氨酰缬氨酸、1-神经酰胺甘油酰磷酸胆碱、磷脂酰丝氨酸(38∶1)、gigantetronenin、辛二酰甘氨酸、双酚酸、4-咪唑酮-5-丙酸、丙氨酰谷氨酰胺、β-D-葡萄糖胺、3,3′,4′,5-四羟基二苯乙烯、1H-嘧啶-2,4二酮和二十二碳六烯酸(docosahexaenoic acid,DHA)等 水 平 明 显 降 低(P<0.05),12个代谢物包括N-A-乙酰-L-精氨酸、N′-羟甲基降烟碱、烟酰胺核苷酸、1,5-二咖啡酰奎宁酸、磷酸肌酐、4-O-咖啡酰莽草酸、丙炔酸、苹果酸、十八碳二酸、乳清酸、2-酮基丙酸和肌肽等水平明显升高(P<0.05);与模型组比较,牛蒡苷元组大鼠血清中26个代谢物变化趋势明显逆转(P<0.05)。见表1。

表1 26个代谢物质谱数据Tab.1 Mass data of 26 metabolites
2.6 差异代谢物聚类分析将上述26个差异代谢物分为正离子模式和负离子模式进行聚类分析,牛蒡苷元组与假手术组颜色评分较为接近,表明牛蒡苷元可以通过调控这26个差异代谢物起到抗脑缺血-再灌注的作用。见图4。

图4 26个差异代谢物聚类分析图Fig.4 Cluster analysis diagram of 26 differential metabolites
2.7 差异代谢物通路分析通过MetaboAnalyst 5.0(https://www.metaboanalyst.ca/)对26个 差 异代谢物进行通路分析,结果显示:上述代谢物参与组氨酸代谢、精氨酸和脯氨酸代谢、三羧酸循环、烟酸和烟酰胺代谢、β-丙氨酸代谢、糖酵解/糖异生和丙酮酸代谢等代谢通路,其中组氨酸代谢(P<0.05)、精氨酸代谢(P<0.05)和脯氨酸代谢(P<0.05)是牛蒡苷元抗脑缺血-再灌注作用的主要通路。见图5。

图5 26个差异代谢物通路分析图Fig.5 Pathway analysis diagram of 26 differential metabolites
3 讨 论
脑缺血-再灌注损伤是脑卒中的一个主要并发症,其病理生理机制存在损伤级联反应,包括炎症损害、氧化应激和兴奋性氨基酸毒性等[8-9]。其中炎症反应、氧化应激是脑缺血-再灌注损伤的主要原因。本研究结果显示:模型组大鼠神经功能缺损评分明显降低,大鼠脑组织神经元损伤明显,结合前期研究[4]结果,模型组大鼠梗死组织呈白色,与假手术组(相应位置呈玫瑰红色)比较,模型组大鼠梗死组织面积明显扩大,表明脑缺血-再灌注损伤模型复制成功;而牛蒡苷元可以明显改善上述症状,表明牛蒡苷元对脑缺血-再灌注损伤具有较好的保护作用。对其保护脑缺血-再灌注损伤分子机制进一步研究显示:牛蒡苷元可以通过调控氨基酸代谢、能量代谢、糖代谢和脂质代谢等减轻脑损伤,发挥神经保护作用。
本研究共发现26个重要的差异代谢物参与牛蒡苷元保护脑缺血-再灌注损伤的分子调控机制,其中DHA(VIP=1.49)最值得关 注。研究[10-13]表明:DHA可以减少缺血性行为障碍、脑梗死、水肿和血脑屏障破坏,对缺血性缺陷具有神经保护和抗炎作用,该作用与DHA能降低氧化应激和c-Jun氨 基 末 端 激 酶(c-Jun N-terminal kinase,JNK)/激活蛋白1(activator protein-1,AP-1)信号及增强核因子红细胞系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)/血红素加氧酶1(heme oxygenase 1,HO-1)表达有关。牛
蒡苷元能明显提升脑缺血-再灌注损伤模型大鼠中DHA水平。其次,牛蒡苷元可以升高3,3′,4′,5-四羟基二苯乙烯(VIP=1.45)水平,3,3′,4′,5-四羟基二苯乙烯是一种抗氧化剂,具有较高的抗氧化活性和清除自由基的能力,可以起到抗缺血-再灌注 损 伤 的 作 用[14]。另 有 研 究[15-16]显 示:肌 肽(VIP=1.32)在调节神经细胞凋亡、氧化应激和神经保护中均起着重要的作用。因此,本研究推测DHA、3,3′,4′,5-四羟基二苯乙烯和肌肽在牛蒡苷元保护脑缺血-再灌注损伤分子调控机制中起着重要的作用,可以作为生物标志物,而其他差异代谢物则需进一步的研究。
此外,本研究对26个差异代谢物进行了通路分析,结果显示:26个差异代谢物主要参与组氨酸代谢、精氨酸和脯氨酸代谢。已知脑缺血-再灌注损伤模型大鼠组胺释放增加,组氨释放增加会进一步促进炎症的发生,组胺与L-组氨酸和肌肽等均有密切关联,共同组成组氨酸代谢通路[17]。WANG等[18]研究显示:组氨酸代谢参与了天麻抗脑缺血-再灌注损伤的分子机制。此外,精氨酸和脯氨酸代谢也是脑缺血-再灌注损伤分子调控机制中的重要通路,已有研究[19-20]显示:丹红注射液和银杏叶提取物均可以通过调控精氨酸和脯氨酸代谢起到抗脑缺血-再灌注损伤作用。
综上所述,本研究通过代谢组学技术探讨牛蒡苷元对大鼠脑缺血-再灌注损伤的分子作用机制。通过对脑缺血-再灌注损伤大鼠差异代谢物通路的分析,表明其主要参与脑缺血-再灌注损伤大鼠组氨酸、精氨酸和脯氨酸代谢。DHA、3,3′,4′,5-四羟基二苯乙烯和肌肽水平在脑缺血-再灌注及牛蒡苷元干预后有差异,推测上述代谢物是牛蒡苷元治疗脑缺血-再灌注损伤的潜在生物标志物,本研究结果为缺血性疾病的治疗提供了参考依据。
