糖尿病肾病大鼠肾脏MATE1和OCT2表达及体内二甲双胍排泄变化研究*
2022-10-13黄陈余丹杨海峰
黄陈, 余丹, 杨海峰△
糖尿病肾病大鼠肾脏MATE1和OCT2表达及体内二甲双胍排泄变化研究*
黄陈1, 余丹2△, 杨海峰1△
(1江苏农牧科技职业学院,江苏 泰州 225300;2南京中医药大学医学院整合医学学院,江苏 南京 210023)
研究糖尿病肾病状态下大鼠体内二甲双胍排泄的变化和肾脏中多药及毒性化合物外排转运体1(MATE1)和有机阳离子转运体2(OCT2)表达的变化,并探讨两者之间的关系。雄性SD大鼠随机分为对照组(=12)和造模组(=12),链脲佐菌素腹腔注射诱导大鼠糖尿病肾病模型;大鼠尾静脉注射二甲双胍(10 mg/kg),考察其在大鼠体内的药物代谢动力学参数,膀胱插管实验考察大鼠体内各时间段的累积尿药排泄分数及肾清除率,测定大鼠肝脏和肾脏药物浓度;RT-qPCR和Western blot检测大鼠肾脏组织MATE1和OCT2的mRNA及蛋白表达水平。与对照组相比,糖尿病肾病大鼠体内的二甲双胍血浆暴露量显著降低(<0.01),二甲双胍清除率显著升高(<0.01),二甲双胍在大鼠体内的稳态表观分布容积显著降低(<0.01),平均滞留时间显著降低(<0.01),半衰期显著缩短(<0.05);糖尿病肾病大鼠2 h内二甲双胍的累积尿药排泄分数显著升高(<0.05),肾清除率显著升高(<0.01);糖尿病肾病大鼠肾脏中二甲双胍的药物浓度显著降低(<0.05),肝脏中药物浓度无显著性差异;糖尿病肾病大鼠肾脏MATE1的mRNA表达水平显著升高(<0.05),OCT2的mRNA水平显著降低(<0.05),MATE1的蛋白表达水平显著升高(<0.01),OCT2的蛋白表达水平显著降低(<0.01)。糖尿病肾病状态下大鼠肾脏MATE1表达升高,而OCT2表达下降;糖尿病肾病大鼠二甲双胍肾脏排泄的加快,可能主要与肾脏MATE1转运体表达升高相关。
糖尿病肾病;多药及毒性化合物外排转运体1;有机阳离子转运体2;二甲双胍;药物代谢动力学
糖尿病(diabetic mellitus, DM)是由胰岛素分泌缺陷、胰岛素生物作用受损或两者兼有引起的以高血糖为特征的代谢性疾病。随着DM病程的发展,机体的组织、器官和血管等会发生病变,形成相应的并发症。糖尿病肾病(diabetic nephropathy, DN)是DM的主要并发症之一,约有1/3的DM患者伴随有DN并发症的发生,其病理学改变主要包括系膜细胞的增殖和细胞外基质的累积,基底膜的增厚,肾小管及间质的损伤和纤维化,目前DN已成为终末期肾脏疾病的主要原因[1]。DM所造成机体生理条件的改变,可能会导致相应药物在机体内的药物代谢动力学过程发生改变。
肾脏作为机体的主要排泄器官,主要承担体内代谢内源性物质、药物以及毒物等物质的排泄功能[2]。在肾脏排泄的过程中,药物转运体发挥着重要的作用[3]。其中,有机阳离子转运体家族(organic cation transporters, OCTs)和多药及毒性化合物外排转运体家族(multidrug and toxic compound extrusion transporters, MATEs)是在肾脏中表达的两个重要的药物转运体家族。MATEs与OCTs共同调节底物的运动,作用在肾脏和肝脏最为明显,OCTs位于肾脏近端小管的基底膜外侧及肝细胞微管膜,底物通过OCTs摄入细胞;MATEs位于极化细胞的顶膜,将底物排出细胞;在肝脏和肾脏中,OCTs-MATEs介导不同结构的阳离子型化合物的吸收及排泄过程,目前约有40种临床使用药物已被证实为OCTs-MATEs的底物。OCT2主要在肾小管细胞基底外侧膜中表达,是肾脏中主要的阳离子转运体,可将底物转运入肾小管细胞内[4];MATE1主要在肝细胞和肾近端肾小管上皮细胞的刷状缘膜中表达,负责相应底物胆汁和尿液排泄的最后一步[5]。
链脲佐菌素(streptozotocin, STZ)诱导的DN大鼠模型表现出的蛋白尿、血清肌酐升高及一些组织学病变,与人DN相似,常用于DN的相关分子机制研究[6]。大鼠肾脏中OCT1和OCT2均有表达,人肾脏中主要有OCT2表达;啮齿类动物MATE1与人肾脏中MATE1的特性相似[7-9]。
二甲双胍是目前被多国指南推荐用作DM治疗的一线药物,其不仅可以降血糖,还可以明显减少DN患者的尿蛋白排泄,抑制单侧输尿管梗阻诱导的肾间质纤维化[10],对DM肾脏病变有一定的保护作用;其在体内被动扩散很少,吸收、摄取和排泄主要由膜转运蛋白介导[11],在血浆中几乎不与血浆蛋白结合,血浆蛋白结合率较低;在体内不发生代谢过程,以原形排出体外;其排泄几乎全部经过肾脏由尿液排泄[12-13]。二甲双胍在肾脏中的排泄主要通过OCT2、MATE1和MATE2-K转运[14-15],且有研究表明,相对于肝脏上OCT1转运体来说,二甲双胍更容易被肾脏上OCT2转运体转运[16]。基底膜侧的OCT2转运体将二甲双胍摄取进入肾小管上皮细胞,管腔膜侧的MATEs家族转运体将其排出至尿液中。
本研究以STZ诱导的DN大鼠为实验对象,以MATE1和OCT2的代表性转运底物二甲双胍为探针药物,研究DN大鼠体内二甲双胍排泄的变化,为DN时使用二甲双胍治疗提供参考;并进一步考察DN状态下大鼠肾脏中MATE1和OCT2表达水平的变化,探讨DN状态下药物代谢动力学变化与肾脏中药物转运体表达水平变化之间的关系。
材料和方法
1 动物
清洁级SD大鼠,24只,雌性,180~200 g,来源于上海西普尔必凯实验动物有限公司。许可证号为SCXK(沪)2016-0016。饲养于江苏农牧科技职业学院动物房。动物实验的所有相关过程均得到江苏农牧科技职业学院动物伦理委员会批准。
2 药品与试剂
盐酸二甲胍标准品购自上海阿达玛斯试剂有限公司;STZ购自Sigma-Aldrich;葡萄糖试剂盒购自上海荣盛生物药业有限公司;甘油三酯试剂盒、肌酐试剂盒和尿素氮试剂盒购自南京建成生物工程研究所;考马斯亮蓝试剂盒、BCA试剂盒、RIPA裂解液(强)、SDS-PAGE蛋白上样缓冲液(5x)、30%丙烯酰胺-甲叉丙烯酰胺和Western Ⅰ抗稀释液购自碧云天生物技术有限公司;TriPure Reagent总RNA提取剂购自北京艾德莱生物科技有限公司;逆转录试剂盒购自Toyobo;qPCR SYBR Green Master Mix购自上海翊圣生物科技有限公司;SLC22A2(OCT2)兔抗单克隆抗体购自Abcam;SLC47A1(MATE1)兔抗多克隆抗体购自ABclonal;辣根过氧化物酶标记的羊抗兔IgG Ⅱ抗和β-actin兔抗多克隆抗体均购自Bioworld;预染色的蛋白marker和ECL化学发光液购自上海天能科技有限公司。
3 主要仪器
HPLC-UV系统(Shimadzu);高速冷冻离心机Centrifuge 5430R和Mastercycler nexus梯度PCR仪(Eppendorf);高速冷冻离心机Sorvall RC6 PLUS(Thermo);多功能酶标仪POLARstar Omega(BMG LABTECH);NANO超微量核酸分析仪(北京原平皓生物技术有限公司);全自动荧光定量PCR仪LightCycler 96(Roche);Western blot 电泳和湿转系统(Bio-Rad);Tanon 5200 Multin凝胶成像仪(上海天能科技有限公司)。
4 主要方法
4.1动物分组及造模雄性健康SD大鼠24只,根据随机数字表法随机分为对照(control, CON)组和造模组(DM组),每组12只。依据文献报道[6, 17-18]建立DM模型:所有大鼠禁食不禁水过夜后,造模组大鼠腹腔注射STZ(65 mg/kg),对照组腹腔注射等体积溶媒(0.1 mol/L柠檬酸-柠檬酸钠缓冲液,pH 4.5)。注射STZ后第7天,所有大鼠禁食不禁水6 h后,从眼底静脉丛取血100 µL收集于已肝素化的离心管中,8 000×离心5 min,获得血浆,用葡萄糖试剂盒测定其空腹血糖水平。DM组大鼠空腹血糖水平>16.7 mmol/L则视为1型DM大鼠模型造模成功[19]。
造模成功的DM大鼠和正常组大鼠饲养8周后,禁食不禁水过夜,从眼底静脉丛取血0.25 mL收集于已肝素化的离心管中,8 000×离心5 min,获得血浆,用葡萄糖试剂盒、甘油三酯试剂盒、肌酐试剂盒及尿素氮试剂盒分别测定空腹血糖、血浆甘油三酯、血清肌酐及血尿素氮[6, 20]的含量;收集留取所有大鼠24 h的尿液,并记录尿液体积;取100 µL尿液,8 000×离心5 min,肌酐试剂盒与考马斯亮蓝试剂盒测定尿肌酐含量[21]和24 h尿蛋白含量,计算肌酐清除率。相关生化指标显著高于对照组的DM组大鼠视为1型DN大鼠模型构建成功。
4.2血浆及尿液样品的处理取100 μL生物样品(尿液或血浆)于1.5 mL离心管中,加入200 μL乙腈,震荡涡旋10 min,18 000×离心10 min,转移上清250 μL于新的1.5 mL离心管中,18 000×离心10 min,取上清100 μL于含有内衬管的进样瓶中。
4.3生物样品中二甲双胍的测定使用HPLC-UV系统,水相(A)为含2 mmol/L十二烷基硫酸钠、0.08%磷酸、0.1%三乙胺的超纯水溶液,有机相(B)为乙腈,等度洗脱,流速为1 mL/min[22-23];柱温:40 ℃;单针进样量20 μL;检测波长:235 nm;测定血浆、肾脏以及肝脏中二甲双胍的药物浓度时,有机相比例35%,测定尿液中二甲双胍的药物浓度时,有机相比例为33%;测定样品时长为10 min。
4.4DN大鼠静脉注射二甲双胍的药物代谢动力学对照组与DM组大鼠禁食后,尾静脉注射含5 g/L二甲双胍的溶液(10 mg/kg),分别在5、10、15、30、60、90、120、240和360 min时,眼底后静脉丛取血0.25 mL于已肝素化的离心管中,8 000×离心5 min,转移血浆,按照4.2方法处理血浆样品,按照4.3方法测定血浆中二甲双胍的药物浓度。根据所得数据,绘制二甲双胍的血药浓度-时间曲线,用Phoneix WinNonlin软件计算出相关药物代谢动力学参数。
4.5DN大鼠膀胱插管实验对照组与DM组大鼠禁食10 h后,进行膀胱插管实验。每只大鼠灌胃给予2 mL生理盐水使膀胱充盈,腹腔注射戊巴比妥钠麻醉,开腹,用镊子提拉起膀胱,开一小口,插管插入小口中,用缝合线固定;挤压膀胱,待尿液流畅稳定排出时,尾静脉注射含5 g/L二甲双胍的溶液(10 mg/kg),每隔15 min收集一次尿液,共2 h。按照4.2方法处理尿液样品,按照4.3方法测定尿液中二甲双胍的药物浓度。计算对照组与DM组大鼠各时间段的累积尿药排泄分数及肾清除率。
4.6DN大鼠肝脏、肾脏药物浓度的测定大鼠膀胱插管实验结束后处死大鼠,留取肾脏、肝脏,并称重。精密称取肾脏和肝脏组织0.1 g,加入1 mL的超纯水匀浆。取100 μL肾脏和肝脏匀浆液于1.5 mL离心管中,加入200 μL乙腈,震荡涡旋10 min后,18 000×离心10 min,转移上清液250 μL于新的1.5 mL离心管中,18 000×离心10 min,取上清液100 μL于含有内衬管的进样瓶中,按照4.3方法测定组织匀浆液中二甲双胍的浓度。
4.7RT-qPCR(1)RNA提取:取肾脏组织0.1 g,置入含有1 mL TriPure®RNA提取剂的研钵中研磨,转移至1.5 mL无核酸酶的离心管中,加入200 μL氯仿,4 ℃、12 000×离心10 min后,吸取上清液400 μL,加入500 µL异丙醇,颠倒混匀10次后室温放置10 min;在4 ℃、12 000×离心10 min后,弃去上清液,加入用DEPC水配置的75%乙醇1 mL,轻弹管底,使沉淀悬浮;在4 ℃、8 000×离心5 min后,弃去上清液,静置使溶剂挥发,据沉淀量加入DEPC水静置溶解并测定RNA浓度。(2)RT-qPCR:使用ReverTra Ace®qPCR RT Master Mix with gDNA Remover逆转录试剂盒将RNA逆转录为cDNA。目的基因的mRNA水平通过β-actin校正,实验数据处理采用2-ΔΔCt法。引物序列见表1。
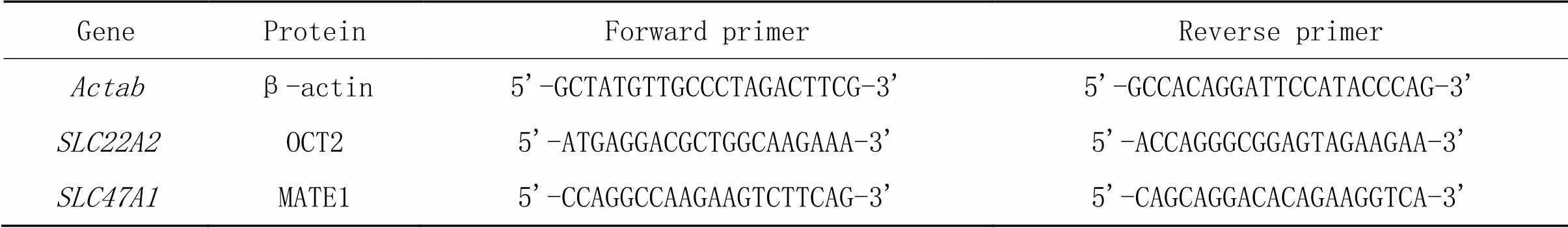
表1 RT-qPCR引物序列
4.8Western blot取大鼠肾脏组织约100 mg,加入1 mL含有1 mmol/L PMSF的RIPA(强)裂解液,冰水浴中匀浆,4 ℃静置30 min后13 000×离心10 min,转移上清液,BCA方法测定蛋白浓度,随后100 ℃煮沸10 min进行蛋白变性。上样后进行SDS-PAGE(80 V 30 min,120 V 90 min)、湿转(200 mA 90 min),5%脱脂牛奶封闭2 h,Ⅰ抗溶液4 ℃条件下孵育过夜,次日孵育Ⅱ抗;ECL化学发光,暗室显定影。图像采用ImageJ软件进行灰度值半定量分析,目的蛋白灰度值用内参蛋白β-actin灰度值进行校正后进行数据分析。
5 统计学处理
实验数据均采用均数±标准差(mean±SD)表示。采用SPSS 17.0软件进行数据处理。组间比较采用单因素方差分析,方差齐时选择LSD检验,方差不齐时选择Dunnett T3检验。当<0.05时认为差异有统计学意义。
结果
1 1型DN大鼠模型的建立
如表2所示,造模成功的DM组大鼠和对照组大鼠饲养8周后,与对照组大鼠相比,DM组大鼠体重显著低于对照组(<0.01),空腹血糖水平显著高于对照组(<0.01),血浆甘油三酯水平显著高于对照组(<0.05),表明DM大鼠模型构建成功。DM大鼠血尿素氮含量显著高于对照组(<0.01),血清肌酐含量无显著性差异,24 h尿液中蛋白含量显著高于对照组(<0.01),尿肌酐含量显著低于对照组(<0.01),肌酐清除率显著低于对照组(<0.01),综合上述生理生化指标结果,显示1型DN大鼠模型构建成功。

表2 1型糖尿病肾病大鼠生理生化指标
FBG: fasting blood glucose; TG: triglyceride; BUN: blood urea nitrogen; Upro: urea protein; SCr: serum creatinine; UCr: urea creatinine; CCr: clearance of creatinine.*<0.05,**<0.01CON group.
2 DN大鼠静脉注射盐酸二甲双胍的药物代谢动力学变化
2.1二甲双胍在DN大鼠血浆中浓度和药物代谢动力学参数变化与对照组相比,DM组大鼠血浆中二甲双胍浓度在30 min内均显著下降(<0.01),见图1。从药代动力学参数结果(表3)可知,与对照组相比,DM组大鼠体内的二甲双胍血浆暴露量显著降低(<0.01),二甲双胍清除率显著升高(<0.01),二甲双胍在体内的稳态表观分布容积显著降低(<0.01),平均滞留时间显著减少(<0.01),半衰期也显著缩短(<0.05)。
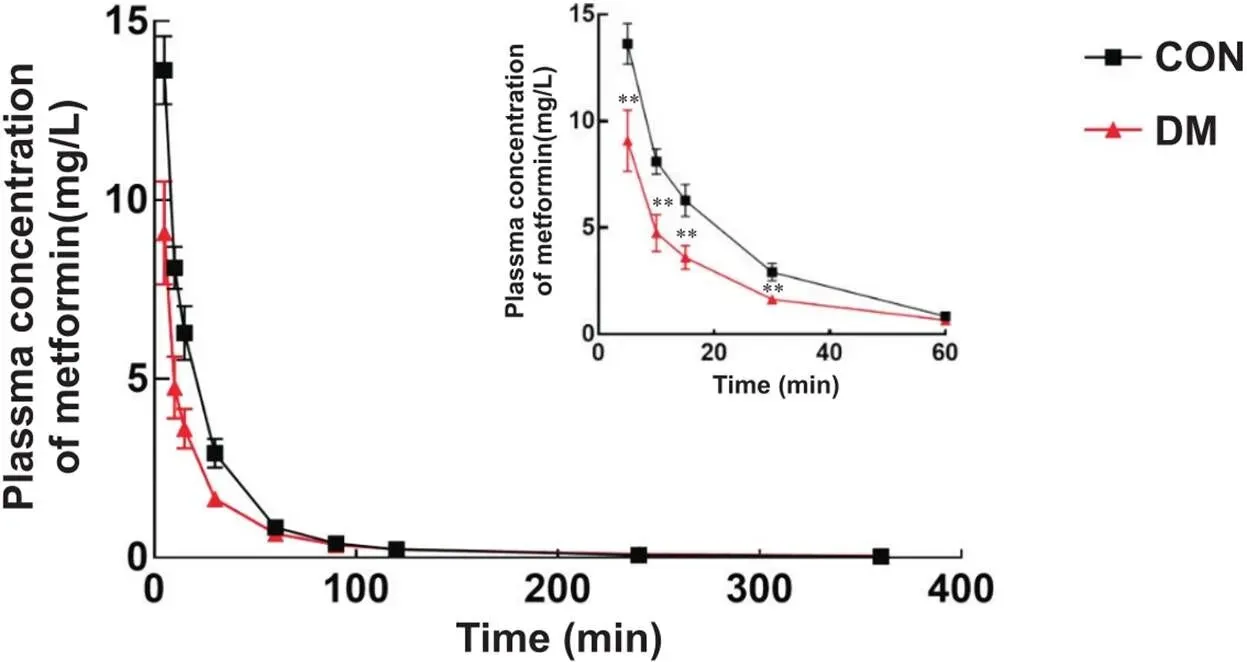
Figure 1. Plasma concentration of metformin after intravenous injection of metformin (10 mg/kg) in rats. Mean±SD. n=6. **P<0.01 vs control group.
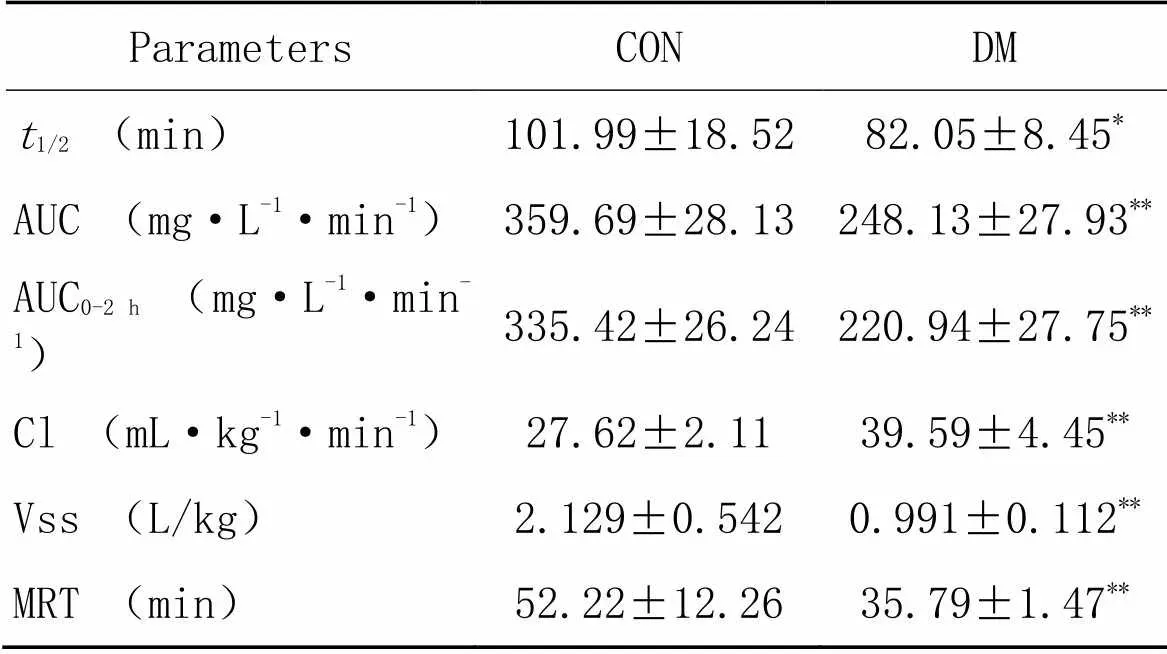
表3 实验大鼠静脉注射10 mg/kg二甲双胍的药物代谢动力学参数
1/2: half-life time; AUC: area under the curve; Cl: clearance; Vss: steady state apparent distribution volume; MRT: mean retention time.*<0.05,**<0.01control group.
2.2大鼠膀胱插管实验结果对照组和DM组大鼠2 h内二甲双胍的累积尿药排泄分数分别为57%和69%左右,两组间有显著差异(<0.05),见图2A;与对照组相比,DM组大鼠45 min后的累积尿药排泄分数显著升高(<0.05),DM组大鼠二甲双胍的肾清除率显著升高(<0.01),见图2B。

Figure 2. Accumulative urinary excretion fraction (A)and renal clearance rate (B)after intravenous injection of metformin (10 mg/kg) for 2 h. Mean±SD. n=6. *P<0.05, **P<0.01 vs control group.
2.3大鼠肾脏和肝脏中二甲双胍的药物浓度静脉注射10 mg/kg二甲双胍2 h后,对照组和DM组大鼠肝脏中二甲双胍的药物浓度接近且无统计学差异;DM组大鼠肾脏中二甲双胍浓度显著低于对照组(<0.05),见图3。

Figure 3. Concentration of metformin in the liver and kidney of rats after intravenous injection of metformin (10 mg/kg) for 2 h. Mean±SD. n=6. *P<0.05 vs control group.
3 DN大鼠肾脏中MATE1和OCT2转运体表达的变化
3.1DN大鼠肾脏中MATE1和OCT2转运体mRNA表达水平的变化RT-qPCR实验结果显示(图4),DM组大鼠肾脏MATE1的mRNA表达水平显著高于对照组(<0.05),OCT2的mRNA水平显著低于对照组(<0.05)。
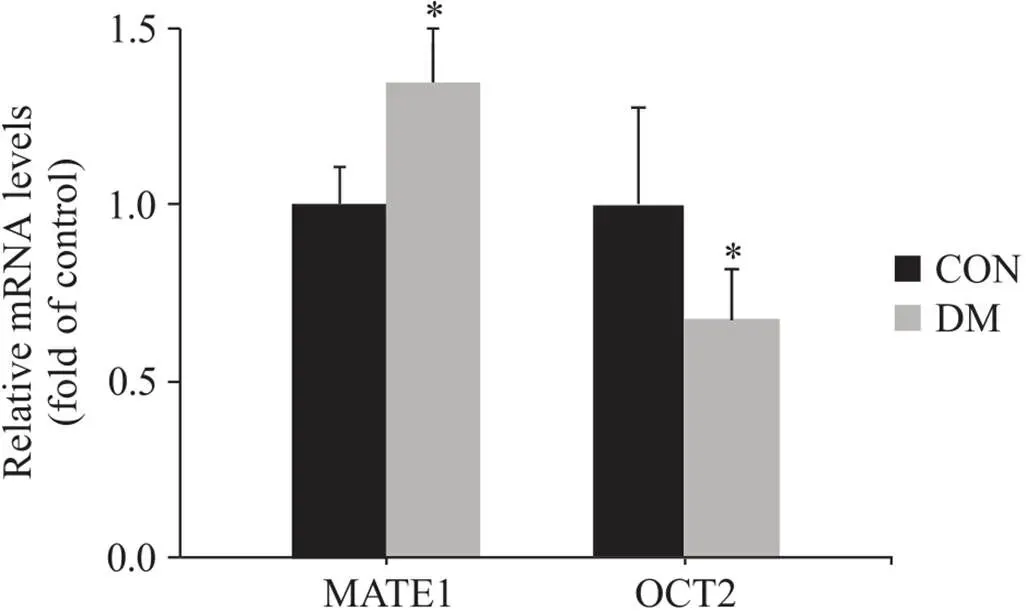
Figure 4. Relative mRNA levels of MATE1 and OCT2 in the kidneys of experimental rats. Mean±SD. n=6. *P<0.05 vs control group.
3.2DN大鼠肾脏中MATE1和OCT2转运体蛋白表达水平的变化Western blot结果显示(图5),DM组大鼠肾脏上MATE1蛋白表达水平显著高于对照组(<0.01),约为正常组大鼠的1.5倍;DM组大鼠肾脏上OCT2蛋白表达水平显著低于对照组(<0.01),约为正常组的0.34倍。蛋白表达水平变化的趋势与mRNA水平变化趋势结果相一致。

Figure 5. Expression of MATE1 and OCT2 in kidney of experimental rats. Mean±SD. n=6. **P<0.01 vs control group.
讨论
本实验研究了二甲双胍在DN大鼠体内的药代动力学及排泄变化。结果显示,与正常大鼠相比,DN大鼠二甲双胍血药浓度显著下降,血浆暴露量显著降低,清除率显著升高,体内的滞留时间和半衰期显著降低,说明二甲双胍在DN大鼠体内清除加快。膀胱插管实验显示,二甲双胍在DN大鼠体内的累积尿药排泄分数和肾清除显著升高;在药代动力学实验中,用Phoneix WinNonlin经非房室模型估算所得到的对照组和DM组大鼠二甲双胍的总清除率分别为(27.62±2.11) mL·kg-1·min-1和(39.59±4.45) mL·kg-1·min-1,膀胱插管实验中计算得到两组大鼠的肾脏清除率分别为(17.48±3.31) mL·kg-1·min-1和(31.95±7.52) mL·kg-1·min-1,综合以上结果显示,二甲双胍在DN大鼠体内清除加快,主要是由于肾脏清除率的增加所致,其他组织的清除率并没有显著变化。二甲双胍以原型经肾代谢,本身并无肾毒性,但严重肾功能衰竭时易在体内蓄积,存在血乳酸水平升高的风险,乳酸酸中毒是二甲双胍最为严重的不良反应,也是二甲双胍的禁忌症。在二甲双胍的临床使用中,如果估算肾小球滤过率大于30 mL/min,可以正常使用二甲双胍,小于30 mL/min是二甲双胍使用的禁忌。本研究结果提示在DN状态下使用二甲双胍,不仅要关注乳酸酸中毒等不良反应,还应关注在估算肾小球滤过率大于30 mL/min的情况下,由于相关药物转运体表达的变化导致的二甲双胍肾脏清除率的增加以及对降糖治疗效果的影响。
本实验从mRNA与蛋白表达水平上研究了肾脏中与二甲双胍转运相关的MATE1和OCT2两种转运体的表达差异。Thomas等[24]的研究中已经发现,DM大鼠中肾脏上OCT1、OCT2和OCT3表达均显著下调;Grover等[25]的研究中同样发现DM状态下,大鼠肾脏上OCT2蛋白表达的下调与DM病程呈现正相关;在Ⅱ型DM大鼠中,肾脏上OCT2的表达同样存在下调现象[26]。本实验研究结果显示DN状态下大鼠肾脏组织中OCT2的mRNA与蛋白表达水平显著降低,同以上研究结果相一致;同时,本实验首次对DN状态下大鼠肾脏MATE1表达进行了研究,实验结果显示,MATE1在mRNA水平与蛋白表达水平上均显著升高。
Fabian等[27]在二甲双胍(30 μmol/L)犬肾细胞(Madin-Darby canine kidney cells, MDCK)胞内累积实验研究中发现,二甲双胍被OCT2摄取进入细胞的量高于MATE1排出细胞的量,即OCT2转运二甲双胍的能力强于MATE1。König等[28]证实OCT2的吸收与MATE1的外排功能之间存在相互作用,与MDCK细胞、MDCK-MATE1单转染细胞相比,双转染MDCK细胞OCT1-MATE1和OCT2-MATE1细胞中(二甲双胍浓度10~2 500 μmoL/L),二甲双胍向细胞内的跨膜转运明显增加,且该过程在二甲双胍浓度达到为2 500 μmol/L之前是不饱和的。由于肾脏分泌阳离子物质是通过基底外侧膜的电位差和刷状缘膜上的H+梯度驱动协同进行。位于基底膜侧的OCT2通过易化扩散的方式将其有机阳离子底物摄入肾小管细胞中,这一过程主要是依靠两侧跨膜电位差来完成[29]。本实验中肝脏、肾脏组织浓度测定结果显示,二甲双胍在DN大鼠肾脏中药物残留显著降低。由此可推测,DN状态下大鼠肾小管细胞因MATE1表达和功能的增加导致细胞内二甲双胍浓度降低,促进了二甲双胍通过OCT2以易化扩散方式进入细胞内,由于OCT2对二甲双胍的转运能力较强,如果转运能力未达到饱和状态,OCT2表达的下调可能不影响其转运二甲双胍的能力。Tsuda等[30]的研究中,通过基因沉默MATE1小鼠证实了MATE1在二甲双胍肾脏消除中发挥的重要作用。在研究二甲双胍相关的药物相互作用时发现,西咪替丁抑制二甲双胍肾脏消除的潜在机制可能是通过抑制MATE1的功能,而不是抑制OCT2的功能[31]。综上所述,从OCT2-MATE1协同转运的视角来看,DN状态下大鼠肾脏MATE1和OCT2表达的变化总体上表现为二甲双胍肾脏清除的加快,二甲双胍肾脏排泄的加快可能主要与MATE1表达升高相关。
目前从基因多态性的角度开展MATE1和OCT2表达差异的研究较多,已在体内外实验中证实MATEs的遗传多态性能影响MATEs转运体的功能,在和中分别发现16个突变位点及4个突变位点对转运体功能有影响[33]。本实验研究了DN状态下大鼠肾脏上MATE1和OCT2的功能与表达变化,表明在疾病状态下肾脏中MATE1和OCT2的功能与表达会受到影响,导致相关药物在肾脏的蓄积或排泄加快,其临床意义值得进一步关注。
[1] Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: a report from an ADA Consensus Conference[J]. Diabetes Care, 37(10):2864-2883.
[2] Yacovino LL, Aleksunes LM. Endocrine and metabolic regulation of renal drug transporters[J]. J Biochem Mol Toxicol, 2012, 26(10):407-421.
[3] Liu X. Overview: role of drug transporters in drug disposition and its clinical significance[J]. Adv Exp Med Biol, 2019, 1141:1-12.
[4] Kimura N, Okuda M, Inui K. Metformin transport by renal basolateral organic cation transporter hOCT2[J]. Pharm Res, 2005, 22(2):255-259.
[5] Otsuka M, Matsumoto T, Morimoto R, et al. A human transporter protein that mediates the final excretion step for toxic organic cations[J]. Proc Natl Acad Sci U S A, 2005, 102(50):17923-17928.
[6] Tesch GH, Allen TJ. Rodent models of streptozotocin-induced diabetic nephropathy[J]. Nephrology (Carlton), 2007, 12(3):261-266.
[7] Xiaoyan, Chu, Kelly, et al. Species differences in drug transporters and implications for translating preclinical findings to humans[J]. Expert Opin Drug Metab Toxicol, 2013, 9(3):237-252.
[8] Nies AT, Damme K, Kruck S, et al. Structure and function of multidrug and toxin extrusion proteins (MATEs) and their relevance to drug therapy and personalized medicine[J]. Arch Toxicol, 2016, 90(7):1555-1584.
[9] Damme K, Nies AT, Schaeffeler E, et al. Mammalian MATE (SLC47A) transport proteins: impact on efflux of endogenous substrates and xenobiotics[J]. Drug Metab Rev, 2011, 43(4):499-523.
[10]冯晔囡, 张幼怡, 肖晗. 二甲双胍通过AMPK依赖及非依赖途径抑制肾脏纤维化[J]. 中国病理生理杂志, 2015, 31(10):1793.
Feng YN, Zhang YY, Xiao H. Metformin inhibits renal fibrosis through AMPK dependent and independent pathways[J]. Chin J Pathophysiol, 2015, 31(10):1793.
[11] Emami Riedmaier A, Fisel P, Nies AT, et al. Metformin and cancer: from the old medicine cabinet to pharmacological pitfalls and prospects[J]. Trends Pharmacol Sci, 2013, 34(2):126-135.
[12] Tucker GT, Casey C, Phillips PJ, et al. Metformin kinetics in healthy subjects and in patients with diabetes mellitus[J]. Br J Clin Pharmacol, 1981, 12(2):235-246.
[13] Markowicz-Piasecka M, Huttunen KM, Mateusiak L, et al. Is metformin a perfect drug? Updates in pharmacokinetics and pharmacodynamics[J]. Curr Pharm Des, 2017, 23(17):2532-2550.
[14] Liang XM, Giacomini KM. Transporters involved in metformin pharmacokinetics and treatment response[J]. J Pharm Sci, 2017, 106(9):2245-2250.
[15] 许希宁, 石荣, 马越鸣. 基于药物转运体机制的二甲双胍体内过程研究进展[J]. 药学学报, 2017, 52(6):865-870.
Xu XN, Shi R, Ma YM. Research progress of pharmacokinetics of metformin based on transporters[J]. Acta Pharm Sin, 2017, 52(6):865-870.
[16] Kimura N, Masuda S, Tanihara Y, et al. Metformin is a superior substrate for renal organic cation transporter OCT2 rather than hepatic OCT1[J]. Drug Metab Pharmacokinet, 2005, 20(5):379-386.
[17] Liu H, Xu X, Yang Z, et al. Impaired function and expression of P-glycoprotein in blood-brain barrier of streptozotocin-induced diabetic rats[J]. Brain Res, 2006, 1123(1):245-252.
[18] Kaur M, Bedi O, Sachdeva S, et al. Rodent animal models: from mild to advanced stages of diabetic nephropathy[J]. Inflammopharmacology, 2014, 22(5):279-293.
[19] 黄恬, 蔡稀, 钟玲. 厄洛替尼减轻STZ诱导的糖尿病肾病模型大鼠的肾损伤[J]. 中国病理生理杂志, 2017, 33(8):1460-1466.
Huang T , Cai X , Zhong L, et al. Effect of erlotinib on renal injury in rats with STZ-induced diabetic nephropathy[J]. Chin J Pathophysiol, 2017, 33(8):1460-1466.
[20] Breyer MD, Böttinger E, Brosius FC, et al. Diabetic nephropathy: of mice and men[J]. Adv Chronic Kidney Dis, 2005, 12(2):128-145.
[21] Mathialagan S, Rodrigues AD,Feng B. Evaluation of renal transporter inhibition using creatinine as a substrateto assess the clinical risk of elevated serum creatinine [J]. J Pharm Sci, 2017, 106(9):2535-2541.
[22] Komazawa H, Yamaguchi H, Hidaka K, et al. Renal uptake of substrates for organic anion transporters Oat1 and Oat3 and organic cation transporters Oct1 and Oct2 is altered in rats with adenine-induced chronic renal failure[J]. J Pharm Sci, 2013, 102(3):1086-1094.
[23] Chen Y, Li HQ, Xu JJ, et al. Determination of metformin in diabetic rat plasma by an improved ion-pair high-performance liquid chromatography: application to a pharmacokinetic study[J]. Acta Pharmacol Sin, 2012(3):211-218.
[24] Thomas MC, Tikellis C, Kantharidis P, et al. The role of advanced glycation in reduced organic cation transport associated with experimental diabetes[J]. J Pharmacol Exp Ther, 2004, 311(2):456-466.
[25] Grover B, Buckley D, Buckley AR, et al. Reduced expression of organic cation transporters rOCT1 and rOCT2 in experimental diabetes[J]. J Pharma Exp Ther, 2004, 308(3):949.
[26] Nowicki MT, Aleksunes LM, Sawant SP, et al. Renal and hepatic transporter expression in type 2 diabetic rats [J]. Drug Metab Lett, 2008, 2(1):11-17.
[27] Müller F,Weitz D,Mertsch K, et al. Importance of OCT2 and MATE1 for the cimetidine-metformin interaction: insights from investigations of polarized transport in single- and double-transfected MDCK cells with a focus on perpetrator disposition[J]. Mol Pharm, 2018, 15(8):3425-3433.
[28] König J, Zolk O, Singer K, et al. Double-transfected MDCK cells expressing human OCT1/MATE1 or OCT2/MATE1: determinants of uptake and transcellular translocation of organic cations[J]. Br J Pharmacol, 2011, 163(3):546-555.
[29] 戴永国, 陈李杰, 王崴, 等. 肾脏有机阳离子转运体2在急性肾损伤中病理生理调控的研究进展[J]. 生命科学, 2018, 30(7):790-797.
Dai YG, Chen LJ, Wang W, et al. Pathophysiological regulation of renal organic cation transporter 2 (OCT2) in acute kidney injury: a review[J]. Chin Bull Life Sci, 2018, 30(7):790-797.
[30] Tsuda M , Terada T , Mizuno T , et al. Targeted disruption of the multidrug and toxin extrusion 1 () gene in mice reduces renal secretion of metformin[J]. Mol Pharmacol, 2009, 75(6):1280-1286.
[31] Tsuda M, Terada T, Ueba M, et al. Involvement of human multidrug and toxin extrusion 1 in the drug interaction between cimetidine and metformin in renal epithelial cells[J]. J Pharmacol Exper Ther, 2009, 329(1):185-191.
[32] Kajiwara M, Terada T, Asaka J, et al. Critical roles of Sp1 in gene expression of human and rat H+/organic cation antiporter MATE1[J]. Am J Physiol Renal Physiol, 2007, 293(5):F1564-F1570.
Changes of MATE1/OCT2 expression and metformin excretion in kidneys of rats with diabetic nephropathy
HUANG Chen1, YU Dan2△, YANG Hai-feng1△
(1,225300,;2,,210023,)
To investigate the changes of metformin excretion in rats with diabetic nephropathy (DN)and the expression of multi-drug and toxic compound efflux transporter 1 (MATE1) and organic cation transporter 2 (OCT2) in kidneys, and to explore the relationship between them.Male SD rats were randomly divided into control group (=12) and model group (=12). Streptozotocin was injected intraperitoneally to induce DN model. Metformin solution (10 mg/kg) was injected into the tail vein of rats to investigate its pharmacokinetic parameters in rats. Bladder intubation test was conducted to investigate the cumulative urinary drug excretion fraction and renal clearance rate in rats at various time points, and the drug concentrations in rat liver and kidney were determined. The mRNA and protein expression levels of MATE1 and OCT2 in rat kidney were tested by RT-qPCR and Western blot, respectively.Compared with control group, the plasma exposure of metformin in DN rats dropped significantly (<0.01), the clearance rate of metformin was elevated significantly (<0.01), the steady-state apparent distribution volume of metformin declined significantly (<0.01), the mean residence time was reduced significantly (<0.01), and half-life time was decreased significantly (<0.05). The cumulative urinary excretion fraction of metformin in DN rats was elevated significantly within 2 h (<0.05), and the renal clearance rate was increased significantly (<0.01). The concentration of metformin in kidney of DN rats declined significantly (<0.05), and there was no significant difference of drug concentration in livers. In DN rats, the mRNA expression level of MATE1 was significantly increased (<0.05), the mRNA level of OCT2 was significantly decreased (<0.05), the protein expression level of MATE1 was significantly increased (<0.01), and the protein expression level of OCT2 was significantly decreased (<0.01).Accelerated renal excretion of metformin in DN rats may be mainly related to the increased expression of MATE1 in the kidney.
Diabetic nephropathy; Organic cation transporter 2; Multidrug and toxic compound extrusion transporter 1; Metformin; Pharmacokinetics
1000-4718(2022)09-1645-08
2022-03-28
2022-06-24
余丹Tel: 025-85811389; E-mail: yud@njucm.edu.cn; 杨海峰 Tel: 0523-86158187; E-mail: yhf8142@ sina.com
R965; R587.1
A
10.3969/j.issn.1000-4718.2022.09.014
[基金项目]江苏省自然科学基金资助项目(No. BK20161368);江苏高校“青蓝工程”资助项目;江苏省“333高层次人才培养工程”资助项目;江苏农牧科技职业学院科技创新团队资助项目(No. NSF2021TC02)
(责任编辑:宋延君,李淑媛)
