在hUCMSCs中过表达Shox2和HCN4以构建生物起搏表型细胞的研究*
2022-10-13韦玮朱业顾建军顾翔
韦玮, 朱业, 顾建军, 顾翔
在hUCMSCs中过表达和以构建生物起搏表型细胞的研究*
韦玮, 朱业△, 顾建军, 顾翔△
(扬州大学临床医学院,苏北人民医院心血管内科,江苏 扬州 225001)
拟利用慢病毒载体将和转染至永生化人脐带间充质干细胞(hUCMSCs),探讨体外过表达和的hUCMSCs是否具有起搏样细胞表型。进行hUCMSCs体外传代培养。分别构建携带和基因的慢病毒载体及空载体,通过慢病毒介导和基因转染至hUCMSCs。采用CCK-8实验检测各组细胞活力。应用RT-qPCR和Western blot方法检测起搏相关因子mRNA和蛋白表达水平。(1)慢病毒过表达载体构建成功,-MSCs组和-MSCs组转染效率约为50%~55%--MSCs组转染效率约40%~45%,形态较前也稍有变化,折光性较好;(2)实验组细胞生长速度较对照组变缓(<0.05);(3)过表达组中HCN4、Tbx18和Tbx3的mRNA表达量显著高于对照组(<0.05),Nkx2.5和Cx43的mRNA表达量显著低于对照组(<0.01);(4)与对照组相比,单基因过表达组Cx45蛋白水平显著上调,Nkx2.5和Cx43蛋白水平显著下调(<0.01),双基因过表达组比单基因过表达组上调(或下调)更显著(<0.01)。过表达和(或)的hUCMSCs具有起搏样细胞表型;共转染有促进hUCMSCs向起搏样细胞表型转化的叠加效果。
生物起搏器;人脐带间充质干细胞;基因;基因
病态窦房结综合征(sick sinus syndrome, SSS)是临床上常见的严重心脏疾病之一,极大地增加了患者死亡风险。目前,电子起搏器是窦房结功能障碍(sinus node dysfunction, SND)患者的一线治疗手段,但仍存在很多局限性,譬如需要定期更换电池、导线断裂等,迫使人们寻找更为理想的起搏方式。随着细胞生物学及心脏电生理学的不断发展,使得干细胞移植构建心脏生物起搏器成为可能[1]。
由超极化激活环核苷酸门控通道(hyperpolarization-activated cyclic nucleotide-gated channel, HCN)产生的电流f,即起搏电流,是舒张期缓慢去极化的关键[2]。HCN4是HCN的主要亚型,该通道突变会导致SND[3]。矮小同源盒2(short stature homeobox 2, Shox2)对窦房结(sinoatrial node,SAN)细胞的发育和分化同样重要。敲除的小鼠由于、和的表达增加以及、和的表达下调而死于SSS[4]。Nkx2.5是心脏发育的重要转录因子,其变异可导致心律失常。胚胎转录因子T-box 3 (Tbx3)和T-box 18 (Tbx18)也是正常SAN发育所必需的。表达Tbx18转录因子的间充质祖细胞与SAN的产生有关,而Tbx3在SAN中充当转录抑制因子[5]。另外,SAN中心表达间隙连接蛋白45(connexin 45, Cx45),使SAN与周围的心房肌形成电绝缘;Cx43在SAN中表达量很低甚至不表达[6]。
与成人骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)不同,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUCMSCs)具有更易获得,成本低,免疫原性弱和良好增殖活力等优势,为后续研究及临床应用提供更好的基础[7]。
在本研究中,我们拟构建携带和基因的慢病毒载体,并将和基因转染至hUCMSCs,运用RT-qPCR及Western blot检测目的基因和起搏相关因子在细胞内的表达情况,初步验证过表达和后的hUCMSCs是否具有起搏样细胞表型。
材料和方法
1 细胞
取自扬州大学表观遗传学实验室提供的永生化hUCMSCs,使用无任何伦理争议。
2 主要实验试剂
pLentis-Ubi-MCS-EGFP、pLentis-Ubi-MCS-ERFP、GV载体质粒、pHelper 1.0和pHelper 2.0载体质粒(上海吉凯生物技术有限公司);α-MEM培养液和DMEM培养液(HyClone);胎牛血清(Gibco);RIPA裂解液、BCA试剂盒、SDS-PAGE凝胶制备试剂盒和胰蛋白酶(上海碧云天生物有限公司);青霉素-链霉素和嘌呤霉素(Sigma);兔抗Shox2多克隆抗体等(Affinity Biosciences);FastKing一步法除基因组cDNA第一链合成预混试剂盒和琼脂糖凝胶DNA回收试剂盒(北京天根生化科技有限公司);AceQ qPCR SYBR Green Master Mix、RNA-easy Isolation Reagent、CCK-8试剂盒和ClonExpress II One Step Cloning Kit(南京诺唯赞生物科技股份有限公司)。引物由武汉赛维尔生物科技有限公司合成。
3 实验方法
3.1携带和基因慢病毒载体的构建、鉴定和包装在pLentis-Ubi-MCS-EGFP/ERFP克隆位点进行H I/I双酶切,对载体酶切产物进行琼脂糖凝胶电泳,回收目的条带。在NCBI查询Shox2和HCN4的mRNA序列,设计特异性引物。将引物稀释进行PCR扩增目的基因片段,根据目的条带和线性载体片段的大小将条带裁剪,用琼脂糖凝胶DNA回收试剂盒回收片段,再与线性化载体通过ClonExpress II One Step Cloning Kit进行连接。将连接反应产物加入到DH5α细胞中,取菌液均匀涂布在含有抗生素平板上,挑取单个克隆通过PCR鉴定阳性克隆,随后测序,测序结果与目的基因序列进行比对分析。转染前24 h将对数生长期293T细胞调整细胞密度后重新接种于10 cm2细胞培养皿。细胞密度80%左右可用于转染;离心管中加入各DNA溶液(GV载体质粒、pHelper 1.0载体质粒和pHelper 2.0载体质粒),与助转染试剂混合均匀。缓慢滴加至293T细胞培养液中,6 h后弃去培养液再加入10% MEM培养液20 mL,继续培养72 h。收集转染后293T细胞上清液,过滤上清液于超速离心管离心,弃上清,加入病毒保存液重悬离心,取上清分装后-80 ℃保存。特异性引物序列见表1。

表1 引物序列
F: forward; R: reverse.
3.2和慢病毒载体转染hUCMSCs和稳定株筛选
3.2.1单转染和基因将第7代hUCMSCs接种于24孔板中,细胞生长达孔底面积约30%时进行转染。按MOI=250,把病毒液和助转液稀释至需要浓度,吸出孔板中的培养液。将混合液混匀后取适量体积加入每孔细胞中。12 h后更换常规培养液,放入5% CO2、37 ℃恒温培养箱培养。
3.2.2共转染和基因取出转染后的hUCMSCs再进行共转染[8]。将携带基因慢病毒和助转剂混合均匀加入每孔细胞中。120 h后将细胞放在倒置荧光显微镜下观察随机多个视野中同时表达红、绿色荧光细胞数。
3.3hUCMSCs过表达细胞株生长曲线检测取对数生长期过表达细胞株接种于96孔板中,对照组为hUCMSCs,实验组为-MSCs、-MSCs和--MSCs。根据CCK-8试剂盒说明书每组设置4个复孔,37 ℃恒温培养箱培养24 h后,每孔细胞中加入10 μL CCK-8溶液,37 ℃孵育2 h。吸出上清,转移至新的96孔板中,用酶标仪检测450 nm处的吸光度()值,连续测量6 d后绘制生长曲线。
3.4RT-qPCR检测目的基因的mRNA表达RT-qPCR反应液配制在冰上进行。通过逆转录试剂盒将各组RNA逆转录成cDNA,随后用荧光定量试剂盒配制反应体系,根据说明书将引物、SYBR荧光染料、ddH2O和cDNA制成混合液再加到96孔板内。利用Bio-Rad实时定量PCR仪检测,反应程序设定为:95 ℃ 5 min; 95 ℃ 10 s, 60 ℃ 30 s, 95℃ 15 s, 60 ℃ 60 s,95 ℃ 15 s,扩增40个循环。以GAPDH作为内参照,运用2-ΔΔCt法计算基因相对表达量。引物序列见表1。
3.5Western blot检测目的基因的蛋白表达胰酶消化贴壁生长的hUCMSCs后移至EP管中,加入配制好的裂解液(RIPA+PMSF)吹打均匀,冰上裂解30 min后4 ℃离心15 min,取上清至新的EP管中。样品加入对应体积的上样缓冲液,100 ℃煮沸10 min以变性。上样、转膜。结束后将膜置于摇床上5%脱脂乳室温封闭2 h,洗膜。根据抗体说明书进行对应抗体稀释、孵育,ECL超敏发光液显影拍照。使用ImageJ软件进行各组目的蛋白表达相对丰度分析,每组样本均进行3次独立重复实验取均值。
4 统计学处理
所有数据采用SPSS 26.0软件进行统计学分析,数据以均数±标准差(mean±SD)表示。两组间比较采用检验,多组间比较采用单因素方差分析。采用GraphPad Prism 7.0进行统计图的绘制。以<0.05为差异有统计学意义。
结果
1 构建Shox2和HCN4基因慢病毒载体
通过5'和3'两端特异性引物进行PCR扩增并获取目的基因片段,再进行重组质粒的制备获得pLentis-Ubi-MCS-EGFP-目的条带,条带大小与基因的CDS区条带大小一致,如图1A所示。将pLentis-Ubi-MCS-EGFP-过表达载体菌液送至公司测序,并将结果序列至NCBI数据库进行比对,如图1B所示,序列信息完全一致即慢病毒过表达载体构建成功。
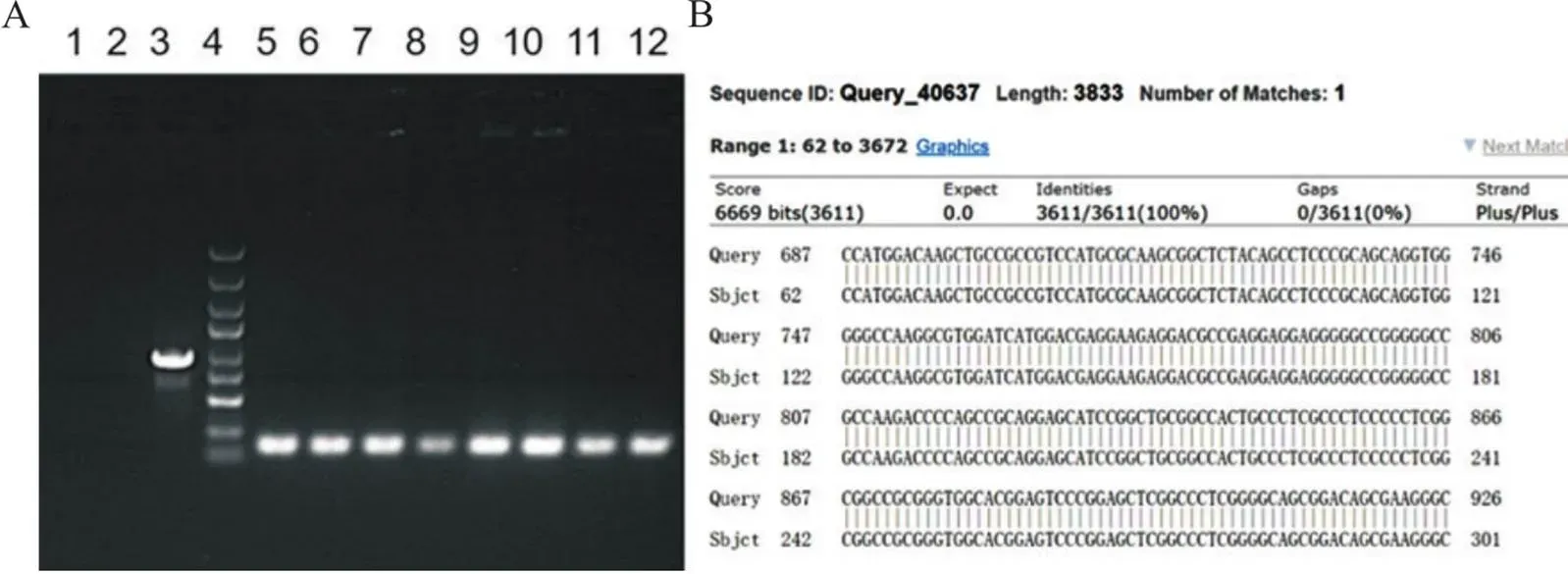
Figure 1. The lentiviral recombinant vector was successfully constructed (taking pLentis-UBI-MCS-EGFP-HCN4 recombinant rector as an example). A: PCR products [1: negative control (ddH2O); 2: negative control (empty control); 3: positive control (GAPDH); 4: marker from top to bottom: 5 kb, 3 kb, 2 kb, 1.5 kb, 1 kb, 750 bp, 500 bp, 250 bp, and 100 bp; 5 to 12: transformant (136 bp)]; B: the sequencing results of pLentis-Ubi-MCS-EGFP-HCN4 overexpression vector were compared in the NCBI database, which was completely consistent with the database sequence information.
2 慢病毒过表达载体转染Shox2和HCN4的效率
以病毒感染复数MOI=250,转染72 h后镜下逐渐能观察到细胞有荧光表达,120 h时-MSCs组和-MSCs组细胞转染效率约为50%~55%。细胞随着培养时间延长表达荧光的细胞量有所增加,形态较前也稍有变化,胞体较为圆润,偶见多角形或棒杆状生长,细胞折光性较好,见图2。
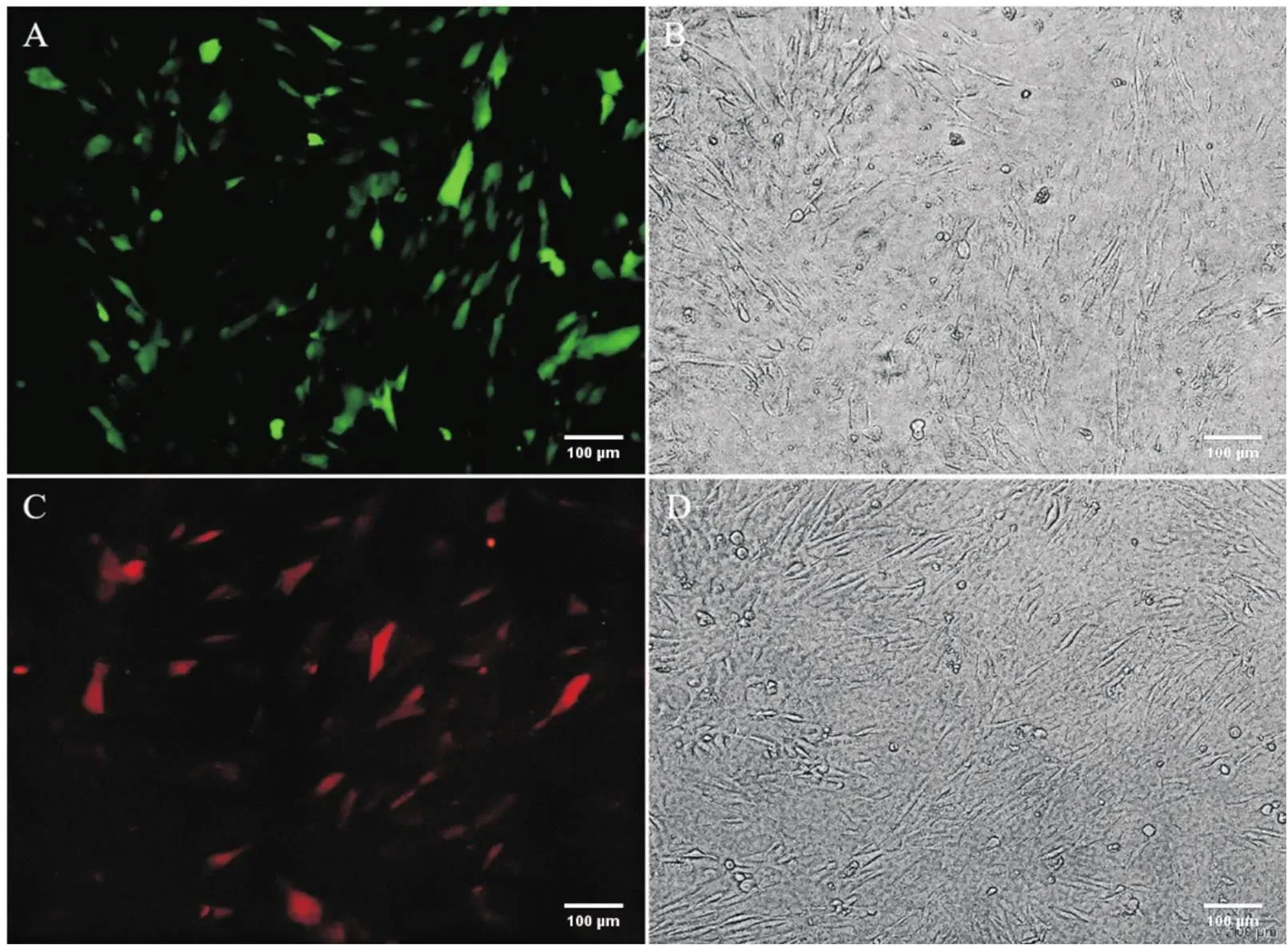
Figure 2. The hUCMSCs infection rate (120 h after transfection). A: Shox2-MSCs group (GFP); C: HCN4-MSCs group (RFP); B and D: the same field of vision under their corresponding inverted microscope, respectively.
进行共转染时选择稳定表达的细胞株进行基因转染,镜下观察细胞折光性较好,表达的为红色荧光蛋白(red fluorescent protein, RFP),表达的为绿色荧光蛋白(green fluorescent protein, GFP),共转染效率约为40%~45%,见图3。
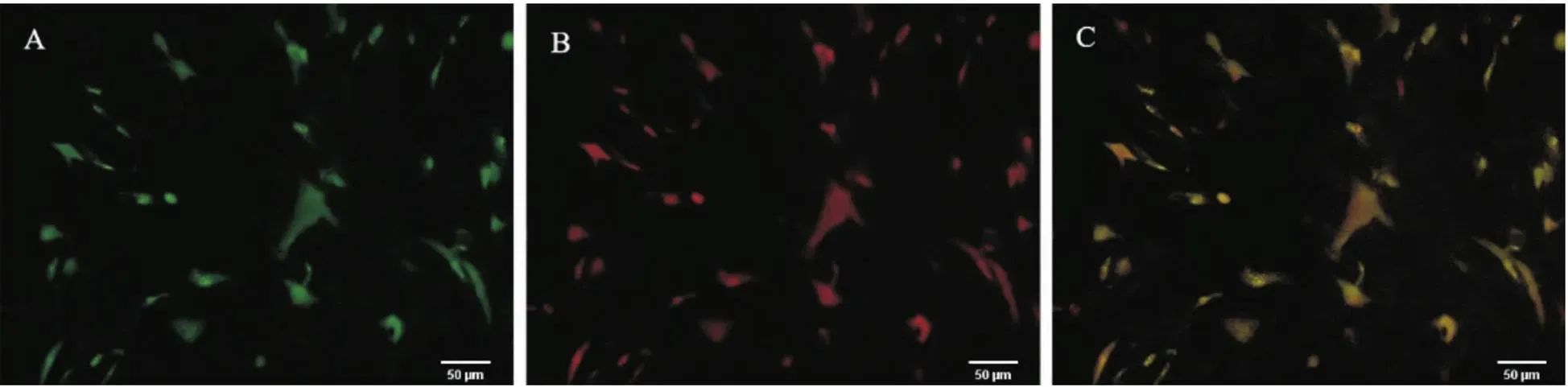
Figure 3. The hUCMSCs co-infection rate (120 h after transfection). A: HCN4-Shox2-MSCs (GFP); B: HCN4-Shox2-MSCs (RFP); C: HCN4-Shox2-MSCs merged fluorescence.
3 过表达Shox2和HCN4对hUCMSCs活力的影响
通过CCK-8法绘制细胞生长曲线,结果表明,或(和)基因转染显著减慢了hUCMSCs的生长速度。与转染空载病毒的hUCMSCs(对照组)相比,-MSCs组和-MSCs组细胞在第4~6天生长速度明显减慢(<0.05),--MSCs组生长速度减慢更明显(<0.01),见图4。

Figure 4. The growth rate of cells in Shox2-MSCs group and HCN4-MSCs group was significantly decreased, and that in Shox2-HCN4-MSCs group was more significantly reduced. Mean±SD. n=4. *P<0.05, **P<0.01 vs MSCs group.
4 稳转hUCMSCs目的基因后相关因子mRNA表达的变化
-MSCs组和MSCs组HCN4、Tbx18和Tbx3的mRNA表达量显著高于对照组(<0.05),Nkx2.5和Cx43的mRNA表达量显著低于对照组(<0.01);-MSCs组和对照组比较Tbx3的mRNA表达显著升高,Cx43和Nkx2.5 mRNA表达显著降低(<0.05);--MSCs组中上述因子mRNA表达量与-MSCs组和-MSCs组相比变化更显著(<0.05),见图5。
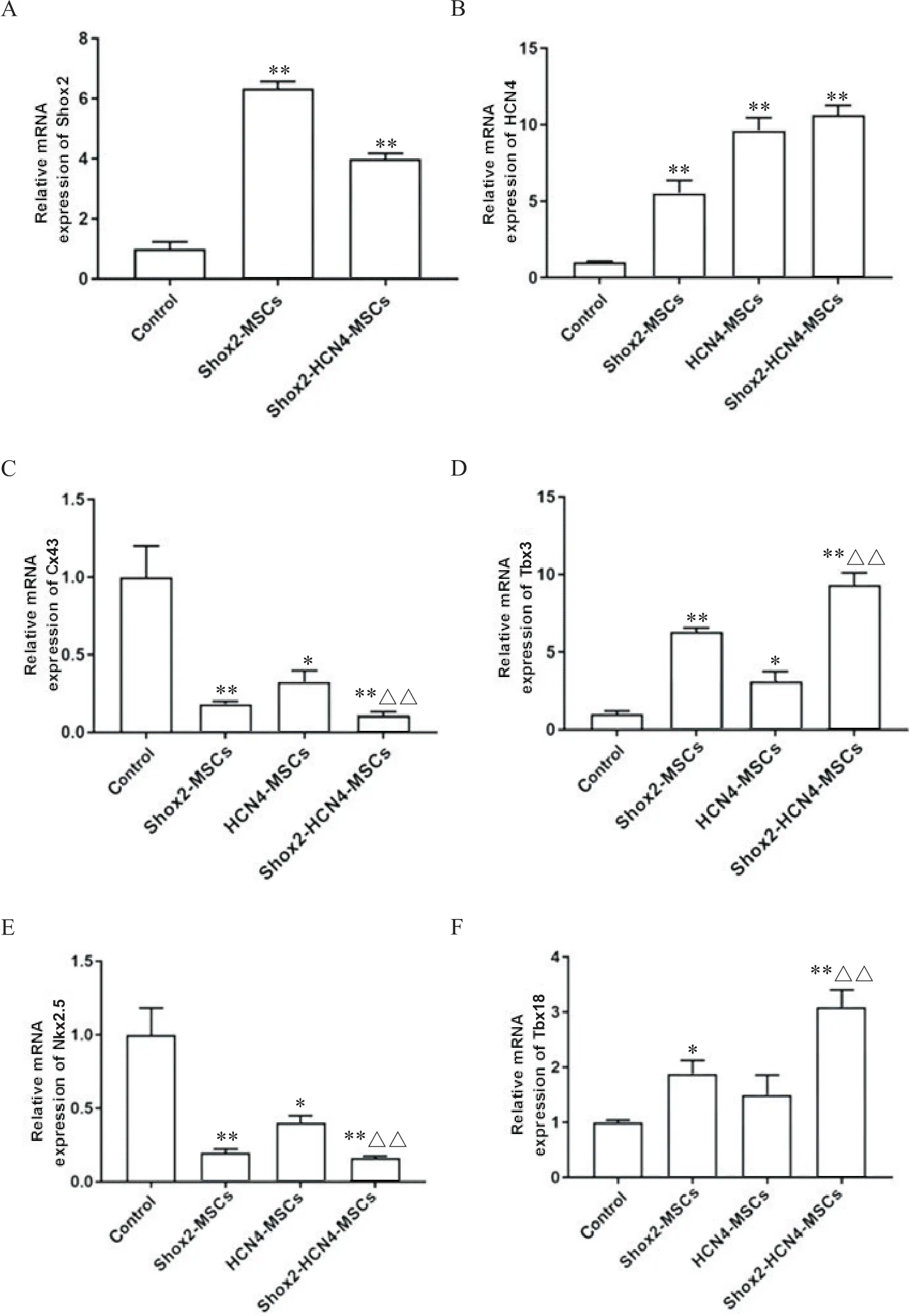
Figure 5. Results of RT-qPCR. A: relative expression of Shox2 mRNA in each group; B: relative expression of HCN4 mRNA in each group; C: relative expression of Cx43 mRNA in each group; D: relative expression of Tbx3 mRNA in each group; E: relative expression of Nkx2.5 mRNA in each group; F: relative expression of Tbx18 mRNA in each group. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group; △△P<0.01 vsShox2-MSCs group.
5 稳转hUCMSCs目的基因后相关因子蛋白表达的变化
与对照组相比,-MSCs组Cx45蛋白水平上调,Nkx2.5和Cx43蛋白水平下调(<0.01),-MSCs组检测到Cx45和Cx43蛋白表达;--MSCs组比-MSCs组和-MSCs组上调(或下调)更显著(<0.01),见图6。

Figure 6. Results of Western blot. A: relative expression of Shox2 protein in each group; B: relative expression of HCN4 protein in each group; C: relative expression of Cx43, Cx45 and Nkx2.5 proteins in each group. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group; △P<0.05 vsShox2-MSCs group.
讨论
MSCs是具有分化成各种细胞类型潜力的多能基质细胞。与成人BMSCs不同,hUCMSCs是一种成体干细胞,可从人脐带分离出来,成本低、免疫原性弱,且增殖能力更强,这些因素都成为hUCMSCs应用于异体或自体研究的优势。通常它们在体外扩增至第8代后开始进入衰老阶段,为了满足后续实验要求,本研究采用经永生化处理的hUCMSCs,运用RT-qPCR及Western blot检测目的基因和起搏相关因子在细胞内的表达情况,验证过表达和后的hUCMSCs是否具有起搏样细胞表型,为研究永生化hUCMSCs结合起搏基因体外构建生物起搏器的基础研究和未来临床应用提供依据。
起搏细胞的独特之处在于它们具有缓慢的去极化阶段。HCN通道可在动作电位的超极化阶段增加内向电流并产生f,是起搏器细胞中离子电流f的分子决定因素[9]。HCN通道特性可以通过cAMP与通道C端的环核苷酸结合结构域结合来调节,从而促进通道激活[10]。在本研究中,我们以转染一种转录因子、一种离子通道蛋白或二重组合的形式将hUCMSCs转化为心脏起搏样细胞,并揭示了在发育中的房室连接处的新型表达域。
HCN4是在SAN中存在的主要离子通道亚型。Ueda等[11]报道,在SSS患者中检测到基因突变,该患者表现出反复晕厥、心电图QT间期延长和多形性室性心动过速、尖端扭转型室性心动过速。Milanesi等[12]也报告了SSS与基因突变之间的关联。在动物模型心脏中过表达可表现出生物起搏活性。研究显示,心动过缓是窦房结中Nkx2.5上调从而导致miR-423-5p上调后抑制HCN4水平的结果[13]。
Shox2通过抑制Nkx2.5的表达激活起搏细胞的基因程序,敲除小鼠因Nkx2.5、Cx40和Cx43的表达增加,以及HCN4、Tbx3和胰岛因子1的表达下调而死于SAN发育不全和起搏细胞增殖减少引起的心动过缓[14]。小鼠胚胎干细胞中过表达外源性可增强Cx45、HCN4和内源性Shox2的表达,并下调Nkx2.5和Cx43[15]。
Nkx2.5是心脏发育的重要转录因子,参与心房、心室和间隔的形成以及心肌细胞的分化与发育[16]。此外,在完全性房室传导阻滞的猪心室中注射过表达的腺病毒载体后,注射区域的起搏活性增强,Nkx2.5和Cx43的表达水平降低,HCN4水平上调[17]。总之,在心脏发育过程中Tbx18、Tbx3和Shox2在窦房结的发育中起协调作用,Shox2抑制Nkx2.5和Cx43的表达同时会上调HCN4、Tbx18和Tbx3等水平。最近研究显示Shox2和HCN4可在窦房结细胞共表达,且二者对心脏起搏发展具有协同作用[18]。所以,在本研究中我们除了选择慢病毒作为目的基因整合入靶细胞的载体外,也进行两个目的基因共表达。本研究通过RT-qPCR和Western blot结果显示,--MSCs组HCN4 mRNA表达量比-MSCs组稍高;-MSCs组高表达Shox2蛋白,-MSCs和--MSCs组中HCN4蛋白明显上调。这表明hUCMSCs可以成功过表达或基因且具有一定的上调过表达作用。
本研究显示,-MSCs组和-MSCs组转染效率为50%~55%,即随着培养时间延长表达荧光的hUCMSCs数量进一步增加,折光性更好。表明慢病毒可以作为感染hUCMSCs的理想载体。共转染时转染效率40%~45%,较单转染效率降低,可能与整合进入细胞内的总载体数量和大小有关。另外,在进行目的基因过表达时,影响慢病毒转染效率的一个关键因素是细胞传代数,对于大鼠原代MSCs,第1代和第5代之间的差异约为8%[19]。而我们在实验中检测到第5代与第7代之间单基因转染效率无差异,可能是本研究所利用的hUCMSCs此前经过永生化处理,细胞传代数影响较小。
本研究具有一定的局限性。首先,本研究只在离体细胞水平上进行了起搏基因修饰,未在动物模型体内进行验证;其次,由于技术层面上的限制与不足,未使用膜片钳确认过表达和的hUCMSCs可以充分激活f电流,以及测定相关的电生理参数如L型钙电流、动作电位时程等;此外,和没有按不同的比例进行共表达处理,无法得到最佳的共表达比率。
综上所述,本研究通过过表达和基因的hUCMSCs经过RT-qPCR和Western blot在细胞分子水平上的检测,证实过表达和后的hUCMSCs具有起搏样细胞表型。这支持了我们通过外源性目的基因转染hUCMSCs诱导生物起搏样细胞生成策略的可行性。但我们还需要下一步在细胞功能学层面进行检测。
[1] Cingolani E, Goldhaber JI, Marban E. Next-generation pacemakers: from small devices to biological pacemakers[J]. Nat Rev Cardiol, 2018, 15(3):139-150.
[2] Li N, Csepe TA, Hansen BJ, et al. Molecular mapping of sinoatrial node HCN channel expression in the human heart[J]. Circ Arrhythm Electrophysiol, 2015, 8(5):1219-1227.
[3] Biel M, Wahl C, Schneider A. Cardiac HCN channels: structure, function, and modulation[J]. Trends Cardiovasc Med, 2002, 12(5):206-212.
[4] Espinoza-Lewis RA, Yu L, He FL,et al. Shox2 is essential for thedifferentiationof cardiac pacemaker cells by repressing Nkx2-5[J]. Dev Biol, 2009, 327(2):376-385.
[5] Wiese C, Airik R, Grieskamp T, et al. Formation of the sinus node head and differentiation of sinus node myocardium are independently regulated by Tbx18 and Tbx3[J]. Circ Res, 2009, 104(3):388-397.
[6] Boyett MR, Yoo S, Inada S, et al. Connexins in the sinoatrial and atrioventricular nodes[J]. Adv Cardiol, 2006, 42:175-197.
[7]叶锦豪, 季杨, 顾杰蕾, 等. 低氧预处理脐带间充质干细胞来源的外泌体对内皮细胞功能的影响[J]. 中国病理生理杂志, 2020, 36(8):1351-1358.
Ye JH, Ji Y, Gu JL, et al. Effects of hypoxic preconditioning of umbilical cord mesenchymal stem cell-derived exosomes on endothelial cell function[J]. Chin J Pathophysiol, 2020, 36(8):1351-1358.
[8] Gao F, Zhao Y, Zhang B, et al. Suppression of lncRNA Gm47283 attenuates myocardial infarction viamiR-706/Ptgs2/ferroptosis axis[J]. Bioengineered, 2022, 13(4):10786-10802.
[9] Ravagli E, Bucchi A, Bartolucci C, et al. Cell-specific dynamic clamp analysis of the role of funny Ifcurrent in cardiac pacemaking[J]. Prog Biophys Mol Biol, 2016, 120(1/2/3):50-66.
[10] Galipeau J, Sensébé L. Mesenchymal stromal cells: clinical challenges and therapeutic opportunities[J]. Cell Stem Cell, 2018, 22(6):824-833.
[11] Ueda K, Nakamura K, Hayashi T, et al. Functional characterization of a trafficking-defective HCN4 mutation, D553N, associated with cardiac arrhythmia[J]. J Biol Chem, 2004, 279(26):27194-27198.
[12] Milanesi R, Baruscotti M, Gnecchi RT, et al. Familial sinus bradycardia associated with a mutation in the cardiac pacemaker channel[J]. N Engl J Med, 2006, 354(2):151-157.
[13] D'Souza A, Pearman CM, Wang YW, et al. Targeting miR-423-5p reverses exercise training-induced HCN4 channel remodeling and sinus bradycardia[J]. Circ Res, 2017, 121(9):1058-1068.
[14] Liu HB, Chen CH, Espinoza-Lewis RA, et al. Functional redundancy between humanand mousegenes in the regulation of sinoatrial node formation and pacemaking function[J]. J Biol Chem, 2011, 286(19):17029-17038.
[15] Ionta V, Liang WB, Kim EH, et al. SHOX2 overexpression favors differentiation of embryonic stem cells into cardiac pacemaker cells, improving biological pacing ability[J]. Stem Cell Reports, 2015, 4(1):129-142.
[16] Wang WJ, Niu ZY, Wang Y, et al. Comparative transcriptome analysis of atrial septal defect identifies dysregulated genes during heart septum morphogenesis [J]. Gene, 2016, 575(2 Pt 1):303-312.
[17] Hu YN, Li N, Liu L, et al. Genetically modified porcine mesenchymal stem cells by lentiviral Tbx18 create a biological pacemaker [J]. Stem Cells Int, 2019, 2019:3621314.
[18] Darche FF, Rivinius R, Köllensperger E, et al. Pacemaker cell characteristics of differentiated and HCN4-transduced human mesenchymal stem cells[J]. Life Sci, 2019, 232:116620.
[19] McGinley L, McMahon J, Strappe P, et al. Lentiviral vector mediated modification of mesenchymal stem cells & enhanced survival in anmodel of ischaemia [J]. Stem Cell Res Ther, 2011, 2(2):12.
Construction of biological pacemaker phenotype cells by overexpressingandin hUCMSCs
WEI Wei, ZHU Ye△, GU Jian-jun, GU Xiang△
(,,,225001,)
In this study, we intend to use lentiviral vectors to transfectandgene into immortalized human umbilical cord mesenchymal stem cells (hUCMSCs), and to explore whether the transfected hUCMSCshave pacing cell-like phenotype.The hUCMSCs were cultured and passaged. Lentiviral vectors carryingandgenes and empty vectors were constructed, andandgenes were transfected to hUCMSCs by lentivirus. Cell viability in each group was detected by CCK-8 assay. The mRNA and protein expression levels of related genes were detected by RT-qPCR and Western blot.(1) The lentiviral overexpression vector was successfully constructed. The transfection efficiency of-MSCs group and-MSCs group was about 50%~55%,--MSCs group was about 40%~45%. (2) The growth rate of cells in the experimental group was slower than that in the control group (<0.05). (3) The mRNA expression levels of HCN4, Tbx18 and Tbx3 in the overexpression group were significantly higher than those in the control group (<0.05), and the expression levels of Nkx2.5 and Cx43 were significantly lower than those in the control group (<0.01). (4) Compared with the control group, the protein level of Cx45 in the single-gene overexpression group was significantly up-regulated and the protein levels of Nkx2.5 and Cx43 were significantly down-regulated (<0.01). The upregulation and downregulation were more significant in the double overexpression group (<0.01).hUCMSCs overexpressingand/orhave pacemaker-like cell phenotype, and the co-transfection has the additive effect of promoting the transformation of hUCMSCs into pacemaker-like cells.
Biological pacemaker; Human umbilical cord mesenchymal stem cells;gene;gene
1000-4718(2022)09-1592-08
2022-04-14
2022-07-19
顾翔 Tel: 18952781166; E-mail: guxiang@yzu.edu.cn; 朱业 Tel: 13773531101; E-mail: 307971331@qq.com
R363.2; R541.7+2
A
10.3969/j.issn.1000-4718.2022.09.008
[基金项目]国家自然基金青年科学基金资助项目(No. 81800250);扬州市“十三五”科教强卫专项经费资助医学重点人才(No. ZDRC20181)
(责任编辑:宋延君,李淑媛)
