实时量化监测型小鼠一氧化碳中毒性缺氧装置的研制*
2022-10-13孙岑岑梅汝焕方瑜厉旭云顾一峰
孙岑岑, 梅汝焕, 方瑜, 厉旭云, 顾一峰
· 实验技术 ·
实时量化监测型小鼠一氧化碳中毒性缺氧装置的研制*
孙岑岑1, 梅汝焕1, 方瑜1, 厉旭云1, 顾一峰2△
(1浙江大学医学院基础医学系,浙江 杭州 310058;2浙江大学医学院附属第一医院,浙江 杭州 310003)
开发一种可实时量化监测小鼠呼吸运动的缺氧装置,实现小鼠一氧化碳中毒性缺氧实验的动态化监测分析。此新型缺氧装置由实验腔、储气装置和超敏呼吸监测仪构成,并以水作为封闭相,提高装置的密封性。通过对比新装置和传统气管插管法得到的呼吸运动监测结果,分析新装置监测数据的可靠性,通过对比采用新、旧装置的教学实验结果,评估新装置的教学成效。(1)该新型缺氧装置记录的小鼠呼吸运动数据与传统气管插管检测结果一致,无显著差异(>0.05);(2)新型缺氧装置测得的小鼠一氧化碳中毒后的存活时间显著短于传统装置组(<0.01),实验成功率[100%(新装置)79%(旧装置)]和结果稳定性[3.61(新装置小鼠存活时间的方差)70.56(旧装置小鼠存活时间的方差)]大大提高,教学效果得到显著提升。本装置实现了小鼠中毒性缺氧过程中呼吸运动的无创化实时监测。该装置具有无创、密封性好、操作简单的特点,可广泛应用于需要短期无创实时监测小鼠呼吸运动的教学实验和科学研究,适用范围广,值得推广使用。
一氧化碳中毒性缺氧;无创实时定量监测;呼吸运动
血液性缺氧动物模型的复制是高等医学大专院校中广泛开展的经典病理生理学实验内容,其中小鼠一氧化碳(carbon monoxide, CO)中毒是必做内容之一[1-6]。目前普遍开展的CO缺氧实验采用目测法,对小鼠CO中毒过程仅停留在定性分析监测[1-6],而CO中毒过程为一动态变化过程,如能实现这一过程中小鼠呼吸运动的量化监测,对CO中毒发病机制的理解和探究及其抢救方法的了解和优化具有重要的教育意义和研究价值[7-11]。
目前普遍采用的缺氧装置通过玻璃空心管向广口瓶中注入CO进而实现小鼠CO中毒模型的建立[5-6, 12-16],但该装置存在很大的局限性和缺陷:(1)缺少量化监测系统,只适用于目测法监测小鼠行为及皮肤、黏膜颜色,无法对其呼吸运动的变化准确监测及量化;(2)密闭性较差,实验常因漏气导致CO中毒模型不典型或失败,影响实验进程和效果。
本文介绍一种新型的可量化监测型气体吸入式缺氧装置(本装置已申请发明专利,专利号:ZL20181014975.8),该装置可实现小鼠呼吸运动的无创实时监测,灵敏度高,密封性好,为CO中毒性缺氧过程的量化记录提供条件,亦为缺氧教学实验的优化和改进提供了参考。
材料和方法
1 实验装置的设计
新型可量化监测型气体吸入式缺氧装置系统由实验腔、储气装置和呼吸监测装置3个部分构成,见图1。

Figure 1. The new mouse CO poisoning hypoxia device. 1: jacketed bottle; 2: mouse room; 3: liquid level; 4: bottom cylinder; 5: inhaul cable; 6: CO store ball; 7: air pipe; 8: hypersensitive respiratory monitor.
1.1实验腔实验腔由套瓶和底筒上下相扣构成,以水做封层封住套瓶瓶口以完全隔绝外界空气,利用水的渗透、黏滞性实现装置的高密封性,解决了传统缺氧装置密封性差的问题;腔内设有一网格状镂空的限制瓶以控制小鼠过度运动,相对增加小鼠的静止时间,避免因剧烈运动引起气流的变化,进而影响记录数据的准确性。
1.2储气装置(1)主体部分呈中空、侧边不等重的半球形;(2)储气半球重心处设置一直杆轴,该轴将储气半球固定于底筒支架的中下部,同时,储气半球侧边连有一拉索,通过牵拉拉索,可使其绕轴180°翻转;(3)储气半球正下方有一CO通气管,经底筒底部与外界相连通。
使用时,在底筒中注入适量的水,储气半球完全浸没在水中,并在重力作用下球面朝上。实验前通过通气管向储气半球内注入一定体积的CO,由于其密度远低于水,CO在水中垂直上浮被拦截并封存于储气半球的空腔中,由于CO难溶于水,故不会泄漏;通过牵拉拉索,储气半球翻转,CO气体被释放到实验腔。由于实验腔内外水相联通,利用气、液联动原理,避免因气体注入而引起的装置内部压力的过度波动,使实验腔保持相对恒压状态,保证实验结果的真实性和监测数据的准确性。
1.3呼吸实时监测量化系统由于实验腔的高密封性,腔内压力的波动可认为由小鼠呼吸时胸廓的扩张和收缩引起,因此监测腔内压力的变化即可实现对小鼠呼吸运动的监测。然而小鼠呼吸运动引起的腔体内压力变化幅度很小,其变化信号无法被常规的呼吸换能器捕捉和记录,故为此设计了超敏呼吸监测仪,该监测仪通过引入超敏呼吸换能器和高灵敏度的生物信号处理系统实现了微量气压变化的准确监测与记录。套瓶顶部与其联通,从而实现了小鼠呼吸运动的实时监测。
设置以下实验对该新装置的使用效果进行验证。
2 实验对象
SPF级8周龄雄性ICR小鼠,(23.0±1.1) g,由浙江大学动物实验中心提供[生产单位:杭州医学院;使用许可证:SYXK(浙)2018-0016;生产许可证:SCXK(浙)2019-0002]。实验过程中所有的操作均符合动物福利的要求。
3 实验材料和仪器
氨基甲酸乙酯(国药集团化学试剂有限公司);钠石灰(H3Ca2NaO4,上海顺强生物科技有限公司);CO气体(杭州民星化工科技有限公司);自制CO中毒模型缺氧装置;RM6240生物信号采集处理系统、呼吸换能器和高敏换能器(成都仪器厂);ABL90 FLEX血气分析仪(Radiometer);温湿度计等。
4 实验方法
4.1新CO缺氧装置对小鼠呼吸运动监测准确性的检测选取10只雄性ICR小鼠[(24.9±1.2) g],用20%氨基甲酸乙酯按5 mL/kg进行腹腔麻醉,置于新型缺氧装置中,记录3~5 min的呼吸运动曲线;后施行颈部手术和气管插管,气管插管与呼吸换能器相连,记录3~5 min的小鼠呼吸曲线。
4.2CO中毒性缺氧过程的呼吸曲线监测选取10只雄性ICR小鼠[(23.5±0.8) g],依次置于新型可量化监测型缺氧装置实验腔内的限制室中,实验前通过底部软管向CO储存球内注入20 mL CO,实验开始后记录一段小鼠的正常呼吸曲线,而后拉动拉索,向实验腔释放CO,记录小鼠CO中毒直至死亡全过程呼吸曲线,处理并分析呼吸运动数据的变化情况。
4.3CO中毒性缺氧的血气分析选取40只雄性ICR小鼠[(23.2±0.6) g]随机均分为4组:正常对照(normal control, NC)组、CO+组、CO-组和乏氧性缺氧(oxygenic hypoxia, OH)组,每组10只。处理方式如下:NC组:小鼠不做任何处理,为快速获得小鼠动脉血,脱颈处死后,采用经皮左心室穿刺取血法抽取动脉血[17],利用ABL90 FLEX血气分析仪测定小鼠动脉血的气体成分;CO+组:小鼠置于新型缺氧装置实验腔的限制室中,参考4.2的操作向实验腔注入并释放10 mL CO,待小鼠死亡,记录小鼠死亡时间并立即按同样方法进行血气分析;CO-组:小鼠置于新型缺氧装置实验腔的限制室中,参考3.2的操作向实验腔注入并释放10 mL空气,10 min后,将小鼠取出脱颈处死并立即取动脉血进行血气分析;OH组:小鼠置于新型缺氧装置实验腔的限制室中,待小鼠死亡后立即抽取动脉血进行血气分析并记录死亡时间。为避免实验腔内CO2含量变化对实验的影响,所有装置实验腔内均放置35 g钠石灰,以吸附小鼠呼吸排出的CO2。
4.4新旧缺氧装置的教学实验效果比较将我校选修生理科学实验课的班级分为A、B两组,各7个班级,每个班级3人一组共10个小组,A、B两组分别采用新旧两种CO缺氧装置开展CO中毒性缺氧实验,CO注入量均为10 mL,分别统计小鼠的存活时间,观察并记录小鼠口唇、肝脏和血液的颜色。
5 统计学处理
用SPSS 16.0软件进行统计分析,用GraphPad Prism 8.0软件绘制统计图。数据均以均数±标准差(mean±SD)表示。组间均数比较采用检验或单因素方差分析。以<0.05为差异有统计学显著性。
结果
1 新装置对小鼠呼吸运动监测的准确性
对呼吸运动进行实时监测通常通过气管插管和呼吸换能器来实现。因此,为检测新装置对小鼠呼吸运动监测的准确性,分别用气管插管和新装置监测小鼠的呼吸运动,比较这2种方式得到的数据。如图2所示,通过气管插管可获得典型的呼吸曲线,小鼠呼吸频率为(222.3±40.9) min-1,呼吸深度为(0.007±0.004) mL/s;利用新型缺氧装置亦能获得比较规律的呼吸曲线,呼吸频率为(207.1±23.6) min-1,呼吸深度为(0.008±0.003) mL/s,这2种方式获得的数据无显著差异(>0.05)。
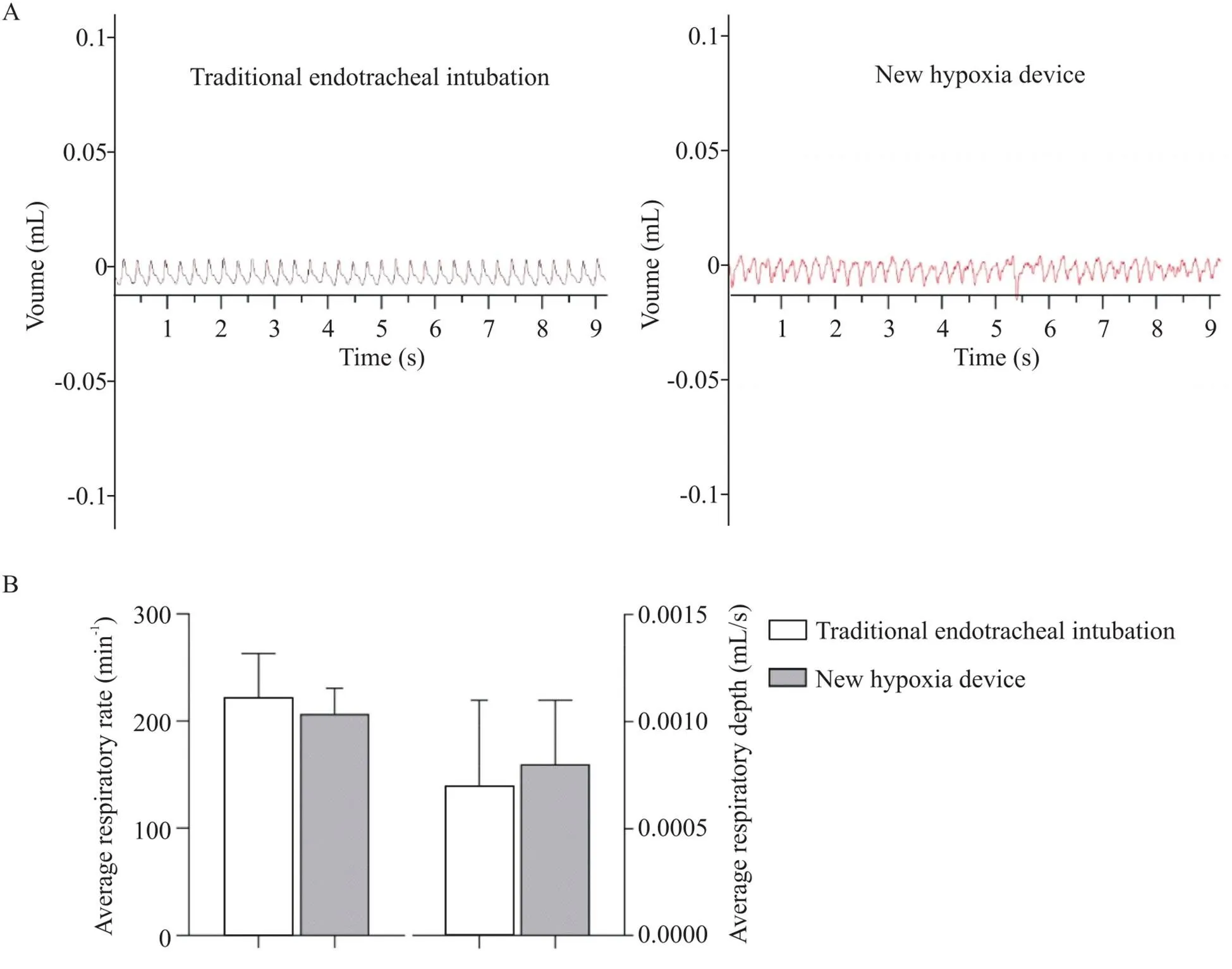
Figure 2. Detection of respiratory movement in mice. A: the breathing curve of the mice was monitored and recorded using the traditional endotracheal intubation and the new hypoxia device; B: the average respiratory rate and the average respiratory depth of the mice measured by different monitor devices. Mean±SD. n=10.
2 小鼠CO中毒性缺氧过程中呼吸运动的监测
利用新装置对小鼠CO中毒过程的呼吸运动变化进行全程监测,结果如图3所示。20 mL CO注入后,小鼠呼吸起初变化不明显,而后逐渐变缓变慢,直至死亡。小鼠呼吸频率分析结果显示,CO吸入0~1 min内,小鼠呼吸频率和呼吸深度略有起伏,但差异无统计学显著性(>0.05),1 min后呼吸频率和呼吸深度显著降低(<0.01),约3 min后呼吸频率降至(27.2±17.7) min-1,呼吸深度降至(0.002±0.003) mL/s,直至小鼠死亡。这说明利用该装置可实现CO中毒性缺氧小鼠呼吸运动变化的全程实时监测。

Figure 3. The changes of respiratory movement in mice with CO poisoning hypoxia. Accompanied by 20 mL CO released into the new hypoxia device, the breathing curve of the mice was record (A), and the average respiratory rate (B) and the average respiratory depth (C) were measured. Mean±SD. n=10. **P<0.01 vs 0 s.
3 小鼠CO中毒性缺氧的血气分析
由于新装置的实验腔为与外界空气完全隔绝的密闭空间,因此为确定实验过程中是否存在由于氧气减少而导致的乏氧性缺氧,设置一系列处理组进行分析。结果显示,CO+组小鼠的死亡时间为(7.5±1.1) min,其动脉血中碳氧血红蛋白分数(FCOHb)较NC组显著增加(<0.01),氧合血红蛋白分数(FO2Hb)显著下降(<0.01),而氧分压(PO2)无显著差异(>0.05),符合典型的血液性缺氧特征;OH组小鼠的死亡时间为(81.0±7.8) min,其动脉血中PO2和FO2Hb均显著下降(<0.01),表现为典型的乏氧性缺氧特征;CO-组小鼠的动脉血各项参数与NC组相比无显著差异(>0.05),无乏氧性缺氧表征,见图4A~D。此外,小鼠皮肤、黏膜、肝脏及血液颜色观察结果亦与血气结果一致,仅在新装置中放置10 min的小鼠未出现明显的乏氧性缺氧表征,见图4D。

Figure 4. The blood gas indexes and signs of mice. A, B, C and D: the arterial blood gas indexes of the mice in different treatment groups; E: observation the colors of skin, mucosa, liver and blood of the mice in different treatment groups. NC: normal mice for control; CO+: the mice were placed in the new hypoxia device with CO released; CO-: the mice were placed in new hypoxia device for 10 min without CO released; OH: the mice were placed in new hypoxia device until death without CO released. Mean±SD. n=10. **P<0.01 vs NC group.
4 采用不同缺氧装置的CO中毒性缺氧教学实验效果比较
为探讨新型CO缺氧装置在实际教学实验中的成效,我们分别采用新旧缺氧装置开展CO中毒性缺氧教学实验课,CO注入量均为10 mL,统计并分析小鼠的存活时间。结果显示,采用传统装置进行的CO缺氧实验,小鼠存活时间为(12.4±8.4) min,且方差较大(70.56),存活时间超过10 min的高达34%,CO释放25 min后仍未死亡的小鼠可认定为CO缺氧实验失败,占21%;而采用新装置进行CO缺氧实验,小鼠存活时间为(8.1±1.9) min,显著低于传统装置组(<0.01),且方差较小(3.61),86.2%的小鼠存活时间集中在3~8 min,且所有小鼠均在10 min内死亡,见图5A、B。此外,采用新装置的所有CO中毒小鼠皮肤、黏膜、肝脏及血液均呈樱桃红色,为典型的CO中毒性缺氧特征,而传统装置组小鼠上述部位的颜色差别较大,25 min内死亡的小鼠大多呈现典型的CO中毒特征,而超过25 min未死的小鼠上述部位的颜色变化不明显,见图5C。这说明新装置大大提高了CO缺氧实验的成功率和实验数据的稳定性。
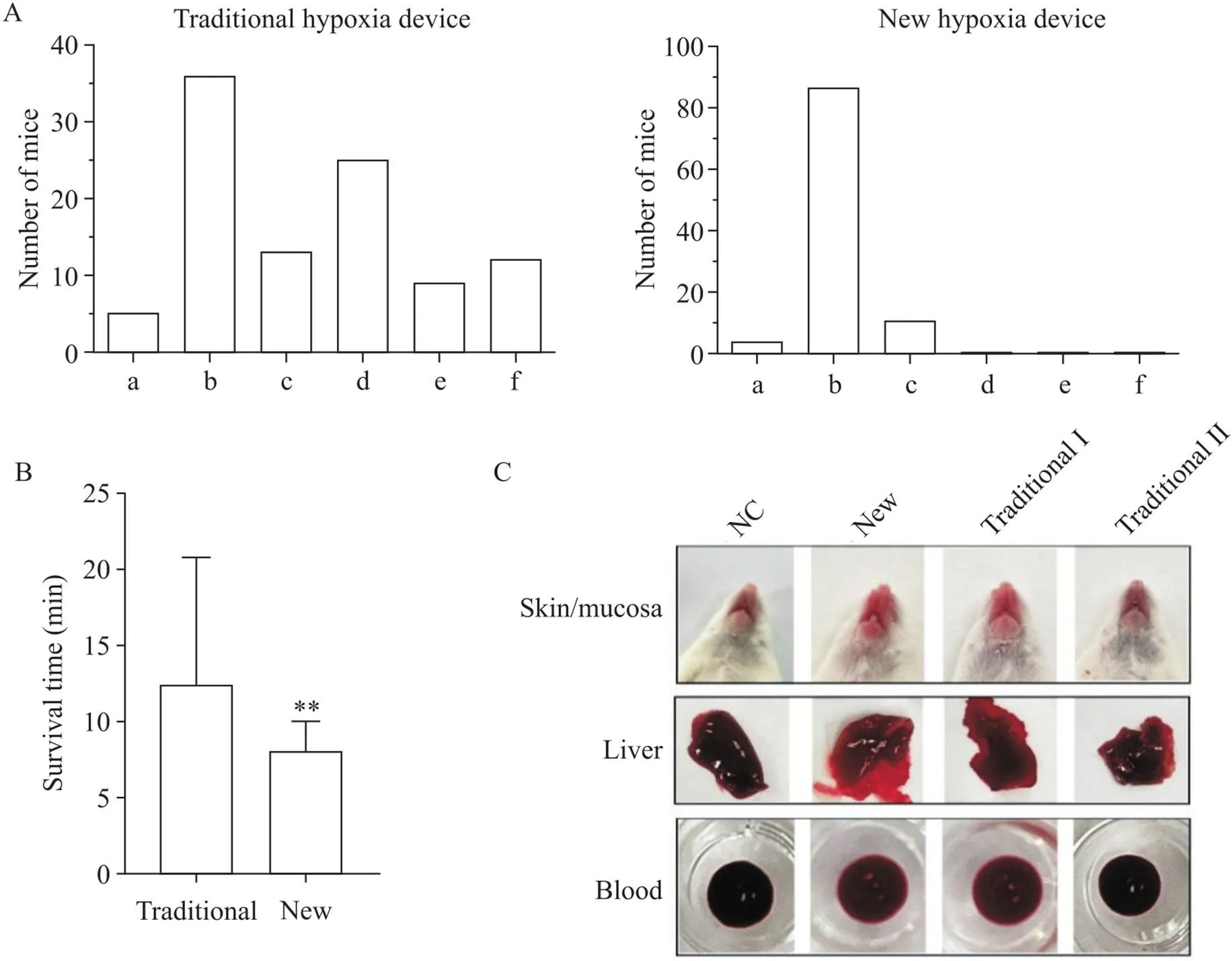
Figure 5. The teaching effectiveness comparison of CO poisoning hypoxia experiments using different hypoxia devices. A: distribution of survival time (t) of CO poisoning mice in different hypoxia devices (a: t≤3 min; b: 3 min
讨论
气管插管法是监测动物呼吸运动的经典方法,通过气管插管和呼吸换能器可较为准确的实时记录动物的呼吸变化,但该方法需进行颈部手术,操作较为复杂,创面较大,因此具有很大的应用局限性。而通过与气管插管法的平行比对,结果显示,本装置记录的呼吸曲线的峰形比较规律,且得到的呼吸频率和呼吸深度数据与气管插管法一致,说明新型缺氧装置可较为准确地记录小鼠的呼吸运动数据。同时,该装置只需将小鼠放入实验腔并连入超敏监测设备后即可实现呼吸运动的实时记录,操作简单且无任何损伤,大大弥补了传统气管插管检测法的缺陷和不足。
缺氧一般分为乏氧性缺氧(低张性缺氧)、血液性缺氧、循环性缺氧和组织性缺氧。其中,乏氧性缺氧是指由于外界氧分压低或呼吸系统通气、换气机能障碍等,引起组织供氧不足,表现为动脉血氧分压、血氧含量和血氧饱和度均降低。血液性缺氧是指由于血红蛋白数量减少或性质改变,血液携氧能力降低,使动脉血氧含量降低或氧合血红蛋白结合的氧不易释出,导致供氧障碍性组织缺氧,而CO中毒性缺氧即属于血液性缺氧,其特征为动脉血氧分压和血氧饱和度正常,血氧含量降低[18]。
本装置虽为密闭容器,小鼠过长时间滞留在实验腔中亦会因氧气减少而造成乏氧性缺氧,但本实验腔容积为500 mL,其氧气含量足以满足体重仅为23 g左右的小鼠存活超过1 h,而CO中毒死亡过程短于10 min,因此在实验过程中容器中含氧量的变化不足以引起小鼠的乏氧性缺氧,而血气实验结果亦给出了数据证明:在新装置中放置10 min的小鼠其动脉血中氧分压和氧合血红蛋白分数均与正常小鼠无显著差异。因此,本装置可较为完美地复制单纯CO中毒性缺氧过程,结果可靠。
本装置以水作为封层,大大提高了装置的密封性,从而提高了实验的成功率和重复性,新旧装置的教学实验结果亦印证了这一点,采用新型装置进行缺氧实验的小鼠,CO中毒死亡时间较为统一,口唇、肝脏和血液颜色等均呈现典型的CO中毒特征,而旧装置实验的小鼠,由于旧装置密闭性不足,CO泄漏情况常常出现,小鼠死亡时间差别较大,皮肤、黏膜、肝脏和血液颜色不典型的出现概率较大。因此,新装置的引入,有效提升了实验教学效果,有利于学生更加直观地认识和理解相关理论知识。
总之,本装置以水作为封层,解决了因装置密闭性不足而引起的CO泄漏问题;以拉索控制储存球中CO释放,实现了CO释放的时间可控性;利用气、液联动原理,通过超敏呼吸换能器和高灵敏度生物信号采集处理系统,实现了对小鼠CO中毒性缺氧全过程的实时监测。新装置大大提高了CO缺氧实验的成功率和稳定性。同时,由于该装置实现了小鼠呼吸运动的无创监测,其使用不仅限于CO中毒实验,其他涉及小鼠呼吸运动监测的教学或科研实验亦可使用[11, 19]。该新型CO缺氧监测装置具有密封性高和无创、实时监测小鼠呼吸运动的特点,使用范围广泛,在实验教学及科研中值得推广应用。
[1]陆源, 夏强. 生理科学实验教程[M]. 2版. 杭州: 浙江大学出版社, 2012:304.
Lu Y, Xia Q. Physiology experimental tutorial[M]. 2nd ed. Hangzhou: Zhejiang University Press, 2012:304.
[2]陈世民. 实验生理科学[M]. 上海: 上海科学技术出版社, 2003:248.
Chen SM. Experimental physiology[M]. Shanghai: Shanghai Science and Technology Press, 2003:248.
[3]王庭槐, 杨惠玲, 汪雪兰, 等. 实验生理科学[M]. 北京: 高等教育出版社, 2014:301.
Wang TH, Yang HL, Wang XL, et al. Experimental physiology[M]. Beijing: Higher Education Press, 2014: 301.
[4]莫书荣. 实验生理科学[M]. 北京: 科学出版社, 2001:152.
Mo SR. Experimental physiology[M]. Beijing: Science Press, 2001:152.
[5]王建红, 古宏标. 医学机能学实验[M]. 北京: 中国医药科技出版社, 2008:167.
Wang JH, Gu HB. Medical function experiment[M]. Beijing: China Pharmaceutical Technology Press, 2008:167.
[6]黄德斌, 李先辉, 丁文文, 等. 医学机能学实验[M]. 北京: 高等教育出版社, 2016:216.
Huang DB, Li XH, Ding WW, et al. Medical function experiment[M]. Beijing: Higher Education Press, 2016:216.
[7]聂云峰. 一氧化碳中毒的防治[J]. 湖南安全与防灾, 2015(2):44-45.
Nie YF. Prevention and treatment of carbon monoxide poisoning[J]. Hunan Safety Disaster Prev, 2015(2):44-45.
[8]任金玲. 一氧化碳中毒患者呼吸异常的观察与护理[J]. 实用医技杂志, 2007, 14(36):5042-5043.
Ren JL. Observation and nursing of respiratory abnormality in patients with carbon monoxide poisoning[J]. J Pract Med Tech, 2007, 14(36):5042-5043.
[9]欧红梅, 张怡萍. 一氧化碳中毒急救护理措施及护理效果分析[J]. 首都食品与医药, 2018, 25(19):75-76.
Ou HM, Zhang YP. Analysis of emergency nursing measures and nursing effect of carbon monoxide poisoning[J]. Cap Food Med, 2018, 25(19):75-76.
[10] 潘晓雯. 一氧化碳中毒与缺氧[J]. 中国实用内科杂志, 2001, 21(3):135-137.
Pan XW. Carbon monoxide poisoning and hypoxia[J]. Chin J Pract Intern Med, 2001, 21(3):135-137.
[11] 丁学琴, 刘贵明, 王俊科, 等. 急性缺氧时内源性一氧化碳的变化及外源性一氧化碳对肺动脉高压的影响[J]. 中国病理生理杂志, 2003, 19(1):87-91.
Ding XQ, Liu GM, Wang JK, et al. The changes in endogenous carbon monoxide during acute hypoxia and the effect of exogenous carbon monoxide on pulmonary hypertension[J]. Chin J Pathophysiol, 2003, 19(1):87-91.
[12] 胡还忠. 医学机能学实验教程[M]. 北京:科学出版社, 2005:195.
Hu XZ. Experimental course of medical mechanics[M]. Beijing: Science Press, 2005:195.
[13] 王慧. 机能学实验[M]. 北京: 科学出版社, 2016:115.
Wang H. Functional experiment[M]. Beijing: Science Press, 2016:115.
[14] 白波. 基础医学机能学实验[M]. 北京: 中国海洋大学出版社, 2008:237.
Bai B. Basic medical function experiment[M]. Beijing: China Ocean University Press, 2008:237.
[15] 王国秋, 刘丽娟. 血液性缺氧实验装置的改进[J]. 锦州医学院学报, 2006, 27(1):17.
Wang GQ, Liu LJ. Improvement of hematological hypoxia experimental device[J]. J Jinzhou Med Coll, 2006, 27(1):17.
[16] 马剑峰, 张尚立, 王丽, 等. 一体式哺乳类动物缺氧实验模拟装置研制与应用[J]. 实验技术与管理, 2016, 33(7):82-86.
Ma JF, Zhang SL, Wang L, et al. Development and application of an integrated simulation device for mammalian anoxia experiment[J]. Exp Technol Manag, 2016, 33(7):82-86.
[17] 吴佩亮, 王良兴, 黄晓颖. 不同动脉血采集方法对小鼠血气分析结果的影响[J]. 温州医科大学学报, 2016, 46(11):793-797.
Wu PL, Wang LX, Huang XY. The effect of different arterial blood collection methods on the results of mice blood gas analysis[J]. J Wenzhou Med Univ, 2016, 46(11):793-797.
[18] 李桂源. 病理生理学[M]. 北京: 人民卫生出版社, 2010:230-232.
Li GY. Pathophysiology[M]. Beijing: People's Health Press, 2010:230-232.
[19] 梁元晶, 吕国蔚. 一氧化碳对缺氧预适应小鼠缺氧诱导因子-1表达的影响[J]. 中国病理生理杂志, 2002, 18(5):47-49.
Liang YJ, Lu GW. Effects of carbon monoxide on expression of hypoxia-inducible factor-1 in hypoxia preconditioned mice[J]. Chin J Pathophysiol, 2002, 18(5):47-49.
Development of a mouse carbon monoxide poisoning hypoxia device with real-time quantitative monitoring function
SUN Cen-cen1, MEI Ru-huan1, FANG Yu1, LI Xu-yun1, GU Yi-feng2△
(1,,310058,;2,,310003,)
To develop a hypoxia device with real-time quantitative monitoring function to realize dynamic detecting and analyzing of carbon monoxide poisoning hypoxia in mice.This new carbon monoxide poisoning hypoxia device was composed of experimental cavity, gasholder, and hypersensitive respiratory monitor, using water seal to improve the leakproofness. The accuracy of the data obtained from the new device was evaluated by comparing with the data obtained from endotracheal intubation. The teaching effectiveness was evaluated by statistical analysis of the data obtained from teaching experiments using new and traditional devices.(1) The respiratory rate and respiratory depth determined by the new hypoxia device were consistent with those obtained from the tracheal intubation (>0.05). (2) The survival time of the mice with carbon monoxide poisoning in the new device was decreased significantly compared with the traditional device (<0.01). The modeling success rate [100% (new device)79% (traditional device)] and data stability [3.61 (variance of survival time of the mice in new device)70.56 (variance of survival time of the mice in traditional device)] were greatly improved, indicating that the teaching effectiveness was enhanced.This device realizes the non-invasive real-time monitoring of mouse respiratory movement in carbon monoxide poisoning hypoxia, which could have a wide range of applications and is worth popularizing and utilizing.
Carbon monoxide poisoning hypoxia; Non-invasive real-time quantitative monitoring; Respiratory movement
1000-4718(2022)09-1722-07
2022-04-24
2022-07-08
15268585770; E-mail: guyifeng@zju.edu.cn
R-331; R364.4
A
10.3969/j.issn.1000-4718.2022.09.024
[基金项目]国家自然科学基金资助项目(No. 82073041; No. 81870207);浙江省自然科学基金资助项目(No. LXR22H160001)
(责任编辑:卢萍,罗森)
