小檗碱对神经病理性疼痛大鼠疼痛行为及IRAK1/TRAF6信号通路介导的神经炎症的影响*
2022-10-13王士珍张晓蕾丁苏彭顾玲玲陈培李广智张萌
王士珍, 张晓蕾, 丁苏彭, 顾玲玲, 陈培, 李广智, 张萌△
小檗碱对神经病理性疼痛大鼠疼痛行为及IRAK1/TRAF6信号通路介导的神经炎症的影响*
王士珍1, 张晓蕾1, 丁苏彭1, 顾玲玲2, 陈培1, 李广智1, 张萌2△
[1江苏护理职业学院解剖生理教研室,江苏 淮安 223005;2徐州医科大学附属淮安医院(淮安市第二人民医院)急诊科,江苏 淮安 223001]
探讨小檗碱对神经病理性疼痛大鼠是否具有疼痛缓解作用,并分析白细胞介素1受体相关激酶(IRAK1)/肿瘤坏死因子受体相关因子6(TRAF6)通路在其中的作用机制。60只SD大鼠随机分为假手术组、脊神经结扎组(模型组)、小檗碱(低、高剂量)组及阳性药物(阿魏酸钠)组,每组12只。对各组大鼠进行动物行为学评估,测定大鼠后足热缩足反射潜伏期(TWL)、机械缩足反射阈值(MWT);六胺银染色观察患侧脊髓背角病理变化;ELISA法检测各组大鼠背根神经节中炎症相关因子肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和IL-6的表达水平;RT-qPCR法和Western blot法分别检测脊髓IRAK1和TRAF6的mRNA及蛋白表达水平。脊髓背角病理切片显示,模型组出现明显的神经元纤维增粗并缠绕成结,且有大量空泡变性,并且神经细胞的胞质出现含有嗜银颗粒的空泡;小檗碱和阳性药物治疗后脊髓背角损伤明显减少。与假手术组相比,模型组MWT和TWL显著降低,大鼠背根神经节中TNF-α、IL-1β和IL-6含量均显著升高,脊髓中IRAK1和TRAF6 mRNA和蛋白表达量显著升高(<0.05);与模型组相比,小檗碱(低、高剂量)组及阳性药物组MWT和TWL显著升高,大鼠背根神经节中TNF-α、IL-1β和IL-6含量均显著降低,脊髓中IRAK1和TRAF6 mRNA和蛋白表达量显著降低(<0.05);与小檗碱高剂量组相比,小檗碱低剂量组MWT和TWL显著降低,大鼠背根神经节TNF-α、IL-1β和IL-6含量均显著升高,脊髓中IRAK1和TRAF6 mRNA和蛋白表达量显著升高(<0.05)。阳性药物组各项指标与小檗碱高剂量组相比均无显著性差异(>0.05)。小檗碱可以抑制IRAK1/TRAF6通路介导的神经炎症反应,减轻神经病理性疼痛大鼠的疼痛反应。
小檗碱;神经病理性疼痛;白细胞介素1受体相关激酶;肿瘤坏死因子受体相关因子6
神经病理性疼痛主要是指中枢神经系统直接损伤所引起的疼痛,其严重影响患者正常的生活活动。神经病理性疼痛发病病因多种多样,其中以机械性损伤最为多见。因该病内在机制尚不明确,故难以对其靶向治疗[1]。目前对于神经病理性疼痛的治疗方法主要有通过常规抗炎药物缓解病痛,或通过作用于神经元,暂时阻断神经传导缓解疼痛,但以上治疗方法均难以有效缓解患者的病情,且都存在一定程度的副作用[2-3]。因此阐明神经病理性疼痛发生发展的内在机理,进而通过调控相关信号通路治疗神经疼痛成为了当前人们研究的重点[4]。研究表明,有多条信号通路参与神经病理性疼痛的调控,其中白细胞介素1受体相关激酶(interleukin-1 receptor-associated kinase, IRAK1)通过神经胶质细胞发挥重要作用,其可以调控中枢神经系统受损引起的神经炎症,诱导神经疼痛[5]。IRAK1与肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6, TRAF6)结合,亦可进一步调控神经炎症[6]。而抑制IRAK1的表达可阻断神经炎症发生发展,进而缓解神经病理性疼痛,因此IRAK1/TRAF6通路往往被视作通过调控神经炎症抑制神经病理性疼痛的重要靶点[7]。
小檗碱又称黄连素,研究表明其具有抗心力衰竭、抗炎症和抗脑缺血等多种药用活性,作为常见的中药而广泛用于治疗脑缺血损伤等疾病[8]。近年来有研究指出,小檗碱可下调炎症因子和凋亡相关因子的表达,减少神经炎症的发生和神经元的凋亡,减轻神经元的损伤,从而发挥保护神经元的作用[9]。但小檗碱神经功能保护作用的具体途径并未明确,其对神经病理性疼痛是否具有治疗作用尚有待验证。本研究以脊神经结扎大鼠模型为实验对象,通过行为学实验、ELISA、RT-qPCR和Western blot实验探究小檗碱对IRAK1/TRAF6神经炎症通路及神经病理性疼痛的影响,以期为靶向治疗神经病理性疼痛药物的研发提供参考。
材料和方法
1 动物
由山东艾莱克生物科技有限公司购得SPF级SD雄性大鼠60只,6~7周龄,体重(220±10) g,许可证号为SCXK(鲁)20190007。所有实验动物均给予24 h昼夜灯光照射控制,并维持温度在24 ℃左右条件下饲养,湿度控制在45%~55%之间。所有实验动物严格遵守3R原则,并通过江苏护理职业学院动物伦理委员会批准。
2 主要试剂与仪器
小檗碱购于成都普瑞法科技开发有限公司;阿魏酸钠(国药准字H20073115)购于成都亨达药业有限公司;von Frey Hair纤维丝刺激针购于上海玉研科学仪器有限公司;mRNA提取试剂盒和基底膜六胺银染色液购于北京索莱宝科技有限公司;反转录试剂盒和RT-qPCR反应体系购于赛默飞世尔科技有限公司;血清肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) ELISA检测试剂盒购于江莱生物科技有限公司;白细胞介素1β(interleukin-1β, IL-1β)ELISA检测试剂盒购于上海酶联生物科技有限公司;IL-6 ELISA检测试剂盒、GAPDH抗体、IRAK1抗体和TRAF6抗体购于Abcam。热测痛仪(Bioserve,北京友诚嘉业生物科技有限公司);荧光定量PCR仪(7500,ABI);凝胶成像系统(ZF-268,上海嘉鹏科技有限公司)。
3 实验方法
3.1动物模型的构建60只大鼠随机分为假手术组、脊神经结扎(模型)组、小檗碱低剂量组、小檗碱高剂量组和阳性药物组,每组12只。参考周晔等[10]造模方法并加以改进,建立脊神经结扎大鼠模型,麻醉各模型大鼠,固定于操作台上,呈俯卧位,剪去背部毛后沿背侧切开皮肤,剥离组织,钝性分离暴露脊神经,造模大鼠在第5脊神经处用5号丝线结扎,缝合后消毒处理,假手术组立即逐层缝合并消毒处理。术后,根据前人研究结果[11-12]及本研究预实验,小檗碱低剂量组大鼠灌胃给予小檗碱50 mg/kg,小檗碱高剂量组大鼠灌胃给予小檗碱150 mg/kg,阳性药物组大鼠灌胃给予阿魏酸钠150 mg/kg,大鼠假手术组、模型组大鼠灌胃给予等体积(10 mL/kg)的生理盐水,每天1次,连续10 d。
3.2机械缩足反射阈值(mechanical withdraw threshold, MWT)检测依据参考文献方法[10],术前2 h、术后3、5、7、10 d将各组大鼠分别置于透明玻璃箱中,箱底部为铁丝网结构。待大鼠适应15 min后,通过下层铁丝网网眼,将特制的von Frey Hair纤维丝刺激针以垂直方向刺激大鼠两侧后肢足底,刺激部位为足底正中心位置,待纤维丝刺激针缓慢接触足底后逐渐用力按压,记录各组大鼠后肢回缩时间,连续检测5次,检测时间间隔为30 s。
3.3后足热缩足反射潜伏期(thermal withdrawal latency, TWL)检测每次MWT检测结束30 min后,将各组大鼠放入透明的有机玻璃箱中,设定热测痛仪并维持辐射热强度,确保大鼠基础值维持在15 s,热辐射照射时间18 s。待大鼠适应15 min后,将辐射热光源对准大鼠足底正中心位置,当大鼠出现缩足时关闭辐射热光源,否则持续照射至18 s。记录各组大鼠缩足反射潜伏期,重复测量3次,检测时间间隔为5 min。
3.4脊髓背角病理检测各组大鼠深度麻醉后,经主动脉迅速灌注200 mL氯化钠溶液(0.9%),接着再灌注4%多聚甲醛溶液,然后将L4~L6断脊髓组织取出,4%多聚甲醛溶液固定,并制成5 µm厚的石蜡切片。切片于60 ℃处理4 h,经过脱蜡、脱水、氧化、洗涤等操作后,使用六胺银在60 ℃的水浴锅中进行染色,30 min左右时切片呈现烟草样黄色或黑色,则染色结束,用蒸馏水洗涤。氯化金进行调色(1~2 min),清洗后加入海波溶液,孵育1 min,用淡绿溶液进行复染(1 min),清洗后进行脱水,封片,最后在显微镜下观察其病理变化(每张切片5个视野)。
采用改良的Campbell-Switzer银染法观察大鼠脊髓背角病理变化[13]。各组大鼠深度麻醉后,经主动脉迅速灌注200 mL氯化钠溶液(0.9%),接着再灌注4%多聚甲醛溶液,然后将L4~L6断脊髓组织取出,4%多聚甲醛溶液固定,并制成5 µm厚的石蜡切片。切片脱蜡后,用水冲洗,在2%氢氧化铵溶液中孵育15~20 min。水冲洗后,将切片转移到碳酸银溶液中,在黑暗条件下孵育40 min。样品在1%柠檬酸中冲洗,在pH 5.0的乙酸缓冲液中浸泡。将硝酸银和乙醛加入溶液中显影几分钟。然后用清水冲洗载玻片,并放入0.5%硫代硫酸钠溶液中几分钟。样品经过水洗和脱水后进行盖滑。使用数字Aperio切片扫描仪扫描染色的切片。
3.5神经节炎症因子检测末次TWL检测后,迅速处死各组大鼠,剥离背部皮肤,暴露脊髓,迅速截取第四至第六脊神经处脊髓,并分离获取两侧背根神经节。脊髓、背根神经节经液氮处理并研磨至粉,将脊髓粉末冻存备用,并取背根神经节粉末进行匀浆,所获匀浆液充分振荡,离心获取上清,按照试剂盒说明书方法检测背根神经节中TNF-α、IL-1β和IL-6的蛋白水平。
3.6脊髓IRAK1和TRAF6 mRNA检测取出冻存备用的脊髓粉末少许,根据试剂盒说明书提取总RNA,反转录成cDNA,上机检测IRAK1和TRAF6 mRNA表达水平。引物序列获自文献,并由广州吉赛生物公司参与合成:GAPDH正义引物为5'-GTGCCAAAAGGGTCATCATCTC-3',反义引物为5'-GGTTCACACCCATCACAAACATG-3';IRAK1正义引物为5'-GCTCCCAGACCCATTCTGAG-3',反义引物为5'-CTCTGGGCTTGGCTTGATGG-3';TRAF6正义引物为5'-GCCCATGCCGTATGAAGAGA-3',反义引物为5'-ACTGAATGTGCAGGGGACTG-3'。
3.7脊髓IRAK1、TRAF6蛋白检测取出冻存备用的脊髓粉末少许,加入含有蛋白酶抑制剂的蛋白裂解液0.5 mL,充分裂解细胞,测定蛋白浓度后经SDS-PAGE分离,转膜。转膜后5%脱脂牛奶溶液室温封闭100 min,加入Ⅰ抗(GAPDH抗体、IRAK1抗体和TRAF6抗体;均1∶2 000稀释),4 ℃孵育过夜。TBST清洗3次,每次3 min。加入Ⅱ抗(1∶1 000),常温孵育40 min,TBST清洗3次,每次3 min。混合发光液A和发光液B,倒于膜上,充分浸泡1 min,吸去多余液体,置于光密度扫描系统下,检测各组条带灰度值。采用ImageJ分析条带灰度值。
4 统计学处理
结果
1 小檗碱对脊神经结扎大鼠MWT和TWL的影响
术前2 h检测,各组间MWT和TWL无显著差异(>0.05);术后3、5、7和10 d,与假手术组相比,模型组MWT和TWL显著降低(<0.05);与模型组相比,小檗碱(低、高剂量)组及阳性药物组MWT和TWL显著升高(<0.05),且小檗碱高剂量组MWT和TWL显著高于小檗碱低剂量组(<0.05),而阳性药物组较小檗碱高剂量组比较,两组MWT和TWL无显著差异(>0.05),见图1。
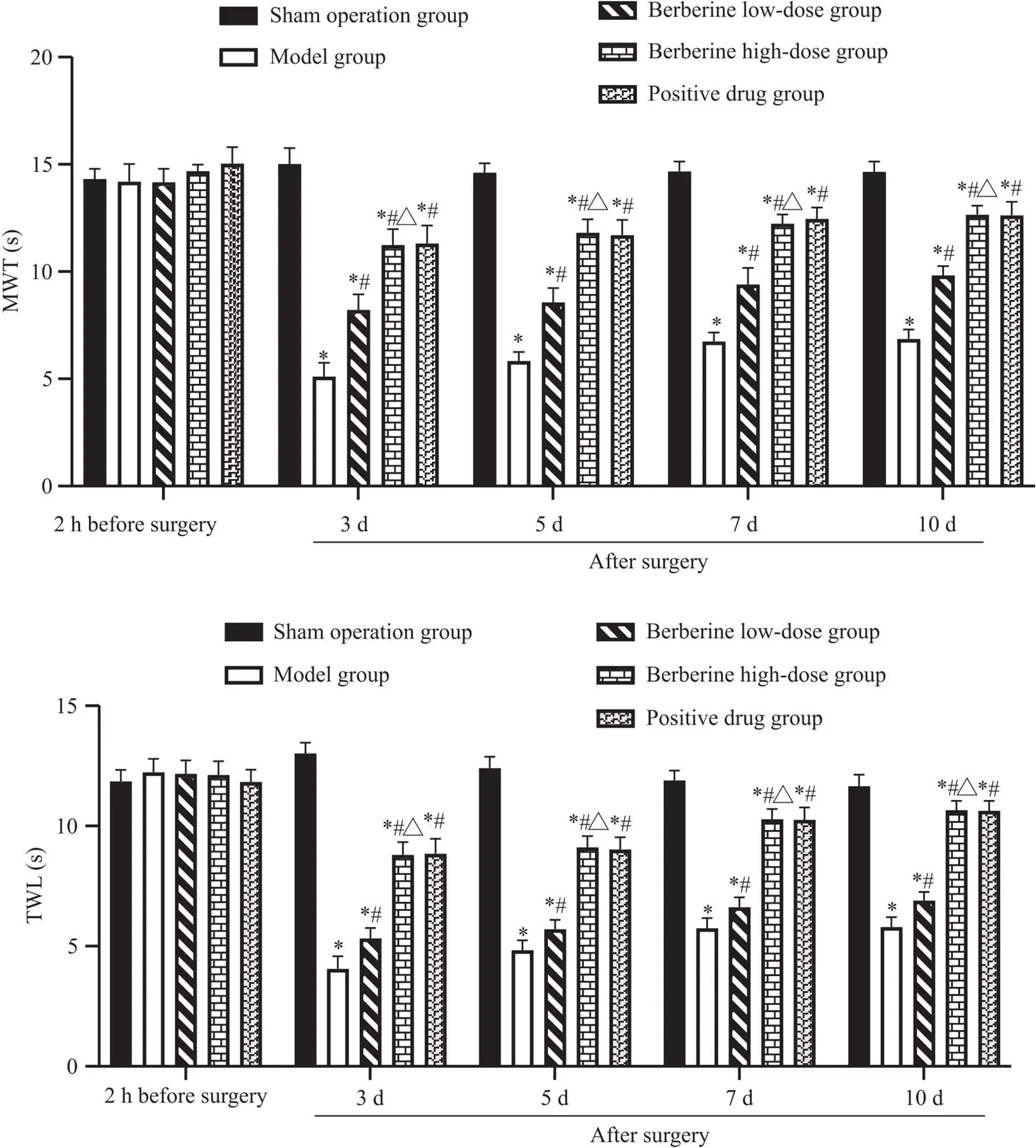
Figure 1. Effects of berberine on MWT and TWL in rats with spinal nerve ligation. Mean±SD. n=12. *P<0.05 vs sham operation group; #P<0.05 vs model group; △P<0.05 vs berberine low-dose group.
2 小檗碱缓解脊神经结扎大鼠脊髓背角病理损伤
假手术组只有极少的空泡样变化,未观察到明显的神经原纤维缠绕和嗜银颗粒;模型组的神经原纤维明显增粗,缠绕成结,为焰状,同时神经元胞质出现含有嗜银颗粒的空泡,说明神经元已坏死,且嗜银颗粒呈现椭圆形或圆形,并成簇分布;相比模型组,阳性药物组、小檗碱高剂量组、小檗碱低剂量组神经元纤维显示较少的缠绕成结和少量的空泡变性,见图2。

Figure 2. Hexamine silver staining to observe the pathological changes of the dorsal horn of the spinal cord in rats. The scale bar=50 μm.
3 小檗碱减轻脊神经结扎大鼠神经炎症
与假手术组相比,模型组大鼠背根神经节TNF-α、IL-1β和IL-6含量均显著升高(<0.05);与模型组相比,小檗碱(低、高剂量)组及阳性药物组大鼠背根神经节TNF-α、IL-1β和IL-6含量均显著降低(<0.05);与小檗碱低剂量组相比,小檗碱高剂量组大鼠背根神经节TNF-α、IL-1β和IL-6含量均显著降低(<0.05),而阳性药物组背根神经节各炎症因子含量较小檗碱高剂量组无显著差异(>0.05),见图3。

Figure 3. Comparison of the contents of TNF-α, IL-1β and IL-6 in the dorsal root ganglion of rats in each group. Mean±SD. n=12. *P<0.05 vs sham operation group; #P<0.05 vs model group; △P<0.05 vs berberine low-dose group.
4 小檗碱对脊神经结扎大鼠脊髓IRAK1和TRAF6 mRNA及蛋白表达的影响
与假手术组相比,模型组大鼠脊髓IRAK1和TRAF6 mRNA及蛋白表达量显著升高(<0.05);与模型组相比,小檗碱(低、高剂量)组及阳性药物组大鼠脊髓IRAK1和TRAF6 mRNA及蛋白表达量显著降低(<0.05);与小檗碱高剂量组相比,小檗碱低剂量组大鼠脊髓IRAK1和TRAF6 mRNA及蛋白表达量显著降低(<0.05),而阳性药物组较小檗碱高剂量组比较,脊髓IRAK1和TRAF6 mRNA及蛋白表达量无显著差异(>0.05),见图4、5。

Figure 4. Comparison of IRAK1 and TRAF6 mRNA expression in spinal cord of rats in each group. Mean±SD. n=12. *P<0.05 vs sham operation group; #P<0.05 vs model group; △P<0.05 vs berberine low-dose group.
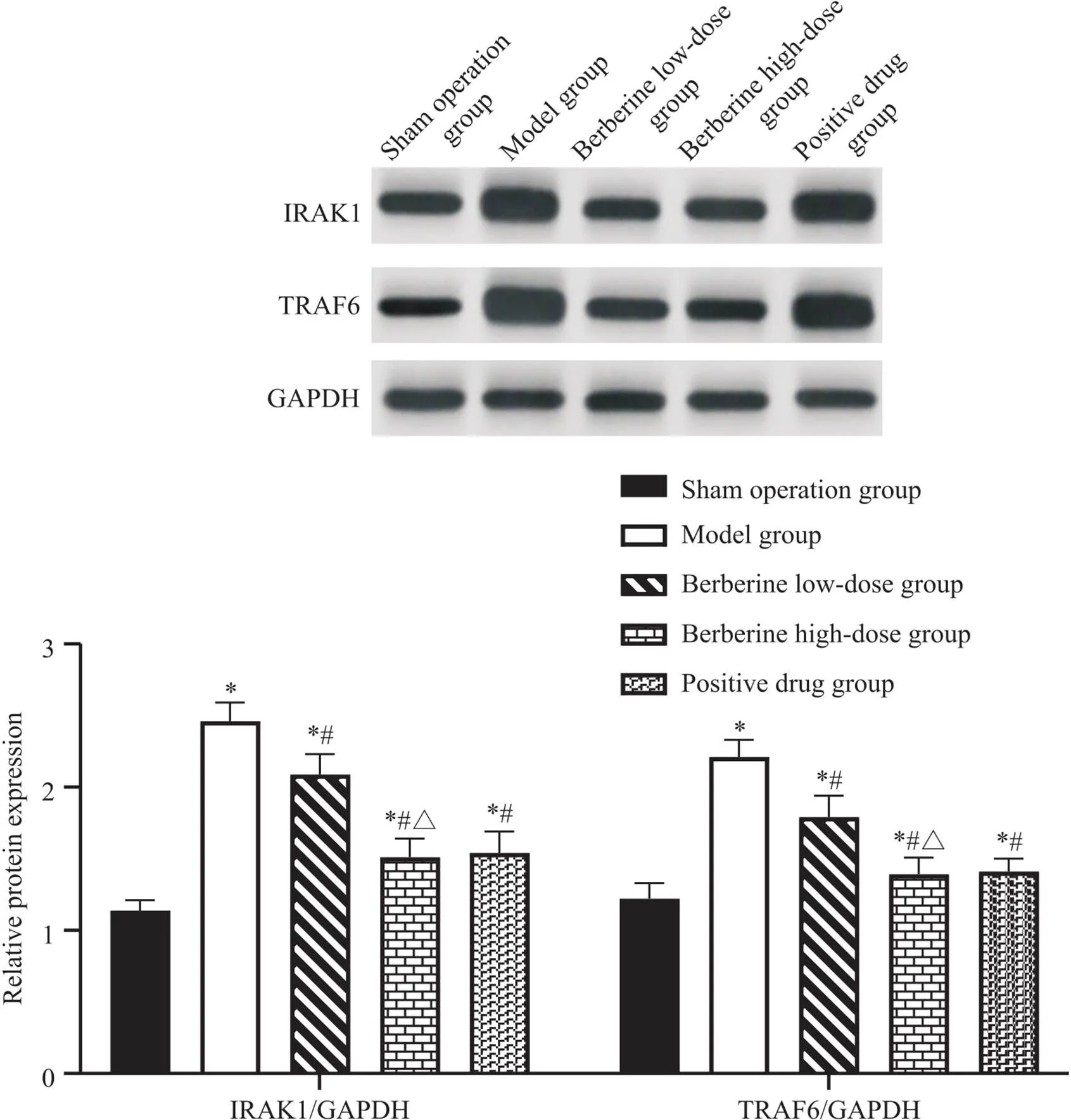
Figure 5. Comparison of IRAK1 and TRAF6 protein expressions in spinal cords of rats in each group. Mean±SD. n=12. *P<0.05 vs sham operation group; #P<0.05 vs model group; △P<0.05 vs berberine low-dose group.
讨论
神经病理性疼痛常指由机械损伤引起的神经疼痛,目前该疾病的治疗方法主要通过消除炎症配合缓解神经疼痛的药物加以治疗[14]。小檗碱作为中药黄连中含量较高的化合物,价格低廉且作用广泛,已被证实具有多种药物活性[15]。因其具有抗菌抗病毒的功效,而被应用于治疗并缓解炎症反应,如小檗碱在治疗脑缺血损伤等疾病时可帮助缓解炎症反应,阻断电压依赖性钾电流,发挥保护神经的作用,从而改善病情[16]。最近有研究显示,小檗碱具有保护神经和避免神经受损的功效,长时间服用一定剂量的小檗碱可以有效缓解突发引起的神经损伤,改善神经功能,且其毒副作用很低[17]。故推测小檗碱可能对机械损伤引起的神经疼痛具有一定的缓解作用。本研究结合参考文献,通过最为有效的脊神经结扎法进行建模,并选用治疗炎症和神经损伤的常规药物阿魏酸钠作为阳性对照开展实验[18-19]。
本研究通过测定MWT和TWL判断疼痛反应及恢复情况,结果显示各组大鼠术前MWT和TWL无显著差异,术后3、5、7和10 d脊神经结扎处理的大鼠MWT和TWL显著降低,说明脊神经结扎引起大鼠疼痛反应,建模成功。不同浓度的小檗碱和阳性药物作用后,大鼠MWT和TWL显著升高,与已有报道一致,说明小檗碱对于神经组织起到了保护作用,减缓了疼痛反应。通过检测炎性因子在背根神经节的表达情况,显示脊神经结扎处理的大鼠背根神经节中TNF-α、IL-1β和IL-6等炎症因子含量显著升高,炎症反应加剧,而不同浓度的小檗碱和阳性药物作用后,大鼠背根神经节中各炎症因子的含量显著降低,表明小檗碱可降低机械损伤引起的神经炎症反应。
IRAK1/TRAF6通路参与炎症反应和神经疼痛调控,成为研究神经病理性疼痛的关键靶点。IRAK1被证实可促进神经炎症反应,脊髓中IRAK1的高表达可增加炎症因子含量,诱导疼痛加剧,而在神经病理性疼痛大鼠模型中,注射干扰IRAK1的siRNA抑制其表达,可显著缓解热痛觉和机械性过敏,减轻神经疼痛[20-21]。TRAF6作为下游影响因子,起到调节和介导信号转导的作用,通过靶向干扰TRAF6的表达可减轻炎症反应,减弱疼痛信号的传导。此外,TRAF6可与IRAK1结合形成复合物共同发挥作用,进一步加剧炎症反应[22-23]。另外,本研究中使用的阳性药物-阿魏酸钠,常用于治疗偏头痛,张爱霞等[24]研究显示,阿魏酸钠能抑制大鼠神经病理性疼痛,其中的机制可能与抑制p38 MAPK信号通路的激活有关,然而阿魏酸钠作为西药,可能会引发过敏性皮疹等不良反应。本研究中,脊神经结扎处理的大鼠脊髓IRAK1和TRAF6 mRNA和蛋白的表达量均显著升高,使用不同浓度的小檗碱和阳性药物处理后,大鼠脊髓IRAK1和TRAF6mRNA和蛋白的表达量均显著降低,表明小檗碱及阳性药物均能通过抑制IRAK1/TRAF6信号通路相关基因的表达,进而减轻其调控的炎症反应和神经疼痛,且两者发挥的治疗作用无显著差异,提示小檗碱对神经病理性疼痛大鼠的治疗作用,可能还涉及其它信号通路,具有成为镇痛药的潜能。
综上所述,小檗碱可以通过升高MWT和TWL,并抑制IRAK1/TRAF6信号通路的途径,减轻神经病理性疼痛,参与影响神经病理性疼痛大鼠的疼痛反应及炎症反应。但由于天然中草药的作用具有多途径、多靶点、多机制的特性,故对于小檗碱在神经病理性疼痛中的治疗作用我们还可以进一步去探究其作用机制,在后续工作中,我们会从神经传导入手,进一步明确小檗碱的在神经病理性疼痛中的作用机理。
[1] Binder A, Baron R. The pharmacological therapy of chronic neuropathic pain[J]. Deutsch Arztebl Int, 2016, 113(37):616-625.
[2] Allison DJ, Agudelo AR, Chan B, et al. Cannabinoids and an anti-inflammatory diet for the treatment of neuropathic pain after spinal cord injury (The CATNP Study): study protocol for a randomized controlled trial[J]. Spinal Cord, 2020, 59(2):112-122.
[3] Zhang P, Sun H, Ji Z. Downregulating lncRNA PVT1 relieves astrocyte overactivation induced neuropathic pain through targeting miR-186-5p/CXCL13/CXCR5 axis[J]. Neurochem Res, 2021, 46(6):1457-1469.
[4] Deguchi R, Fujimoto M, Sekiyama H, et al. Effect of Yokukansan on sleep disturbance and neuropathic pain in chronic constriction injury using a rat model[J]. Sleep Biol Rhythms, 2021, 19(3):277-283.
[5] Dekun Y, Yonglin C, Yao L, et al. Interleukin-1 receptor associated kinase 1 mediates the maintenance of neuropathic pain after chronic constriction injury in rats[J]. Neurochem Res, 2019, 44(5):1214-1227.
[6] Lu Y, Jiang BC, Cao DL, et al. TRAF6 upregulation in spinal astrocytes maintains neuropathic pain by integrating TNF-α and IL-1β signaling[J]. Pain, 2014, 155(12):2618-2629.
[7] Wang Z, Liu F, Wei M, et al. Chronic constriction injury-induced microRNA-146a-5p alleviates neuropathic pain through suppression of IRAK1/TRAF6 signaling pathway[J]. J Neuroinflammation, 2018, 15(1):179-190.
[8] Maleki SN, Aboutaleb N, Souri F. Berberine confers neuroprotection in coping with focal cerebral ischemia by targeting inflammatory cytokines[J]. J Chem Neuroanat, 2018, 87(1):54-59.
[9] Deng H, Jia Y, Pan D, et al. Berberine alleviates rotenone-induced cytotoxicity by antioxidation and activation of PI3K/Akt signaling pathway in SH-SY5Y cells[J]. Neuro Report, 2020, 31(1):41-47.
[10] 周晔, 吴巧云, 屠文展, 等. 电针对神经病理性疼痛大鼠损伤处脊髓背角形态及p38MAPK蛋白表达的影响[J]. 针刺研究, 2020, 45(5):368-372, 378.
Zhou Y, Wu QY, Tu WZ, et al. Effect of electroacupuncture on the morphological changes of the spinal dorsal horn and the expression of p38 mitogen-activated protein kinase in the injured spinal cord of rats with neuropathic pain[J]. Acupunc Res, 2020, 45(5):368-372, 378.
[11] 邱教, 谢兆兰, 李访贤, 等.小檗碱对非酒精性脂肪肝大鼠肝脏脂肪沉积的改善作用及相关机制研究[J]. 中国临床药理学杂志, 2021, 37(4):393-396.
Qiu J, Xie ZL, Li FX, et al. Study on the improvement effect of berberine on liver fat deposition in rats with non-alcoholic fatty liver and related mechanism[J]. Chin J Clin Pharmacol, 2021, 37(4):393-396
[12] 郑颖, 李小华, 李香营, 等. 小檗碱对压力超负荷肥厚心肌组织miR-29b表达的影响及其干预心肌纤维化的作用与机制[J]. 江西医学院学报, 2020, 60(3):31-34.
Zheng Y, Li XH, Li XY, et al. Effects of Berberine on miR-29b expression in pressure-overloaded hypertrophic myocardium and myocardial fibrosis and its mechanism of action[J]. Acta Acade Med Jiangxi, 2020, 60(3):31-34.
[13] Xia Y, Chen Z, Xu G, et al. Novel SOD1 monoclonal antibodies against the electrostatic loop preferentially detect misfolded SOD1 aggregates[J]. Neurosci Lett, 2021, 742(1):135553-135561.
[14] 郭秋岩, 李玮婕, 王超, 等. 乌头汤缓解神经病理性疼痛的炎症网络调控机制研究[J]. 药学学报, 2019, 54(6):1054-1061.
Guo QY, Li WJ, Wang C, et al. Investigation on the inflammation network mechanisms of Wutou decoction acting on neuropathic pain[J]. Acta Pharm Sinica, 2019, 54(6):1054-1061.
[15] 陈润森, 唐凯锐, 梁曙, 等. 小檗碱对NAFLD大鼠肝组织氧化损伤及SIRT1/p53通路的影响[J]. 中国病理生理杂志, 2019, 35(4):725-731.
Chen RS, Tang KR, Liang S, et al. Effect of berberine on oxidative damage and the SIRT1/p53 pathway in liver tissues of NAFLD rats[J]. Chin J Pathophysiol, 2019, 35(4):725-731.
[16] 马竞, 何文龙, 高重阳, 等. 盐酸小檗碱对脂多糖诱导的大鼠急性脑损伤后脑组织形态学和NF-κB活性的影响[J]. 中国免疫学杂志, 2019, 35(21):2582-2586.
Ma J, He WL, Gao CY, et al. Effects of berberine hydrochloride on brain histomorphology and NF-κB activity in rats with acute brain injury induced by LPS[J]. Chin J Immunol, 2019, 35(21):2582-2586.
[17] Yang S, Yu Z, Sun W, et al. The antiviral alkaloid berberine ameliorates neuropathic pain in rats with peripheral nerve injury[J]. Acta Neurol Belg, 2018, 120(3):557-564.
[18] 裴海波, 张富军, 张浩, 等. 脊髓背角星形胶质细胞内PAPR-1/TNF-α通路参与脊神经结扎模型大鼠神经病理性痛的机制研究[J]. 解剖学研究, 2020, 42(1):15-18.
Pei HB, Zhang FJ, Zhang H, et al.Mechanism of PAPR-1/TNF-α pathway in astrocytes of spinal dorsal horn in the neuropathic pain of spinal nerve ligation model rats[J]. Anatomy Res, 2020, 42(1):15-18.
[19] 王臣健, 陈春晓, 徐涛, 等. 阿魏酸钠对大鼠脊髓损伤中NLRP3炎性小体的影响及机制[J]. 中国脊柱脊髓杂志, 2021, 31(8):739-748.
Wang CJ, Chen CX, Xu T, et al.Effect and mechanism of sodium ferulate on NLRP3 inflammasomes in spinal cord injury[J]. Chin J Spine Spinal Cord, 2021, 31(8):739-748.
[20] Martin MU, Kollewe C. Interleukin‑1 receptor‑associated kinase‑1 (IRAK‑1): a self‑regulatory adapter molecule in the signaling cascade of the Toll/IL‑1 receptor family[J]. Signal Transduct, 2015, 1(1/2):37-50.
[21] Yin D, Chen Y, Li Y, et al. Interleukin-1 receptor associated kinase 1 mediates the maintenance of neuropathic pain after chronic constriction injury in rats[J]. Neurochem Res, 2019, 44(5):1214-1227.
[22] Xie P. TRAF molecules in cell signaling and in human diseases[J]. J Mol Signal, 2013, 8(1):7-37.
[23] Chen G, Gao X, Wang J, et al. Hypoxia-induced microRNA-146a represses Bcl-2 through Traf6/IRAK1 but not Smad4 to promote chondrocyte autophagy[J]. Biol Chem, 2017, 398(4):499-507.
[24] 张爱霞, 卢晶, 吴饶平. 阿魏酸钠对神经病理痛大鼠痛觉的改善及对p38MAPK信号通路的影响[J]. 西部医学, 2021, 33(11):1591-1595.
Zhang AX, Lu J, Wu RP.Effect of sodium ferulate on improving pain perception in rats with neuropathic pain and its influence on p38MAPK signal pathway[J]. Med J West China, 2021, 33(11):1591-1595.
Effects of berberine on pain behavior and neuroinflammation mediated by IRAK1/TRAF6 signaling pathway in neuropathic pain rats
WANG Shi-zhen1, ZHANG Xiao-lei1, DING Su-peng1, GU Ling-ling2, CHEN Pei1, LI Guang-zhi1, ZHANG Meng2△
[1,,223005,;2,(),223001,]
To explore whether berberine can relieve pain in neuropathic pain rats, and to analyze the underlying mechanism of interleukin-1 receptor-associated kinase (IRAK1)/tumor necrosis factor receptor-associated factor 6 (TRAF6) pathway.Sixty SD rats were randomly divided into sham operation group, spinal nerve ligation group (model group), (low- and high-dose) berberine groups and positive drug group, with 12 rats in each group. The rats in each group were evaluated by animal behavior, and the thermal withdrawal latency (TWL) and mechanical withdraw threshold (MWT) of the hindfoot in rats were measured. The pathological changes of ipsilateral spinal cord in the affected side were observed by hexamine silver staining. The expression levels of inflammation-related factors, tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-6, in the dorsal root ganglion of rats were detected by ELISA kits. The IRAK1 and TRAF6 mRNA and protein expression levels in spinal cord were detected by RT-qPCR and Western blot, respectively.In the model group, the neuronal fibers were obviously thickened and entangled into knots, with a lot of vacuolar degeneration, and vacuoles containing silver-loving granules appeared in the cytoplasm of the nerve cells. The spinal dorsal horn injury was significantly reduced after berberine and positive drug treatment. Compared with sham operation group, the MWT and TWL in model group were significantly decreased, the levels of TNF-α, IL-1β and IL-6 in the dorsal root ganglion of rats were significantly increased, and the mRNA and protein expression levels of IRAK1 and TRAF6 in the spinal cord were significantly increased (<0.05). Compared with model group, the MWT and TWL in (low- and high-dose) berberine groups and positive drug group were significantly increased, the levels of TNF-α, IL-1β and IL-6 in the dorsal root ganglion of rats were significantly decreased, and the mRNA and protein expression levels of IRAK1 and TRAF6 in the spinal cord were significantly decreased (<0.05). Compared with high-dose berberine group, the MWT and TWL in low-dose berberine group were significantly decreased (<0.05), the levels of TNF-α, IL-1β and IL-6 in the dorsal root ganglion of rats were significantly increased (<0.05), and the mRNA and protein expression levels of IRAK1 and TRAF6 in the spinal cord were significantly increased (<0.05). There were no significant difference in all indicators between positive drug group and high-dose berberine group (>0.05).Berberine inhibits the neuroinflammation via IRAK1/TRAF6 pathway and attenuates the pain response in rats with neuropathic pain.
Berberine; Neuropathic pain; Interleukin-1 receptor-associated kinase; Tumor necrosis factor receptor-associated factor 6
1000-4718(2022)09-1561-08
2022-04-28
2022-07-25
15861780633; E-mail: 807307144@qq.com
R285.5; R741.02
A
10.3969/j.issn.1000-4718.2022.09.004
[基金项目]浙江省医药卫生科技计划(No. 2020358554); 淮安市自然科学研究计划(No. HAB202134)
(责任编辑:李淑媛,余小慧)
