超声多模态影像评价克罗恩病的研究进展
2022-10-12李世岩汪贤臣
李世岩 汪贤臣
克罗恩病(Crohn's disease,CD)属于炎症性肠病亚型,是一种慢性反复发作的胃肠道非特异性肉芽肿性炎,可发生于胃肠道任何部位,尤以末端回肠为主。CD不仅是慢性腹泻的首要病因,也是临床消化系统的常见疾病之一,严重影响患者的生活和心理健康。CD的病因和发病机制尚存在争议,可能与感染、自身免疫、遗传、环境、社会及心理因素有关,也可能是上述多种因素共同作用的结果[1]。CD患者常以消化道症状(腹痛、腹泻、血便等)起病,亦可伴全身症状如发热、消瘦、贫血等,部分可伴有皮肤、黏膜、关节等肠外表现。肠梗阻、肠穿孔、瘘管、腹腔脓肿、肛周脓肿和肛瘘等是CD常见的并发症[2-3]。内镜检查示消化道黏膜呈节段性炎性改变,肉眼观呈纵行溃疡状及鹅卵石样外观。克罗恩病活动指数(Crohn's disease activity index,CDAI)是临床最常采用的评估CD活动性的一项指标,通过患者的临床表现来反映CD的严重程度和疗效,包括一般情况、腹痛程度、腹泻次数、腹部有无包块、肠外有无侵犯、是否服用止泻药物、红细胞比容及体质量等评价指标。CDAI评分≥150分表明CD处于炎症活动期,反之则为缓解期[4]。既往CD的发病率在欧美国家要远高于中国,近十几年来,CD在中国的发病率有明显上升趋势。对CD患者进行全面、准确的评估,掌握疾病的活动情况,选择合适的个体化治疗方案已成为当今CD治疗的焦点[5]。
CD患者会经常出现炎症期与缓解期交替的现象;临床诊治过程中,不同患者疾病的严重程度与临床表现往往不一致,因而治疗方式也不尽相同。内镜检查是目前评估CD较为可靠的方法,但内镜检查存在重复性不高、通过狭窄段肠管困难、近端小肠无法显示、肠外侵犯及并发症情况无法诊断等诸多局限性,需要借助影像学检查发挥补充性诊断作用。CT和MRI可观察胃肠道内外的病变情况,但不适合长时间反复检查以及动态观察[6]。超声(ultrasound,US)检查因具有无创、无辐射、简便、重复性好等优势成为CD患者首选的影像学检查方法。随着超声新技术的发展,US多模态影像在评估CD方面体现了重要的临床应用价值,如二维灰阶US对肠壁厚度的观察、多普勒超声对肠壁炎症活动度的评价等。此外,超声造影(contrastenhanced ultrasound,CEUS)和超声弹性成像(ultrasonic elastography,UE)分别从微循环灌注及组织质地的角度为CD评估提供了重要的影像学信息。本文就US及其新技术在CD评价中的应用进展进行述评。
1 US的技术要点与正常肠管的US表现
US检查前患者需禁食6 h以上。检查时取平卧位,全面扫查整个腹部区域,根据患者体型灵活选用不同分辨力的线阵探头(体型消瘦者)或凸阵探头(体型肥胖者),探头频率范围一般为7~13 MHz。建议采用节段法进行连续性全腹扫查,若发现异常声像图表现,则应重点观察;显示肠管的长轴和短轴切面,并针对异常处肠管进行多帧图像采集,以便更好地显示病变的形态特征和范围,同步存储图像。扫查过程中采用逐步轻加压的方法,避免急剧加压。必要时可使用经阴道或者肛周的扫查方式,以便清晰显示盆腔深部及肛周的异常情况。有学者研究认为口服超声造影(oral contrast-enhanced ultrasound,OCEUS)有助于改善小肠病变的US图像[7],也有研究者主张不采用OCEUS,以便胃肠道处于正常生理休息状态而利于观察[8]。临床上需根据患者的检查条件进行选择,对于胃肠腔气体干扰明显者,可选用OCEUS改善显像效果。
正常肠管管壁的US表现为连续的5层结构,从内向外依次为黏膜层、黏膜肌层、黏膜下层、固有肌、浆膜层(图1)。正常肠壁厚度一般<4 mm,可观察到规律的肠管蠕动。彩色多普勒超声成像(color Doppler flow imaging,CDFI)显示正常肠壁上无明显血流信号或仅见少许血流信号。

图1 正常管壁超声表现(箭头示5层结构,厚度<4 mm,由内向外分别呈高回声、低回声、高回声、低回声、高回声表现)
2 CD的典型声像图表现
CD的主要病理组织学特点为病变常侵犯肠壁全层,病变处肠壁明显增厚变硬,内镜检查可见肠黏膜呈鹅卵石样外观(图2,见插页)。CD典型的US表现为受累消化道管壁明显增厚,黏膜层呈不规则低回声;肠壁层次结构破坏或消失,管壁僵硬,蠕动消失;常可探及肿大的腹腔淋巴结、腹腔积液;病变周围脂肪组织增厚,回声增强,即脂肪爬行征象(图3);伴或不伴有溃疡、瘘管、窦道及脓肿形成。对临床怀疑CD的患者可行US初步筛查,若发现上述典型声像图改变则高度提示CD可能[9]。有报道称US诊断CD的灵敏度可达67%~96%,特异度高达79%~100%[10]。Fraquelli等[11]分别以肠壁厚度>3 mm和>4 mm作为诊断标准进行比较研究,结果显示US诊断CD的灵敏度分别为88%、75%,特异度分别为93%、97%。也有研究认为将肠壁厚度>4 mm作为CD的诊断标准时,其准确性有明显提高[11-14]。
注:CD为克罗恩病
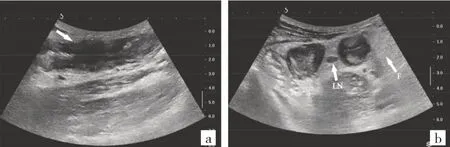
图3 CD的US表现(a:肠管壁显著增厚,箭头示层次结构消失;b:肠管周围脂肪组织回声增强,肠系膜淋巴结肿大)
3 US对CD的评估
3.1 评估CD的活动性二维灰阶US可较为清晰地显示病变处肠壁增厚情况,已被广泛应用于CD活动性的初步评估,有一定临床参考价值。研究发现,当以肠壁增厚>4 mm作为判断CD炎症活动期的指标时,其灵敏度较高(约80%),但特异度较低(38%~50%)[15]。
除了肠壁增厚之外,CD活动期还表现为肠壁内血流信号增多及动脉血管阻力指数减低,且炎症越严重该表现越明显。因此,肠壁血管化程度是判断CD炎症活动期的可靠的方法。相比CDFI,能量多普勒超声(power Doppler imaging,PDI)具有显示低速微小血管的优势,在评估肠壁血管化程度时灵敏度较高[16]。为了提高对肠壁血管化程度评估的重复性,需要规范、统一的评价标准。Limberg评分被用来作为半定量评价CD肠壁血管化程度和肠壁厚度的指标,可分为5型,其中0型指正常肠壁声像,Ⅰ型指单纯肠壁增厚声像(常见于CD缓解期),Ⅱ型指肠壁增厚伴有细小的血管出现(常见于CD缓解期),Ⅲ型指肠壁增厚伴有较长的血管出现(常见于CD活动期),Ⅳ型指肠壁增厚伴有能与肠系膜相连的较长血管(常见于CD活动期)。Limberg分型越高表明炎症活动性越强,该分型已被临床广泛采用[17]。
CEUS通过将微气泡注入静脉血管内来提高血管内声压反射系数,在微泡对比剂所到达部位产生明显高于组织回声的非线性谐波,与二维声像产生明显的对比效果,从而实时动态观察病灶或组织内的微血管灌注情况。在注射对比剂前,应先行二维灰阶US及CDFI扫查定位,再选择感兴趣区进行CEUS检查,通常选定的感兴趣区为肠壁明显增厚处。CD的CEUS增强模式一般有4种类型:肠壁无增强;仅黏膜下层呈高增强;黏膜层、黏膜下层、黏膜肌层呈持续高增强和肠壁全层呈持续性高增强。其中,前两者多见于CD缓解期,后两者多见于CD活动期[18](图4,见插页)。徐大华等[19]跟踪随访的39例CD患者中,有15例炎症活动期CEUS表现为肠壁全层持续性高增强,14例缓解期表现为持续低增强;活动期与缓解期CEUS定量分析曲线的峰值强度及上升斜率的差异有统计学意义(P<0.05),而上升时间、达峰时间的差异无统计学意义(P>0.05)[20-21]。

图4 增厚处肠壁CEUS显示呈显著均匀强化,强化范围累及周围脂肪组织(箭头所示)
3.2 评估CD的并发症
3.2.1 狭窄大约12%~54%的CD患者会发生肠管狭窄。有研究发现,约50%的CD患者在首次确诊后的20年内至少会有1次手术治疗,而肠道狭窄是手术治疗的主要原因[22-23]。灰阶US可准确显示狭窄部位,从而成为不能耐受内镜检查的CD患者的首选检查方法。徐晓蓉等[16]随访的25例CD患者中,US诊断肠管狭窄的准确率与CT相当。肠管狭窄的US表现为受累处肠壁不规则增厚,管腔变窄并常伴有近端肠管扩张。US检查可发现80%以上的肠管狭窄,对于重度狭窄者,其诊断准确率可达90%。
狭窄的肠管需根据其纤维化程度不同来选择不同的治疗方式。临床上,对炎性为主的狭窄患者多采用内科药物治疗,而对纤维性为主的狭窄患者多数需进行内镜下球囊扩张或外科手术切除治疗,因此对狭窄纤维化程度的判断就显得至关重要。UE被广泛应用于评估肝硬化、乳腺结节、甲状腺结节及肾脏纤维化程度,主要包括剪切波弹性超声(share wave elastography,SWE)及应变弹性超声。SWE通过计算剪切波在组织中传播的速度来实时反映组织弹性模量值的彩色编码图,并可测量组织的硬度值[24](图5,见插页)。目前已有研究在动物模型或炎症性肠病患者中证实CD患者可通过UE鉴别炎性狭窄与纤维性狭窄[25]。Chen等[26]以手术病理结果为金标准,应用SWE联合CDFI评估肠壁血管情况以鉴别CD狭窄性质。Lu等[27]研究表明肠壁纤维化程度与SWE剪切波速度呈正相关,而与CEUS曲线峰值强度呈负相关。因此,使用SWE技术评估肠壁纤维化程度可靠性高,有助于鉴别CD患者肠管狭窄的性质,有利于为患者选择合适的治疗方法,避免不必要的外科手术[28-29]。
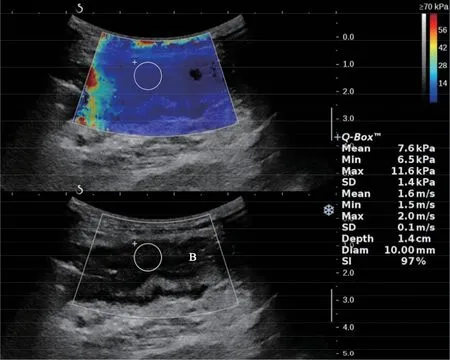
图5 SWE对肠壁硬度质地进行定性及定量分析
3.2.2 瘘管及脓肿US可较为准确地诊断瘘管及脓肿。李少春等[30]对50例CD患者进行随访,结果显示40例有并发症存在;与X线诊断的比较发现,US诊断准确率明显较高(P<0.05)。Paiiotta等[31]研究发现CEUS诊断瘘管、脓肿的灵敏度达96%以上,特异度达90%以上,但由于US存在声衰减的物理特性,对腹腔深部及腹膜后病变诊断的灵敏度相对较低。
3.3 CD患者随访期间的评估由于CD为慢性反复发作的炎症性肠病,其发作期与缓解期常反复交替出现[32]。因此,CD患者需长期随访观察。US检查安全无辐射,对妊娠期等特殊CD患者进行监测有独特的优势。Ribaldone等[33]应用PDI评估CD术后复发,结果显示US结果阳性和阴性患者术后复发率分别为42.0%和28.6%,因此建议对肠壁厚度>5 mm的阳性患者采取积极治疗;而应用CEUS诊断CD术后复发,则可以进一步提高其灵敏度及特异度[34]。
4 US检查的局限性及展望
应用US检查诊断CD也存在一些局限性。胃肠道为空腔含气脏器,正常情况下US无法清晰显像,容易出现漏诊及误诊,尤其是肥胖患者、腹膜后病灶及盆腔深部的显示,更为困难。CDFI容易受肠管蠕动的干扰而产生声学伪像,不利于观察病灶内血流情况。UE、CEUS等评估CD的优势明显,但其成像往往依赖于一定的肠壁厚度,对于肠壁过薄的患者,不易观察肠壁内血流灌注及质地等情况,从而影响对病灶作出准确的判断。
随着科技的不断发展,超声仪器的不断优化,超声新技术的不断出现且广泛运用,US在CD的诊断、评估、随访和治疗中所体现的价值越来越高,将有更多、更可靠的超声影像技术为临床诊疗保驾护航。相信随着时间的推移和技术的进一步发展,今后多模态超声的联合应用将会大放异彩。
