Wnt/β-catenin信号通路在糖尿病性关节炎发病中的作用
2022-10-09刘冬恋张雨晴杨婷何欣宇王玉江
刘冬恋 张雨晴 杨婷 何欣宇 王玉江
(成都医学院四川养老与老年健康协同创新中心,四川 成都 610500)
骨性关节炎(OA)是一种因关节软骨退变、破坏所导致的关节疼痛,以不同程度的活动受限、软骨下骨质硬化、关节周围骨赘形成等为主要表现的关节退行性疾患。由于该疾患病程长且不能根治,病变将随着时间的延长不断破坏关节软骨、滑膜,侵犯软骨下骨质及关节周围肌肉等组织,最终造成关节疼痛症状加重甚至关节生理功能丧失,极大地增加了老年人病残率,对病患的身体健康及生活质量带来严重的影响。对糖尿病患者来说,长期暴露在糖尿病环境中,通过分子和结构水平上的各种机制,会导致骨代谢的改变和骨微结构的受损〔1〕。同时患有OA和糖尿病的人群中,与OA相关的步行困难是糖尿病并发症如高血糖、感染、视网膜病变等出现的一个重要的潜在危险因素。OA患者有限的活动性和避免高强度、高冲击性下肢运动可能会阻止患者遵循健康的活动/运动方案,从而导致血糖控制恶化〔2〕。膝关节OA+糖尿病患者患单侧和双侧膝关节疼痛的可能性分别是膝关节OA+非DM患者的2.45和2.55倍〔3〕。这些研究告诉我们,糖尿病与OA是密切相连的,糖尿病性关节炎是机体功能紊乱的表现,也是糖尿病的并发症之一。
Wnt/β-catenin信号通路主要分为经典信号通路和非经典信号通路,前者是研究的最为广泛的信号通路,控制着不同的生物过程,包括胚胎发育、细胞周期进程、糖原代谢和免疫调节,与癌症、2型糖尿病(T2DM)、炎症、OA和帕金森症等疾病的发生发展密切相关。本文以经典的Wnt/β-catenin信号通路作为研究对象,研究Wnt/β-catenin信号通路在糖尿病性关节炎发病中的作用。
1 T2DM导致糖尿病性关节炎的主要途径
Cannata等〔4〕梳理了高血糖导致OA的主要途径,见图1。一方面,高血糖通过氧化应激,促进肿瘤坏死因子(TNF)-α、前列腺素(PG)E2、白细胞介素(IL)-1β、IL-6、IL-10等促炎症介质的分泌,从而促进基质金属蛋白酶(MMP)-1、MMP-3、MMP-13、含血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS)-4和ADAMTS-5等基因激活发生转录,而这些基因在OA中处于异常激活的状态,参与了OA的发生、发展过程〔5〕。
另一方面,因为关节软骨细胞以糖酵解为主,故而软骨细胞细胞膜内存在大量的葡萄糖转运蛋白(GLUT)。GLUT可诱导并在生理上上调葡萄糖消耗,以便最大限度地摄入葡萄糖。当关节内血糖水平升高,软骨细胞适应局部葡萄糖水平的能力在OA期间丧失,GLUT持续过度表达,可能导致葡萄糖毒性,造成软骨细胞凋亡、自噬和衰老〔6〕。
MMP、ADAMTS等基因的异常激活和葡萄糖毒性造成的软骨细胞凋亡、自噬和衰老,导致了关节胶原合成减少、蛋白多糖分解和软骨细胞活性降低,从而导致OA的发生、发展。因此,T2DM是通过氧化应激和葡萄糖毒性这两个主要途径而导致糖尿病性关节炎。
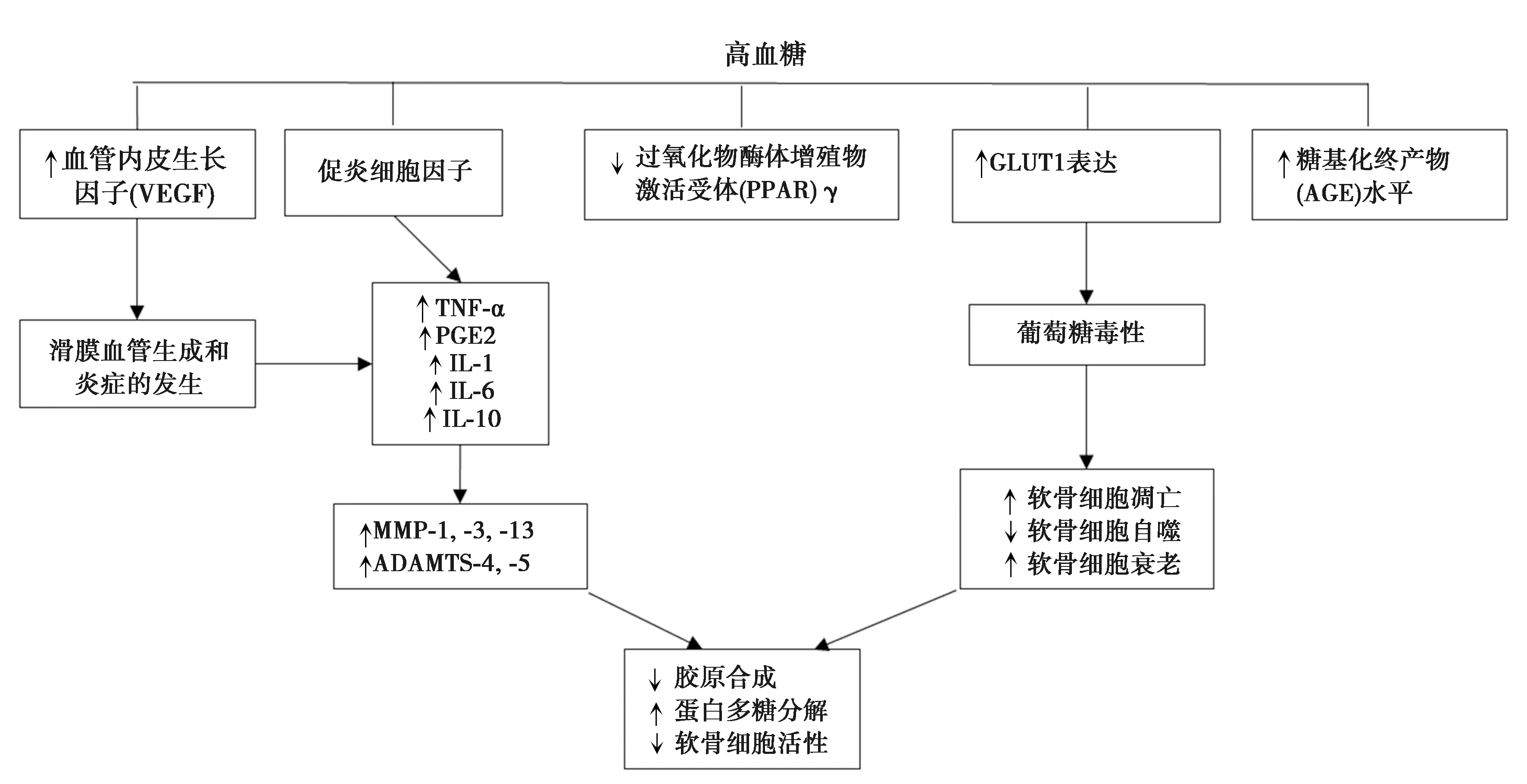
图1 高血糖导致OA的主要途径
2 Wnt/β-catenin信号通路转导过程
在失活状态下,β-catenin与糖原合成酶激酶(GSK)-3β、Axin、结肠腺瘤性息肉病基因蛋白(APC)和酪蛋白激酶(CK)-1形成的复合物结合,使β-catenin磷酸化进而将其降解。当Wnt/β-catenin信号通路被激活时,由Frizzled(FzD)和脂蛋白受体相关蛋白(LRP)5/6组成的受体复合物与Wnt蛋白结合,激活细胞内的Disheveled(Dvl)蛋白,随后,GSK-3β、APC和Axin等组成的破坏β-catenin的复合物被募集到细胞膜上,从而阻止了β-catenin的磷酸化〔7〕。β-catenin的磷酸化被阻止,β-catenin便会在细胞质内聚集,升高的β-catenin进入细胞核,激活淋巴样增强因子(LEF)/T 细胞因子(TCF),进而激活下游的 C-myc、G1/S-特异性周期蛋白(cyclin)D1、MMP-7、survivin、PPAR等下游靶基因〔8〕。
3 Wnt/β-catenin信号通路与T2DM的发病机制相关
胰腺β细胞功能进行性的下降是T2DM发病机制的核心。研究发现,Wnt/β-catenin信号通路在小鼠胰腺的诱导、扩张、模式化和分化等不同阶段均能进行精确的调节〔9〕。小鼠胰腺/胰岛细胞可以分泌多个Wnt亚型蛋白(Wnts),并且胰岛释放的Wnts可能参与糖尿病前期β细胞的调节。Maschio等〔10〕发现,糖尿病前期小鼠胰岛细胞增生,Wnts3a和5b在增生性胰岛中的基因表达明显高于对照组小鼠。Kurita等〔11〕也发现,Wnt4是β细胞中表达最为丰富的Wnts亚型蛋白,高脂高糖饲喂的小鼠胰岛中Wnt4表达上调,提示Wnt4信号转导增加与胰岛素分泌增加和β细胞增殖受损有关。
除了Wnts与T2DM发病机制相关,Wnt/β-catenin信号通路的某些其他环节也发现与T2DM相关。Sacco等〔12〕发现,β-catenin的负调节因子GSK-3β参与了β细胞功能的调节,GSK-3β激酶通过调控β细胞特异性转录因子PDX1而抑制T2DM患者胰岛素的分泌。通过对不同人群的全基因组关联研究发现,Wnt信号通路的关键细胞内效应器TCF转录因子如TCF7L2的基因变异与T2DM有关,高脂饮食饲喂的TCF7L2基因敲除小鼠出现了糖耐量受损、胰岛素敏感性受损、体重增加和脂肪组织质量增加〔13〕。
4 Wnt/β-catenin信号通路与OA的发病机制相关
在人类遗传学研究中,Wnt/β-catenin信号转导相关基因的改变被认为是OA发生的易感因素。Wnt/β-catenin信号通路的异常激活会促进OA的发展,如R-防御素2可以通过促进软骨内的Wnt/β-catenin信号而促进软骨细胞向肥大软骨细胞的分化;关节内注射米安色林可抑制β-catenin的积累,并阻止OA中异常激活的Wnt/β-catenin信号转导〔14〕。因此,Wnt/β-catenin信号在OA的发生发展中起着重要作用,而β-catenin水平的高低是维持软骨内环境稳定所必需的。
当Wnt/β-catenin途径激活后,β-catenin在细胞质中上调并转移到细胞核,在细胞核与TCF结合,使得 C-myc、MMP-3、MMP-9、MMP-13、ADAMTS-4,ADAMTS-5及骨形态发生蛋白(BMP)-2等下游靶基因激活发生转录,这些基因在OA中处于异常激活的状态,参与了OA的发生、发展过程〔15,16〕。
在上述的下游靶基因中,MMP-13作为软骨降解网络中的一个中心节点而最受关注。Yun等〔17〕发现LEF1与β-catenin结合后,直接结合在MMP-13基因的3′-区并且通过使MMP-13启动子DNA构象的改变而反式激活MMP-13启动子。当软骨细胞受到IL-1β的攻击时,LEF1蛋白水平和基因表达增强,导致MMP-13表达增加〔18〕。在OA微环境中,MMP-13存在过度表达,其表达水平与OA的严重程度相对应〔19〕。MMP-13通过降解OA关节软骨和骨中的Ⅱ型胶原发挥作用。目前,已有较多的实验致力于研究MMPs抑制剂用来控制OA的发生发展,但在临床试验中,广谱MMPs抑制剂可能导致一些疼痛和关节僵硬的副作用,称为肌肉骨骼综合征(MSS)。因此,开发选择性MMP-13抑制剂是OA治疗的一个潜在策略〔20〕。
ADAMTS目前发现了19种亚型,其中很多亚型都被发现参与了OA软骨的病理生理过程,这些酶可能在软骨基质合成代谢(如ADAMTS-2、ADAMTS-3和ADAMTS-14)、软骨细胞分化和增殖(如ADAMTS-9、ADAMTS-10、ADAMTS-12)及促进软骨分解代谢(如ADAMTS-7和ADAMTS-12)等各方面发挥作用〔21〕。目前研究得较多的ADAMTS-4和ADAMTS-5被证实在OA软骨细胞中表达增加,通过增加分泌金属蛋白酶而使细胞外基质的Ⅱ型胶原和软骨蛋白聚糖降解增加〔22〕。
5 糖尿病性关节炎的治疗现状
OA主要的治疗方案分为药物治疗和手术治疗。药物治疗选用非甾体类抗炎药、止痛药、关节保护药物及四环素、基质金属蛋白酶抑制剂、炎性细胞因子抑制及记忆治疗等。药物治疗大多属对症处理范畴。手术治疗被公认最有效的为关节镜手术,有创伤性小、恢复快且并发症小的优点,但关节镜对己损伤的关节软骨无法修复,对存在关节畸形的晚期病例基本无效,部分病例在术后较长时间后仍会复发。目前,能根治OA的手术是关节置换术。但是,由于患者T2DM的存在,患者的年龄、体重指数和其他潜在的混杂因素使得术后死亡风险增加,感染率增加〔23〕。那么,抗糖尿病药物是否对糖尿病性关节炎的预后有积极的影响呢?在英国的一项调查研究中发现,3 217例T2DM患者使用二甲双胍治疗时,与T2DM并发症之一的OA的出现没有相关性〔24〕。另一项调查研究也发现,没有证据显示,T2DM患者服用噻唑烷二酮类药物后有改善OA的作用〔25〕。因此,寻找糖尿病性关节炎治疗中存在的潜在靶点,开发能延缓其发生发展的药物,是目前较为迫切的一项研究。
6 Wnt/β-catenin信号通路在糖尿病性关节炎治疗中潜在的靶点
6.1细胞外潜在靶点 在细胞外,Wnt/β-catenin信号通路的激活受不同蛋白质家族的调控,包括分泌型FzD相关蛋白(SFRPs)和Dickkopfs(DKK)。在骨关节疾病中,FzD蛋白的表达谱改变,可能是Wnt/β-catenin信号通路异常激活的原因,SFRPs能与其细胞膜受体FzD蛋白结合,抑制Wnt/β-catenin信号通路的异常激活,从而调节炎症反应和细胞外基质重塑的能力〔26〕。IL-1β会通过介导SFRP4的分泌,抑制胰岛素信号转导,在骨骼肌、脂肪组织和肝脏中引起胰岛素抵抗,导致β细胞衰竭,最终导致T2DM〔27〕。SFRP5则主要通过抑制非经典Wnt/β-catenin信号通路,抑制TNF-α和IL-6的表达,从而减轻炎症反应和胰岛素抵抗〔28〕。
DKK家族是Wnt信号通路中最重要的拮抗剂之一,由脊椎动物分泌的4种蛋白(DKK 1、2、3、4)组成。其通常通过结合和抑制LRP5/6来拮抗Wnt/β-catenin信号传导〔29〕。Theologis等〔30〕对40例56~87岁原发性膝关节OA患者和20名健康人展开研究,发现OA组关节滑液中Dkk-1水平明显高于对照组,说明Dkk-1可能在OA退行性变过程中发挥重要作用。在T2DM方面,T2DM大鼠骨髓间充质干细胞生长活性和成骨分化潜能减弱,可能与DKK-1在骨髓间充质干细胞中的表达增加有关〔31〕。Tsentidis等〔32〕发现Dkk-1表达升高会下调T1D儿童和青少年的Wnt/β-catenin信号通路,使成骨细胞活性降低,破骨细胞信号传导增强,对糖尿病骨病有明显的促进作用。
sclerostin是一种由SOST基因编码,抑制成骨细胞的糖蛋白,主要由骨细胞分泌,受激素变化和骨骼负荷的调节。sclerostin可与LRP5/6结合,阻断Wnt/β-catenin信号通路。在OA的发生发展过程中,sclerostin表达下降,从而促进软骨下骨硬化和增加软骨分解代谢活性而加重小鼠膝关节OA〔33〕。当葡萄糖水平升高,sclerostin的表达增加而抑制骨细胞形成,因此,糖尿病患者成骨细胞的成骨作用可能会降低,从而导致骨密度降低,骨脆性增加〔34〕。
Wnts是一类分泌型糖蛋白,目前在人体中已发现19种。除上述Wnts与T2DM发病机制相关外,Wnts对软骨细胞的增殖分化和骨祖细胞的合成代谢有直接影响,是维持骨骼细胞正常发育的必要条件〔35〕。体外实验显示,Wnt10a对OA患者的滑膜间充质干细胞(SMSCs)有明显的抗衰老作用;Wnt5b显著抑制SMSCs的分化;Wnt5a和Wnt10a可显著增加SMSCs中炎性细胞因子的表达。在OA大鼠模型中,Wnt5a明显加重关节退行性变,而Wnt10a对软骨完整性有轻度的保护作用〔36〕。Ding等〔37〕在人OA软骨中检测到FzD7、Wnt3a蛋白水平的升高。同时,FzD7通过胞外富含半胱氨酸结构域(CRD)与配体Wnt3a结合,以剂量依赖的方式拮抗Wnt3a/β-catenin信号通路,具有软骨保护作用。
综上,在细胞外,Wnt/β-catenin信号通路受不同蛋白质家族的调控,如SFRPs、DKK和sclerostin,进而对T2DM和OA 的发生发展起到调控作用,可作为糖尿病性关节炎的潜在靶点。
6.2细胞质内潜在靶点 在正常细胞的细胞质中,β-catenin与GSK-3β、Axin2、APC和CK-1形成的复合物结合,β-catenin蛋白浓度处于较低水平。GSK-3β是细胞分化和凋亡的重要调节因子,可以调节成骨细胞和破骨细胞之间的平衡,敲除GSK-3β可增加成骨细胞中β-catenin的表达〔38〕。当抑制剂灭活GSK-3β/β-catenin途径时,会抑制MMPs和ADAMTS等下游基因的表达,抑制软骨细胞凋亡〔39〕。在T2DM方面,筛选GSK-3β/β-catenin途径的抑制剂是现在研究的热点,通过药物降低GSK-3β的表达,从而激活Wnt/β-catenin通路,使胰岛β细胞增殖和质量升高,同时修复糖尿病患者的骨代谢紊乱〔40,41〕。
因此,在细胞质内,GSK-3β和β-catenin糖尿病性关节炎的值得关注的靶点。
6.3细胞核内潜在靶点 TCF是Wnt信号通路的关键细胞内效应器,TCF除了上述的与T2DM有关,目前的研究也发现其与OA有关。 某些药物通过抑制小鼠原代软骨细胞TCF/LEF启动子活性而阻止软骨细胞肥大分化,从而阻止软骨进一步降解〔42〕。或通过药物直接靶向β-catenin mRNA而调节β-catenin的表达,降低β-catenin/TCF复合物的相对转录活性,减轻OA小鼠模型的进展〔43〕。
6.4Wnt/β-catenin信号通路下游潜在靶点 β-catenin与TCF/LEF结合后的下游靶基因中,MMP-13、ADAMTS-4和ADAMTS-5除了是OA治疗的潜在靶点,也可能是T2DM治疗的潜在靶点。高糖会通过上调糖尿病性OA患者膝关节软骨细胞MMP-13、ADAMTS-4和ADAMTS-5的表达而激活炎症反应〔44〕。MMPs和ADAMTS是细胞外基质(ECM)的主要分解代谢因子,过度激活会导致ECM中Ⅱ型胶原和软骨蛋白聚糖过度降解,提示软骨早期级联性退变的开始。目前,一些新型抗糖尿病药物如杜拉鲁肽、利西那肽可以抑制MMP-13、ADAMTS-4和ADAMTS-5的表达,对软骨细胞损伤具有很强的保护作用〔45,46〕。
综上,Wnt/β-catenin信号通路在糖尿病性关节炎中起到了至关重要的作用。深入研究 Wnt/β-catenin信号通路对于阐明糖尿病性关节炎的发病机制有重要意义。目前采用针对Wnt/β-catenin信号通路的生物制剂大都停留在细胞或动物模型阶段,开发通过Wnt/β-catenin信号通路作用糖尿病性关节炎的药物,实现从科研到临床的转化,是未来的研究方向。
