干细胞生长因子对动脉粥样硬化大鼠NO、ET-1、MMP-9的影响
2022-10-09王磊方叶青艾文陈之杰邱小燕李华英谢培益
王磊 方叶青 艾文 陈之杰 邱小燕 李华英 谢培益
(华中科技大学协和深圳医院心血管内科,深圳 南山 518000)
动脉粥样硬化(AS)是动脉壁多种细胞遭受各种因素影响出现的慢性炎症发展,是脑梗死和心脏动脉疾病的主要病因〔1〕。动脉血管壁内皮细胞与平滑肌细胞分化增加,诱导多种细胞因子导致血管通透性改变,大量的钙离子穿过血管内膜,增加血管内钙离子浓度,损伤部位形成堆积,诱导疾病产生〔2〕。大量研究发现,颈动脉和冠状动脉是极易出现斑块的部位,导致血液供应不足,如不及时治疗导致多种心脑血管疾病产生,威胁患者生命安全〔3〕。
国内外研究发现,AS的发生发展与机体炎症水平及多种血管因素水平密切相关。基质金属蛋白酶(MMP)-9对细胞的生物活性具有重要作用。对AS发生发展过程中具有重要作用〔4〕。内皮素(ET)-1由多个氨基酸组成的生物活性肽,是调节心血管功能的重要因子。一氧化氮(NO)在血管内皮细胞受到损伤时发挥保护作用〔5〕。干细胞生长因子(HGF)能够诱导血管多种细胞进行分化和增殖,并对受损的心脑血管相关细胞进行修复及再生作用,在动脉粥样硬化中发挥重要保护因子作用〔6〕。本研究旨在探讨HGF对AS大鼠NO、ET-1、MMP-9的影响。
1 材料与方法
1.1动物与分组 SPF级SD大鼠40只,由北京大学生命科学学院提供,10只为正常组,其余大鼠建立AS模型,分为三组,为AS组和HGF1组和HGF2组,AS组不进行HGF干预,HGF1组和HGF2组分别进行剂量为10 mg/(kg·d)和30 mg/(kg·d)的HGF干预,干预时间为12 w。
1.2AS模型建立 AS组和HGF1组和HGF2组在腹腔处注射700 000 U/kg的维生素D,注射3 d后,进行高级饲料喂养〔在给予基础饲料(81%)的方案上添加10%猪油、4%胆固醇、5%白糖〕,正常组喂养基础饲料,建模成功标准:主动脉出现斑块脱落,符合AS病理学特征视为造模完成。造模成功后,HGF1组和HGF2组进行灌胃10 mg/(kg·d)和30 mg/(kg·d)的HGF,其余组灌胃同体积的生理盐水,连续喂养12 w后,处死大鼠,苏木素-伊红(HE)染色观察大鼠主动脉造模情况。
1.3HE染色检测各组胸主动脉病理 各组随机安乐死5只大鼠,提取胸主动脉组织,甲醛固定,酒精透水,PBS透明。石蜡包埋后,24 h后,采用HE染色,按照说明书进行,利用显微镜观察胸主动脉病理变化。
1.4各组血脂检测 各组抽取空腹静脉血2 ml,离心15 min,采用免疫比浊法检测总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的水平。
1.5各组血清中NO、ET-1的水平 将静脉血离心保留血清,采用全自动生化分析仪检测NO、ET-1的水平。
1.6细胞炎性因子检测 各组隔夜清晨无进食时,抽取静脉血,3~5 ml,离心,采用酶联免疫吸附试验(ELISA)测定血清细胞因子白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α水平。
1.7Western印迹检测胸主动脉组织MMP-9蛋白表达 在6孔板中加入100 μg的胰蛋白酶提取液,在注入2 ml的培养基停止消化,再将细胞提取液放入EP管中,并与胰蛋白酶提取液按照1∶100进行混合,再放入冰箱中冷冻10 min。使细胞完全裂变,成为E溶液;在EP管中放入各组胸主动脉组织并按照1∶100比例加入胰蛋白酶提取液2 ml,使细胞完全裂变,成为F溶液;再把E和F溶液以80∶1的体积进行摇匀,配制成工作液,放入37.5℃的保温箱中20 min,冷却后计算MMP-9蛋白的浓度。
1.8统计学分析 采用SPSS22.0软件进行χ2、t检验。
2 结 果
2.1HGF对各组大鼠胸主动脉病理变化影响 正常组结构良好,平滑肌紧致排列,外膜较厚,无病变组织。AS组内皮细胞增厚,血管内皮出现病理改变,厚薄不均匀,呈现平滑肌纤维化趋势。HGF1组血管结构正常,出现内皮细胞脱落较AS组改善。HGF2组血管结构清除,内皮细胞结构好于AS组。见图1。
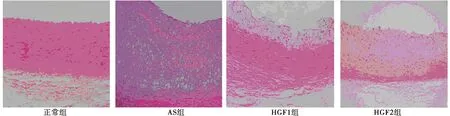
图1 各组大鼠胸主动脉病理变化(HE染色,×400)
2.2HGF对各组大鼠血清中血脂、NO、ET-1、水平的影响 AS组与正常组相比在血脂、NO、ET-1、水平均差异显著(P<0.05),HGF1组与AS组TC、LDL-C、NO、ET-1指标上有明显差异(P<0.05),HGF2组与HGF1组TG、TC、HDL-C及LDL-C、NO水平均差异显著(P<0.05)。见表1。
2.3HGF对各组大鼠血清中IL-6、TNF-α水平的影响 与正常组相比,AS组IL-6、TNF-α水平均明显升高(P<0.05),与AS组比较,HGF1组和HGF-2组IL-6水平均明显下降,且HGF2组明显低于HGF1组(P<0.05),HGF2组TNF-α均明显低于HGF1、AS组(P<0.05)。见表1。
表1 HGF对各组大鼠血清中血脂、NO、ET-1、炎症因子水平的影响
2.4HGF各组胸主动脉组织中MMP-9蛋白水平的影响 AS组MMP-9蛋白水平(0.86±0.13)明显高于正常组(0.25±0.03,P<0.05),与AS组相比,HGF1组、HGF2组水平MMP-9蛋白(0.71±0.09,0.43±0.06)明显低于AS组(P<0.05),HGF2组明显低于HGF1组(P<0.05)。见图2。
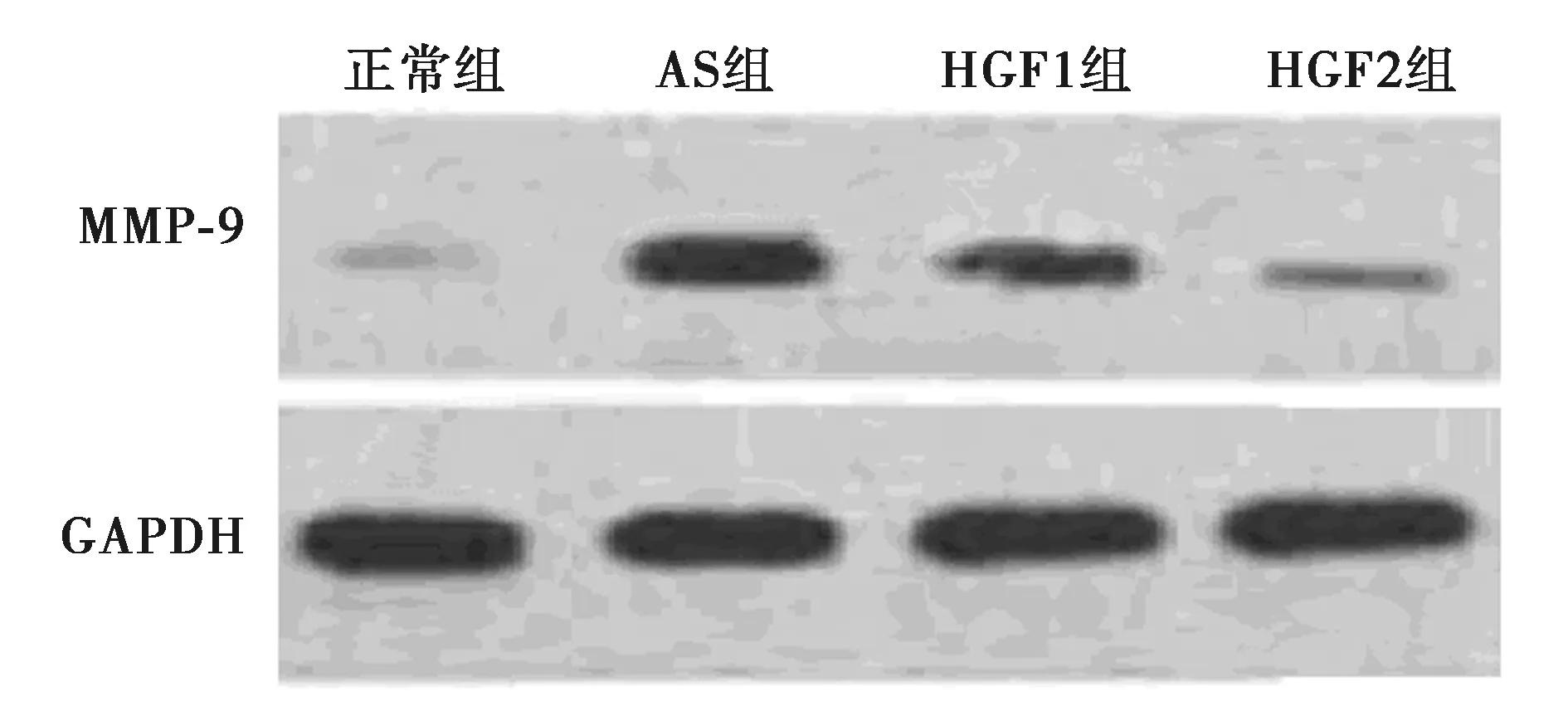
图2 各组大鼠组织中MMP-9蛋白表达
3 讨 论
AS的形成较复杂,经过医学研究人员的不断探索,先后提出多种病理,如内皮质、血脂、炎症水平相关等〔7,8〕。但是目前研究认为该疾病的形成与多种原因共同导致有关,临床多采用口服抗凝药物治疗,但是该种药物血液浓度较低,长时间服用,耐药性增加〔9〕。
HGF具有强烈的促进血管生成作用,是神经系统首选药物〔10〕。研究表明,HGF能够促进心肌细胞的有丝分裂,对损伤血管有提高血液流速的作用,加快心脏供养能力的恢复,加快损伤器官的血液供应〔11〕。本研究说明HGF能够降低大鼠的血脂,具有缓解病情作用。血脂代谢功能失调与AS的发生、发展具有相关性〔12〕。动物实验表明,AS模型大鼠采用高级饲料喂养,发现血脂水平急剧升高,并在大鼠动脉观察有脂质颗粒沉积,说明两者之间呈现正相关〔13〕。模型大鼠血管内皮损伤加剧,肾素-血管紧张素-醛固醇系统(RAAS)水平升高,HGF能够修复受损的血管内皮细胞,降低RAAS水平,降低血脂水平。杨婷等〔14〕研究发现HGF能够改善冠状动脉粥样硬化大鼠血清的血脂水平,与减少单核细胞增加损伤血管内皮,缓解病情。这与杨清等〔15〕研究结果相似。
斑块中的巨噬细胞具有调节炎症介质的作用,多种细胞因子水平上升,而当血管内皮功能障碍时,血管收缩反应严重,ET-1水平升高时会导致血管内血小板大量增殖及聚集,有研究发现当对使用ET-1拮抗剂时NO表达上升,并抑制斑块形成〔16〕。说明ET-1和NO表达及作用具有负相关性。HGF通过对可以通过修复损伤血管内皮,增加血液微循环,并诱导多种效应蛋白表达,减少血管炎症反应,降低IL-6及TNF-α水平〔17〕。Luo等〔18〕研究发现HGF生物活性较广泛,有效改善血管壁变薄,并随着HGF浓度的升高,ET-1水平逐渐减少,NO水平升高发挥保护血管功能,改善病情。这与本文研究结果相似。大量研究证实,AS患者体内血清中MMP-9表达活跃,如不及时控制会导致斑块的损伤及破裂〔19〕。HGF能够通过抑制斑块形成,减少血管内皮损伤降低MMP-9水平,这与赵晟昊等〔20〕研究结果相似。
