益母草碱对Aβ1~42所致老年痴呆大鼠大脑保护作用及机制
2022-10-09柯莉方登富潘飞豹蒋世杰
柯莉 方登富 潘飞豹 蒋世杰
(遂宁市中心医院,四川 遂宁 629000)
阿尔茨海默病(AD)世界范围内患者已逾1亿,且随着人口老龄化程度加深,AD发病率居高不下〔1,2〕。AD的β淀粉样蛋白(Aβ)级联是其研究领域最广泛的假说,相关研究显示,AD患者细胞非正常凋亡与大脑神经元丢失密切相关,而Aβ过量积累会促进细胞凋亡〔3〕。单磷酸腺苷活化蛋白激酶(AMPK)作为机体新陈代谢重要的参与者,在生化反应过程中能够保持外界能量平衡。临床学者认为,激活AMPK有利于修复脑卒中患者受损细胞〔4〕。同时AMPK与内皮型一氧化氮合酶(eNOS)磷酸化水平呈正相关,这对神经再生和修复具有积极意义〔5〕。益母草碱(LEO)是唇形科植物益母草的主要成分之一,具有抵抗血小板凝聚、舒张血管、促进血液循环等生理功能,在保护急性心肌缺血、脑缺血等方面的优势已经得到证实〔6〕。但目前尚无关于LEO对Aβ1~42诱导的老年性痴呆大脑保护机制的相关报道。本研究探究LEO对Aβ1~42致痴呆大鼠脑保护作用及机制。
1 材料与方法
1.1实验动物 SPF级雄性SD大鼠购自成都百裕制药股份有限公司〔许可证号:SYXK(川)2019-222〕,体重为180~220 g,遂宁市中心医院动物实验中心饲养,常规饲养,温度、湿度适宜,循环光照12 h,构建模型前禁食12 h。常规饲养1 w以适应实验环境,第2周开始实验流程。
1.2主要试剂 LEO( 批号为:TZ18938,纯度>98%)购自西安通泽生物科技有限公司;尼莫地平注射液(NMDP,上海信宜金朱药业有限公司,批号为:国药准字H20057745);TUNEL试剂盒采购自Sigma公司;二氨基联苯胺(DAB)化学发光试剂盒采购自天津祥盛通达生物有限公司;酶联免疫吸附试验(ELISA)试剂盒采购自美国abcam公司;p-AMPK、p-eNOS和核转录因子(NF)-κB抗体采购自美国Sigma公司,戊巴比妥钠购自上海恒远生物技术有限公司,p-AMPK、p-eNOS和NF-κB抗体(美国abcam公司)购自美国PALL公司,冰冻切片包埋剂采购自美国樱花公司,Western印迹试剂盒购自北京博凌科为生物公司。
1.3模型构建及分组构建 模型前适应性喂养SD大鼠1 w,使用1% 戊巴比妥钠麻醉Model组、LEO组、NMDP组,麻醉起效后常规消毒铺巾,剔除大鼠头顶毛发并清洁皮肤,头顶部做纵向2 cm伤口,使用镊子分离骨膜充分暴露颅骨,海马CA1区应用脑立体定位仪定位〔7〕,将颅骨打开:以前囟后 3.3 mm、中线1.5 mm、硬脑膜下3.0 mm,采用微量注射器向每侧注射2 μl微量孵育好的Aβ1~42溶液,为了规避药物外渗,注射完成后需留针5 min。切口缝合后消毒。切开Sham组硬脑膜后注射生理盐水2 μl,其他流程与上述操作一致。模型构建完成3 h后,LEO组腹腔内注射LEO 50 mg/kg,NMDP组腹腔注射NMDP 50 mg/kg,注射剂量为10 ml,1次/d,Sham组、Modle组腹腔给予等量生理盐水,连续注射14 d。
1.4大鼠学习记忆能力检测跳台实验〔8〕跳台装置为10 cm×10 cm×30 cm长方形反射箱,用黑色塑料板分隔成为5间。底面是可通电的不锈钢网栅,设立橡胶站台,大鼠不离开不锈钢网栅则会遭受电击。进行3 d连续实验,第1天为适应阶段,将大鼠面向墙角置于站台上,网珊不通电,适应环境5 min。第2天为学习阶段,大鼠面向墙角轻轻放置于站台上,然后通以36 V交流电,持续5 min。若动物跳下站台则受电击,其正常反应应该是跳回站台,记录每只大鼠跳台失败次数;第3天为实验阶段,记录4组第一次受到电刺激及首次跳下站台的时间。
1.5大鼠大脑皮层血流变化监测 跳台试验完成后,使用激光散斑成像检测4组大脑皮层血流变化,使用0.3%戊巴比妥钠成功麻醉后,获取5组额定皮层600 s实时图像,将内源成像孔与Baumer相机连接,观察大脑皮质血流灌注量变化情况,并使用散斑软件计算皮层血流差异。
1.6大鼠脑组织神经元形态 苏木素-伊红(HE)染色观察检测大鼠脑组织中细胞凋亡情况,取部分脑组织,采用多聚甲醛固定,制备4 μm的切片,进行HE染色,采用光学显微镜观察痴呆大鼠脑组织神经元的形态变化。
1.7大鼠脑组织中的细胞凋亡 采用TUNEL染色评估大鼠脑组织细胞凋亡率,取部分脑组织,常规固定后,用60℃恒温烤箱烘烤石蜡脑组织切片3 h,二甲苯脱蜡完成后、梯度浓度酒精脱水处理,分别使用不含DNase的蛋白酶K、磷酸盐缓冲液(PBS)完成消化,冲洗后,放入3% H2O2溶液中黑暗常温孵育,依次完成PBS冲洗,生物素标记,分别用DAB、苏木素显色、染色,持续脱水至切片透明,封固完成后,使用显微镜观察并留存照片。以完整非重叠的5个高倍镜(×400)视野计算同一切片的细胞凋亡指数。细胞凋亡指数(AI)=凋亡细胞数/总细胞数× 100%,取其均值。
1.8大鼠脑组织中IL-1β、IL-6 和 TNF-α的水平 将细胞裂解液加入部分脑组织中,离心取上层清液,根据ELISA 试剂盒操作说明检测IL-1β、IL-6 和 TNF-α的水平。检测完成后,在450 nm处OD值应用采用酶标仪测量。
1.9大鼠脑组织中NF-κB的核移位 取部分脑组织石蜡切片,按照免疫荧光的试剂盒说明书:60℃恒温箱中烤2 h,待恢复室温后脱水、脱蜡、抗原修复处理,1%牛血清白蛋白(BSA)、一抗体中、二抗中分别封闭20 min、孵育1.5 h、孵育30 min,操作中选择PBS洗涤,荧光显微镜观察NF-κB的核移位现象,平均光密度应用图片分析程序测定。
1.10大鼠脑组织中p-AMPK、p-eNOS和NF-κB的表达采用Western印迹检测 在裂解液中加入部分脑组织,加入裂解液,冰上放置20~30 min,超声裂解30 s,12 000 r/min,4℃离心10 min,收集上清,置于-20℃保存。收集组织液中总蛋白,采用二喹啉甲酸(BCA)试剂盒说明书测定总蛋白表达水平,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)完成后,展开转膜、封闭流程,稀释后的p-AMPK、p-eNOS和NF-κB蛋白一抗添加完成后,在4℃恒温条件下孵育过夜,加入标记辣根过氧化物酶(HRP)的羊抗鼠二抗,常温条件下2 h孵育完成后,磷酸盐吐温缓冲液(PBST)洗膜,增强化学发光(ECL)显影后黑暗下曝光拍照,内参选择GAPDH。
1.11统计学分析 采用SPSS16.0软件进行单因素方差分析和t检验。
2 结 果
2.1各组学习成绩和记忆成绩 4组学习和记忆成绩差异有统计学意义(P<0.05);Model组学习成绩高于sham组,记忆成绩低于Sham组,差异具有统计学意义(P<0.05);LEO组学习成绩低于Model组,记忆成绩高于Model组,差异具有统计学意义(P<0.05);LEO组与NMDP组比较,差异具有统计学意义(P<0.05),见表1。
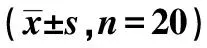
表1 各组学习记忆能力、脑皮层血流灌注量、脑组织细胞凋亡率、IL-1β、IL-6和TNF-α的水平的比较
2.2激光散斑成像检测大脑皮层血流变化 4组大脑皮层血液灌注量差异明显(P<0.05),Model组大脑皮层血流灌注量显著少于Sham组(P<0.05),LEO组、NMDP组大脑皮层血流灌注量显著多于Model组(P<0.05),LEO组与NMDP组比较无明显差异(P>0.05),见表1、图1。
2.3各组脑海马区形态学的比较 HE 染色结果显示,Sham组海马区神经元细胞核较大且细胞结构完整、规律排列,细胞形态正常;Model组海马区神经元细胞细胞核染色模糊且结构大小不一,排列不规则,细胞核缩小且出现较多的凋亡的神经元。LEO组可明显减少神经元丢失,改善神经元异常形态;NMDP组与LEO组海马区神经元结构相似,见图2。
2.4TUNEL染色观察脑组织中细胞凋亡 4组脑组织中细胞凋亡率均具有明显差异(P<0.05),Model组细胞凋亡率显著高于Sham组(P<0.05),LEO组、NMDP组细胞凋亡率显著低于Sham组(P<0.05),LEO组与NMDP组凋亡率比较无明显差异(P>0.05),见表1、图3。
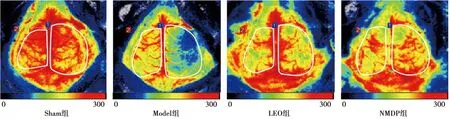
图1 各组脑皮层血流灌注量

图2 各组脑海马区形态学的比较(×200)

图3 TUNEL染色检测各组脑组织细胞凋亡(×400)
2.5ELISA 法检测脑组织中IL-1β、IL-6和TNF-α的水平 4组脑组织中IL-1β、IL-6和TNF-α均具有明显差异(P<0.05)。Model组IL-1β、IL-6和TNF-α水平显著高于Sham组(P<0.05),LEO组、NMDP组IL-1β、IL-6和TNF-α水平显著低于Model组(P<0.05);LEO组与NMDP组差异无统计学意义(P>0.05),见表1。
2.6免疫荧光检测脑组织中NF-κB的核移位 4组脑组织细胞内NF-κB核移位荧光强度具有明显差异(P<0.05)。Model组NF-κB核移位荧光强度强于Sham组,LEO组、NMDP组NF-κB核移位荧光强度弱于Model组,差异均具有统计学意义(P<0.05);LEO组与NMDP组无明显差异(P>0.05),见图4、表2。
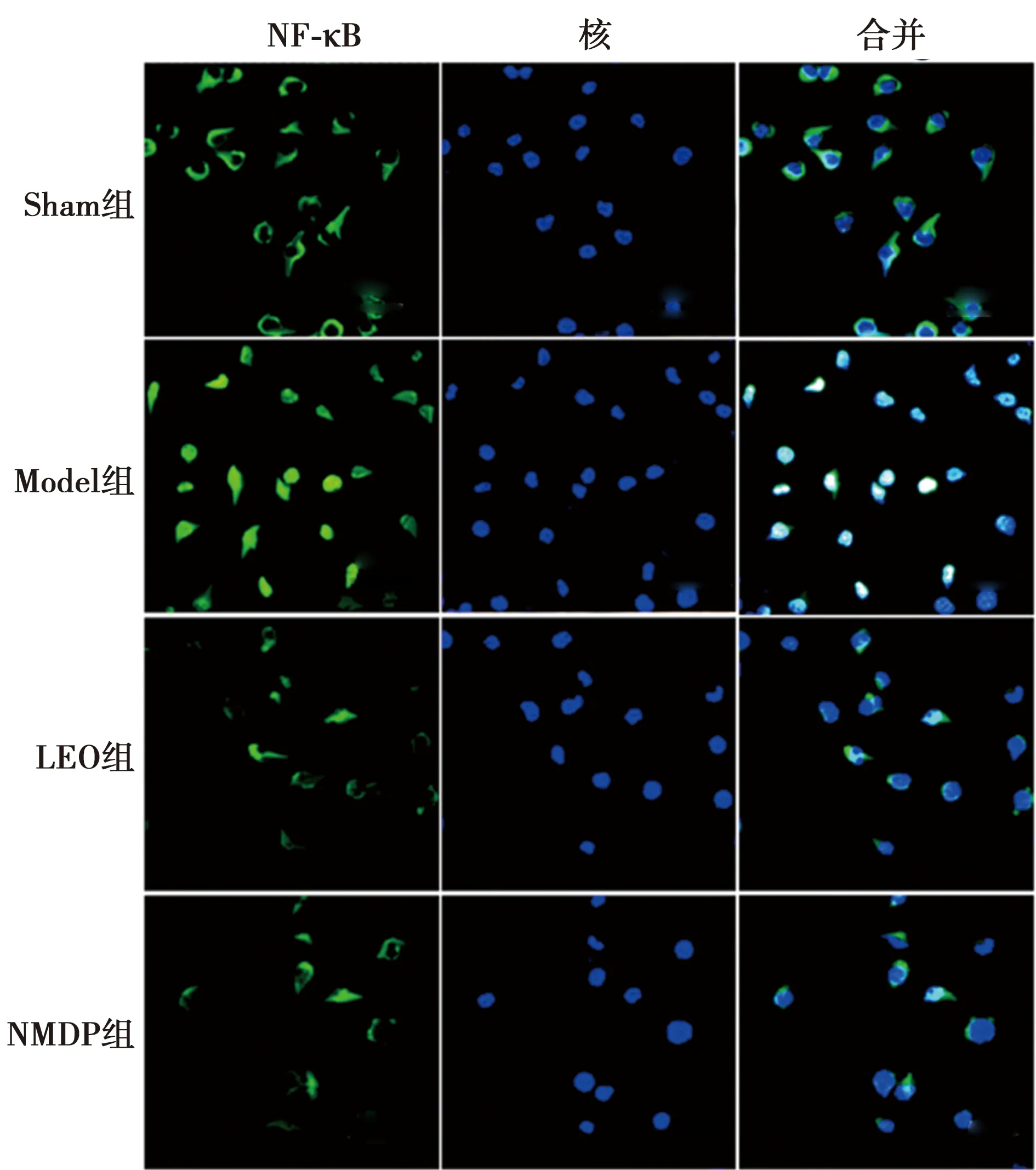
图4 免疫荧光检测NF-κB核位移(×400)
2.7Western印迹检测脑组织中p-AMPK、p-eNOS和NF-κB蛋白的表达 4组脑组织中p-AMPK、p-eNOS和NF-κB蛋白表达具有明显差异(P<0.05)。Model组p-AMPK、p-eNOS蛋白表达低于Sham组,NF-κB蛋白表达高于Sham组,LEO组、NMDP组p-AMPK、p-eNOS蛋白表达高于Model组,NF-κB蛋白表达低于Model组,差异均具有统计学意义(P<0.05);LEO组与NMDP组无明显差异(P>0.05),见表2、图5。
表2 各组NF-κB荧光强度及脑组织p-AMPK、 p-eNOS、 NF-κB蛋白表达

图5 Wetern印迹分析p-AMPK、 p-eNOS、NF-κB蛋白表达
3 讨 论
AD起病迟缓且发病隐匿,属于慢性神经退行性疾病,病理特征包括海马神经元大量凋亡及死亡、Aβ沉积等,多表现为记忆减退、精神障碍及行为障碍等。目前AD发病机制尚未明确,积极采取有效治疗药物缓解AD患者病情进展是临床亟待解决问题。中药中的有效成分或单一成分在AD的治疗中取得了一定的突破,LEO作为益母草的有效成分之一,具有活血解毒的功效,随着研究的深入,LEO对脑神经具有良好的保护作用。据报道〔9〕,LEO预处理能够明显降低缺血缺氧导致的大鼠皮层神经元凋亡率。研究显示〔10〕,LFO与SD大鼠皮质神经元存在潜在关联,LEO能明显改善局灶性脑缺血再灌注大鼠脑海马区神经元细胞的线粒体功能,并且可以抑制局灶性脑缺血再灌注模型SH-SYSY细胞凋亡,提示LEO能够保护海马区缺血引发的神经元凋亡。另有学者研究证实,LEO能够缓解脑震荡引发的神经功能损伤,其大鼠模型脑水肿明显改善〔11〕。本研究发现,LEO减轻AD对学习和记忆能力的损伤程度,减少神经元凋亡率,与上述研究结果一致。
研究表明,AD表现的认知功能障碍,与脑部能量代谢失衡有关。AMPK属于丝氨酸/苏氨酸蛋白激酶,是能量代谢过程的关键调节因子。在细胞能量代谢过程中,AMPK主要负责平衡外围能量,如果细胞能量减弱时,激活AMPK能够维持细胞的新陈代谢稳定。所以,有学者称之为平衡细胞能量的“介质”〔12〕。有报道称〔13〕,AMPK的激活是大脑神经元修复过程的重要因素之一。eNOS是细胞氮元素代谢的重要参与者,受AMPK的影响,与神经元凋亡、再生密不可分。NF-κB在多种类型细胞中存在,尤其是神经系统神经元细胞和星形细胞〔14〕。是免疫平衡调节程序中重要的参与者。相关研究显示,在高炎状态下细胞核内存在活化后NF-κB,其能够对多种编码炎症的靶基因展开调控作用,进而影响如IL-1β、IL-6 和 TNF-α等的表达,而高炎状态下会导致脑神经损伤加深,上游AMPK/eNOS通路会抑制NF-κB的表达〔15〕。相关研究显示〔16〕,脑梗死后神经细胞中AMPK/eNOS/NF-κB信号通路相关蛋白表达异常改变,进一步说明AMPK/eNOS/NF-κB信号通路参与脑细胞的修复和再生。本研究说明AD脑部的神经损伤与 AMPK/eNOS/NF-κB信号通路密切相关。LEO可能激活AMPK/eNOS通路,抑制NF-κB的活化发挥对AD大鼠脑组织的保护作用。
