两种H7N9 流感病毒荧光RT-PCR 试剂盒的敏感性和特异性评价
2022-10-14冯肖肖赵灵燕陈伟良董建斐
冯肖肖,赵灵燕,刘 霞,黄 靖,陈伟良,董建斐,张 璐,徐 辉
(浙江省动物疫病预防控制中心,浙江杭州 310000)
2013 年我国首次报告人H7N9 流感病例[1-3]。2017 年初我国首次检测到对家禽呈高致病力的H7N9 流感病毒,其传播力强、致死率高,给国内养禽业造成了巨大经济损失[4-9]。2017 年秋季我国开始实施家禽H5 和H7 亚型流感全面免疫政策,有效防控了H7N9 流感的传播与流行。家禽H7N9 流感强制免疫效果和病原污染状况日常监测是H7N9 流感防控的重要工作内容[10-11]。目前,H7N9 流感日常监测和防控普遍采用商品化荧光RT-PCR 试剂盒。而市场上商品化的H7N9 流感病毒荧光RT-PCR 检测试剂盒种类众多,不同试剂盒的阴阳性临界点判定标准不同,导致临床检测结果存在较大差异。因此,本研究选择两种H7N9 流感病毒荧光RT-PCR 检测试剂盒,对50 份样品进行检测,采用TG-ROC 方法分析其敏感性和特异性,并用Kappa 一致性检验评估检测结果的一致性,综合评价其检测性能,为H7N9 流感病毒检测试剂盒的选择和应用提供依据和指导。
1 材料与方法
1.1 检测样品
浙江省在2016—2017 年日常监测中检出50份疑似H7N9 流感核酸阳性样品,已通过官方报备并送国家禽流感参考实验室,经国家禽流感参考实验室通过鸡胚病毒分离鉴定,确认其中11 份为H7N9 流感病毒阳性,其余39 份为阴性。
1.2 主要仪器与试剂
两种H7N9 流感病毒荧光RT-PCR 检测试剂盒分别购自A、B 两家生物科技有限公司,分别标记为A、B 试剂盒。A 和B 两种试剂盒提供的临界点判定值分别为43 和30。
Roche480 荧光定量PCR 仪、MagNA Pure 96全自动核酸提取仪,均购自Roche 公司。
1.3 荧光RT-PCR 检测
按照核酸提取试剂盒说明书提取样品核酸,分别用A、B 两种试剂盒进行H7N9 流感病毒核酸检测,结果判定依据试剂盒说明书标准。
1.4 数据统计与分析
统计分析两种荧光RT-PCR 检测试剂盒的检测结果,并以鸡胚病毒分离鉴定结果作为“金标准”,采用TG-ROC 分析方法筛选荧光RT-PCR最适Ct 值(阈值),以2×2 列联表分析两种检测试剂盒的敏感性和特异性。敏感性=真阳性数/(真阳性数+假阴性数)×100%;特异性=真阴性数/(真阴性数+假阳性数)×100%。对检测结果用Kappa 一致性检验评估其一致性,综合评价两种试剂盒的检测性能。其中,Kappa <0.2 说明一致性较差,0.2~0.4 说明一致性一般,0.4~0.6 说明一致性中等,0.6~0.8 说明一致性较强,0.8~1.0 说明一致性很强。
2 结果与分析
2.1 核酸检测
采用两种H7N9 流感病毒荧光RT-PCR 检测试剂盒分别对50 份拭子样品进行检测,按照试剂盒提供的临界点判定阈值。结果(表1、2)显示:A试剂盒检出27 份阳性、23 份阴性,以鸡胚病毒分离鉴定结果为“金标准”,则A 试剂盒的敏感性和特异性分别为90.9%(10/11)和56.4%(22/39),敏感性高,但特异性低;B 试剂盒共检出8 份阳性,其余42 份为阴性,以鸡胚病毒分离鉴定结果为“金标准”,则B 试剂盒的敏感性和特异性分别为54.5%(6/11)和94.9%(37/39),特异性高,但敏感性低。
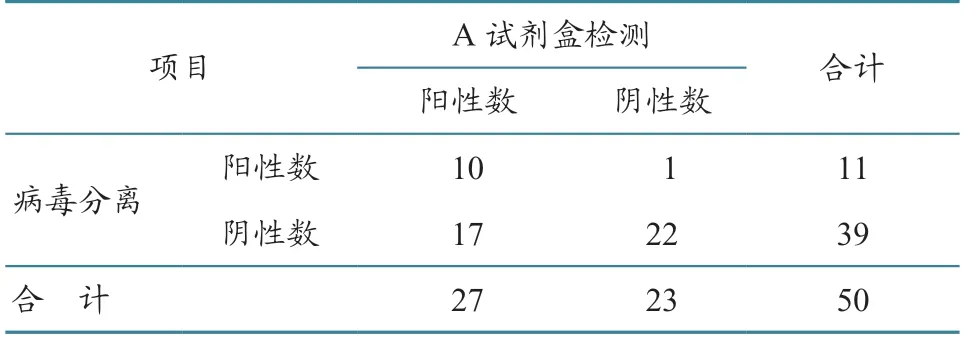
表1 A 试剂盒与病毒分离鉴定法的检测结果比较 单位:份

表2 B 试剂盒与病毒分离鉴定法的检测结果比较 单位:份
2.2 一致性比较
Kappa 一致性检验结果(表3)显示:两种检测试剂盒的Kappa 值为0.28,一致性一般,说明A 和B 两种荧光RT-PCR 检测试剂盒对H7N9 流感病毒的检测结果差异较大。

表3 两种荧光RT-PCR 检测试剂盒的检测结果比较 单位:份
2.3 TG-ROC 分析曲线
敏感性和特异性相等时所对应的Ct 值为最佳阈值,这个点恰好是敏感性和特异性曲线的交点[12-14]。TG-ROC 分析曲线(图1)显示:A试剂盒阈值为33,对应的敏感性和特异性分别为90.91%和92.31%;B 试剂盒阈值为37,对应的敏感性和特异性分别为81.82%和87.18%。

图1 两种试剂盒TG-ROC 分析曲线
2.4 判定标准重设后检测
A 试剂盒原定的判定标准(Ct)为43,该阈值下的敏感性达到最高,但特异性较差。若将判定标准调整至33~35,其敏感性不变,但特异性大大提高。因此,根据TG-ROC 分析曲线,重新设定A 试剂盒判定标准为33。调整后的检测结果(表4)显示,与“金标准”相对比,A 试剂盒的敏感性和特异性分别为90.91%(10/11)和92.31%(36/39),均达到90%以上,与调整前相比,敏感性不变,但特异性提高了35.91 百分点。

表4 A 试剂盒调整判定标准后的检测结果对比 单位:份
B 试剂盒原定的判定标准(Ct)为30,该阈值下的特异性较高,但敏感性较差。若将临界点调整至36~37,不仅特异性保持较好,且敏感性大大提高。因此,根据TG-ROC 分析曲线,重新设定B 试剂盒判定标准为37。调整后检测结果(表5)显示,与“金标准”相对比,B 试剂盒的敏感性和特异性分别为81.82%(9/11)和87.18%(34/39),均在80%以上。与调整前相比,特异性虽然下降7.72 百分点,但敏感性提高了27.32 百分点。

表5 B 试剂盒调整判定标准后的检测结果对比 单位:份
2.5 判定标准重设后检测结果一致性
调整判定标准后两种试剂盒检测一致性比较结果(表6)显示,两种检测试剂盒的Kappa 值为0.85,一致性很强,说明两种试剂盒检测结果一致。

表6 两种试剂盒调整判定标准后检测结果一致性比较 单位:份
3 讨论
高致病性H7N9 流感是我国重点防控的人兽共患传染病之一[2-3,5]。H7N9 流感病毒属于RNA病毒,极易发生基因突变和重组,因此病原变异监视是防控高致病性禽流感的重要工作。目前,荧光RT-PCR 检测技术是H7N9 流感病原检测的常用方法之一[10,15],可实时、快速地监视其分布和流行情况,在高致病性禽流感防控监测工作中得到广泛应用。不同厂家的H7N9 流感病毒荧光RT-PCR 检测试剂盒判定标准不同,导致其最终检测结果也不一致。因此,在实际应用中,应根据不同监测目的和要求,选择不同敏感性和特异性的试剂盒。ROC曲线,也称受试者工作特征曲线,最初运用在军事上,1971 年被推广到医学界后得到广泛应用,主要用于诊断试验的综合评价[12-13]。1995 年德国学者首次对ROC 曲线进行改进,并提出TG-ROC 分析方法,也称双图受试者工作特征曲线[12]。通过计算诊断试剂每个阈值对应的敏感性和特异性,以阈值为横坐标,敏感性和特异性为纵坐标,在同一个坐标系上绘制敏感性曲线和特异性曲线双图,其交点即为最佳阈值。TG-ROC 分析方法不仅可直观地反映敏感性和特异性对阈值的影响,也可估计试验结果准确度,还可以根据实际情况,选取最佳阈值作为判定标准,使试验的敏感性和特异性达到实际要求,以获得检测试验的最大准确度,因而常用来评价检测试验的可靠性,具有临床指导意义[13]。
本研究发现,两个厂家的H7N9 流感病毒荧光RT-PCR 检测试剂盒的判定阈值不同,因而其敏感性和特异性也各不相同,导致检测结果不一致。在实际应用中两种试剂盒各有利弊:A 试剂盒敏感性较高,可以有效检测病原,降低漏检对防控造成的不利影响,但其特异性低,误诊率较高,实际应用中会导致假阳性较多,导致因疫情误判而加大防控成本;而B 试剂盒特异性较高,可降低误诊引起的经济损失,但其敏感性低,难以有效检测禽群中存在的H7N9 流感病毒,实际应用中会导致假阴性较多,漏检率较高,可能造成防控漏洞而增加疫情发生风险。因此,在临床应用中,应根据不同需求和检测目的选择合适的试剂盒。
诊断试验中,恰当的判定阈值可提高诊断的真实性,提高疫病防控能力,还可以防范漏检、误诊带来的危害。TG-ROC 分析结果显示,在原定阈值下,A、B 两种试剂盒只能满足敏感性高或特异性高之一的特性,而不能同时达到最佳敏感性和特异性要求,不利于实际应用和选择。A、B 两个试剂盒的判定阈值偏低或偏高,致使假阳性或假阴性偏多,容易造成误判或漏检,不仅会加大诊断处理成本或疫情风险,还会降低诊断试剂的综合性能。通过TG-ROC 分析法计算诊断试剂的最佳阈值并重新调整后,A 试剂盒的敏感性和特异性同时达到90%以上,B 试剂盒能同时达到80%以上,且两者检测结果的一致性明显增强。这表明,判定阈值会影响诊断试验的可靠性和真实性。采用TG-ROC分析方法,选择适当的判定阈值,可以提高检测试剂的敏感性和特异性,增加检测结果的可靠性和真实性,减少漏诊和误诊带来的问题,从而帮助采取科学的疫病防控措施。
综上所述,不同厂家试剂盒的检测结果存在差异,实际应用中不同监测目的要求的试剂盒敏感性和特异性也不同,因此可以应用TG-ROC 分析方法,选定检测试剂盒的阴阳性临界点,重新调整试剂盒判定标准,提高检测方法在临床检测应用中的指导性。本试验样本数据有限,今后还需进一步积累数据进行深入研究。
