LncRNA DLX6-AS1靶向miR-374a-3p调控糖尿病患者创面愈合的分子机制
2022-10-09陈啸王媛媛崔云飞黄贤明
陈啸 王媛媛 崔云飞 黄贤明
(青岛大学附属青岛市海慈医院血管外科,山东 青岛 266000)
创面愈合不良是糖尿病(DM)的常见并发症,创面愈合受损和反复感染可大大增加下肢截肢风险,甚至导致死亡。研究报道DM和高糖暴露可能导致微血管内皮细胞(HMECs)活力和迁移能力降低,血管生成减少,凋亡增加,从而导致创面愈合缓慢,诱导HMECs增殖和迁移可能是促进创面愈合的潜在方法〔1,2〕。长链非编码RNA(LncRNA)通过靶向微小RNA(miRNA)调节下游靶mRNA表达在许多疾病病理过程中发挥作用〔3〕。研究表明LncRNA DLX6-AS1介导糖尿病肾病(DN)肾功能的下降,下调LncRNA DLX6-AS1能够抑制高糖诱导的肾小球系膜细胞炎症反应〔4,5〕。miRNA表达失调与创面愈合不良等多种DM并发症进展有关〔6〕。研究发现miR-374a-3p低表达介导DN的发生发展〔7〕。骨关节炎(OA)患者软骨中miR-374a-3p表达降低,过表达miR-374a-3p显著减轻脂多糖诱导的软骨细胞损伤〔8〕。靶基因预测显示miR-374a-3p是LncRNA DLX6-AS1的潜在靶点,然而,LncRNA DLX6-AS1是否靶向miR-374a-3p影响创面愈合尚未可知。本研究通过分析糖尿病患者创面组织中LncRNA DLX6-AS1、miR-374a-3p的表达情况,探讨LncRNA DLX6-AS1对高糖暴露下人HMECs增殖、迁移和侵袭的影响,并通过miR-374a-3p探讨其作用机制。
1 资料与方法
1.1一般资料
1.1.1组织来源 选取青岛市海慈医院DM患者足部溃疡组织27例标本为DM组,排除下肢动脉疾病、心脑血管疾病或其他并发症,年龄36~73岁。27例正常人足部组织标本为对照组。两组年龄、性别差异无统计学意义。本研究经医院伦理评审委员会批准,参与者均签署知情同意书。
1.1.2细胞和试剂 HMECs购自上海研谨生物科技公司;CCK-8试剂盒、Trizol试剂购自南京凯基生物公司;PrimeScript逆转录试剂盒和SYBR Premix Ex Taq试剂盒购自大连takara生物公司;miRNA检测试剂盒购自美国GeneCopoeia公司;si-RNA、miRNA模拟物、miRNA抑制物、pcDNA-RNA、荧光素酶报告载体购自江苏百奥迈科生物技术有限公司;Cyclin D1兔多克隆抗体(ab226977)、MMP2兔多克隆抗体(ab97779)、MMP9兔多克隆抗体(ab73734)、山羊抗兔二抗(ab205718)、β-actin兔单克隆抗体(ab115777)购自美国Abcam公司;Transwell培养板购自美国Corning公司。
1.2方法
1.2.1细胞培养和高糖损伤模型细胞的建立 HMECs接种于含5%胎牛血清、1%内皮生长因子的内皮培养基(ECM)置于37℃、含5%二氧化碳、95%空气、湿度为70%~80%的培养箱中孵育,在细胞密度达80%~90%即可进行传代培养。用含30 mmol/L葡萄糖的培养液孵育HMECs 48 h建立高糖损伤细胞模型〔9〕,记为高糖(HG)组。
1.2.2RT-qPCR检测LncRNA DLX6-AS1和miR-374a-3p表达 通过Trizol试剂提取受试者创面组织、的总RNA。用PrimeScript逆转录试剂盒和SYBR Premix Ex Taq试剂盒进行RT-qPCR以检测LncRNA DLX6-AS1表达。用miRNA检测试剂盒对miR-374a-3p进行定量检测。2-ΔΔCt法计算LncRNA DLX6-AS1和miR-374a-3p表达量。
1.2.3实验分组 将HMECs接种24孔板,在细胞密度达50%按照脂质体2000说明书分别将pcDNA、pcDNA-LncRNA DLX6-AS1、si-NC、si-LncRNA DLX6-AS1、miR-NC、miR-374a-3p模拟物、anti-miR-374a-3p+si-LncRNA DLX6-AS1、anti-miR-NC +si-LncRNA DLX6-AS1转染HMECs中,转染48 h收集细胞备用。正常培养的HMECs为对照(NC)组;高糖损伤细胞模型为HG组;HMECs分别转染si-NC、si-LncRNA DLX6-AS1、miR-NC、miR-374a-3p模拟物、anti-miR-374a-3p+ si-LncRNA DLX6-AS1、anti-miR-NC +si-LncRNA DLX6-AS1后进行高糖处理,分别为si-NC+HG组、si-LncRNA DLX6-AS1+HG组、miR-NC+HG组、miR-374a-3p+HG组、anti-miR-374a-3p+si-LncRNA DLX6-AS1+HG组、anti-miR-NC+si-LncRNA DLX6-AS1+HG组。仅转染pcDNA、pcDNA-LncRNA DLX6-AS1、si-NC、si-LncRNA DLX6-AS1的HMECs分别为pcDNA组、pcDNA-LncRNA DLX6-AS1组、si-NC组、si-LncRNA DLX6-AS1组。
1.2.4CCK-8法检测细胞增殖 将各组HMECs以5×103个/孔接种96孔板,培养48 h后替换为含10% CCK-8试剂的培养基,孵育2 h后,通过酶标仪测定450 nm处光密度(OD)值。细胞增殖率(%)=实验OD/对照OD×100%
1.2.5Transwell实验检测细胞迁移和侵袭 将各组HMECs重悬在不含胎牛血清ECM中,取200 μl密度为1×106个/ml细胞悬液接种到上室,将600 μl含20%胎牛血清ECM加入下室。培养箱孵育24 h后,用5%戊二醛固定穿膜细胞,0.1%结晶紫染色。以显微镜下随机选取5个视野细胞数均值表示HMECs迁移数量。侵袭检测采用包被基质胶的上室,其他步骤参考迁移检测。
1.2.6Western印迹检测细胞周期蛋白(Cyclin)D1、基质金属蛋白酶(MMP)-2和MMP-9蛋白水平 向各组HMECs中加入细胞裂解缓冲液4℃孵育15 min,离心收集上清即为蛋白样品。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后进行湿法转膜,封闭膜后,在4℃下用一抗孵育10 h。随后与二抗在室温下孵育1 h,滴加显影液显影,以Image J软件测得的靶蛋白和内参β-actin灰度值比值表示靶蛋白表达量。
1.2.7双荧光素酶报告实验 starBase数据库预测显示LncRNA DLX6-AS1和miR-374a-3p序列之间存在特异性结合区。构建野生型(WT)报告载体LncRNA DLX6-AS1-WT和突变型(MUT)报告载体LncRNA DLX6-AS1-MUT。将报告载体分别与miR-374a-3p模拟物、miR-NC共转染到HMECs中,转染48 h后,收获细胞、裂解细胞,离心收集上清,测量相对荧光素酶活性。
1.3统计学方法 采用SPSS21.0软件进行t检验,多组间数据比较采用单因素方差分析和LSD-t检验。
2 结 果
2.1DM组和对照组创面组织中LncRNA DLX6-AS1和miR-374a-3p和表达情况 与对照组比较,DM组创面组织中LncRNA DLX6-AS1表达水平显著升高(P<0.05),miR-374a-3p表达水平显著降低(P<0.05),见表1。
2.2高糖处理HMECs细胞模型中miR-374a-3p和LncRNA DLX6-AS1表达情况 与NC组比较,HG组HMECs中LncRNA DLX6-AS1表达水平显著升高(P<0.05),miR-374a-3p表达水平显著降低(P<0.05),见表2。
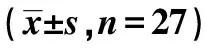
表1 两组创面组织中miR-374a-3p和 LncRNA DLX6-AS1表达情况
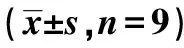
表2 高糖处理HMECs的细胞模型中miR-374a-3p和 LncRNA DLX6-AS1表达情况
2.3下调LncRNA DLX6-AS1对高糖处理的HMECs增殖、迁移和侵袭的影响 与NC组比较,HG组HMECs中LncRNA DLX6-AS1表达水平显著升高(P<0.05),CyclinD1、MMP-2和MMP-9蛋白水平、细胞增殖率、迁移数量、侵袭数量显著降低(P<0.05);与si-NC+HG组比较,si-LncRNA DLX6-AS1+HG组HMECs中LncRNA DLX6-AS1表达水平显著降低(P<0.05),CyclinD1、MMP-2和MMP-9蛋白水平、细胞增殖率、迁移数量、侵袭数量显著升高(P<0.05),见图1和表3。

1~4:NC组,HG组,si-NC+HG组,si-LncRNA DLX6-AS1+HG组图1 Western印迹检测CyclinD1、MMP-2和 MMP-9的蛋白表达
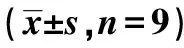
表3 下调LncRNA DLX6-AS1对高糖处理的HMECs增殖、迁移和侵袭的影响
2.4上调miR-374a-3p对高糖处理的HMECs增殖、迁移和侵袭的影响 与miR-NC+HG组比较,miR-374a-3p+HG组HMECs中miR-374a-3p表达水平、CyclinD1、MMP-2和MMP-9蛋白水平、细胞增殖率、迁移数量、侵袭数量显著升高(P<0.05),见表4和图2。
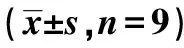
表4 上调miR-374a-3p对高糖处理的HMECs增殖、迁移和侵袭的影响

1,2:miR-NC+HG组,miR-374a-3p+HG组图2 Western印迹检测CyclinD1、MMP-2和 MMP-9蛋白的表达
2.5LncRNA DLX6-AS1靶向调控miR-374a-3p的表达 starbase预测到miR-374a-3p和LncRNA DLX6-AS1存在特异性结合位点,见图3。同与LncRNA DLX6-AS1-WT共转染时,与转染miR-NC比较,转染miR-374a-3p模拟物可降低HMECs相对荧光素酶活性(P<0.05),见表5。与pcDNA组比较,pcDNA-LncRNA DLX6-AS1组HMECs中LncRNA DLX6-AS1表达水平显著升高(P<0.05),miR-374a-3p表达水平显著降低(P<0.05);与si-NC组比较,si-LncRNA DLX6-AS1组HMECs中LncRNA DLX6-AS1表达水平显著降低(P<0.05),miR-374a-3p表达水平显著升高(P<0.05),见表6。
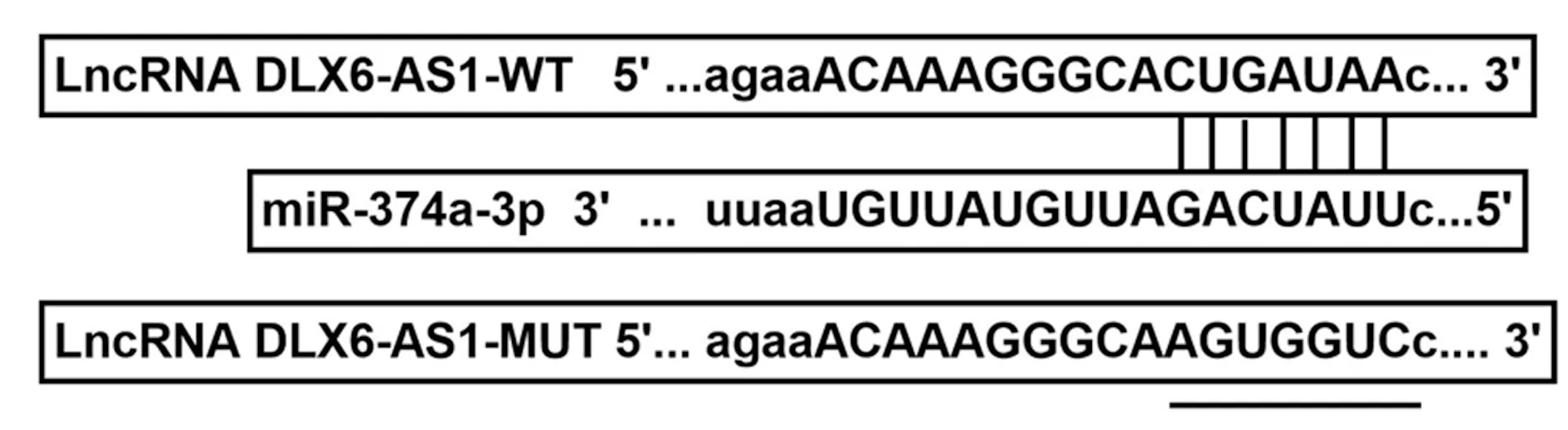
图3 starbase对miR-374a-3p和LncRNA DLX6-AS1结合进行预测示意图
2.6下调miR-374a-3p可以逆转LncRNA DLX6-AS1低表达对高糖处理的HMECs增殖、迁移和侵袭的影响 与anti-miR-NC+si-LncRNA DLX6-AS1+HG组比较,anti-miR-374a-3p+ si-LncRNA DLX6-AS1+HG组HMECs中miR-374a-3p表达水平、CyclinD1、MMP-2和MMP-9蛋白水平、细胞增殖率、迁移数量、侵袭数量显著降低(P<0.05),见图4和表7。
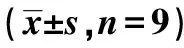
表5 相对荧光素酶活性检测
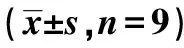
表6 RT-qPCR检测LncRNA DLX6-AS1和 miR-374a-3p的表达
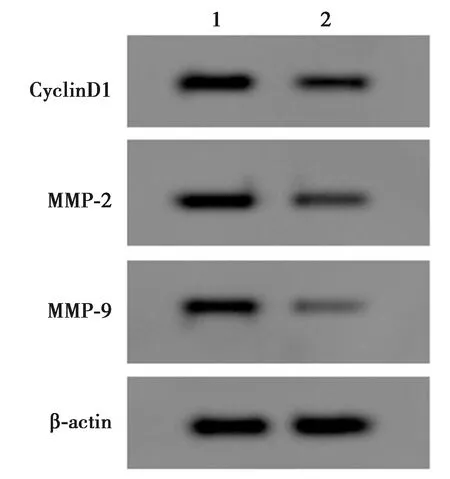
1,2:anti-miR-NC+si-LncRNA DLX6-AS1+HG组,anti-miR-374a-3p+si-LncRNA DLX6-AS1+HG组图4 Western印迹检测CyclinD1、 MMP-2和MMP-9蛋白表达
表7 下调miR-374a-3p可以逆转LncRNA DLX6-AS1低表达对高糖处理的HMECs增殖、迁移和侵袭的影响
3 讨 论
尽管已有抗生素治疗、清创、高压氧治疗、控制血糖等促进创面愈合方法,但在临床上仍有多数DM患者因创面愈合不良最终不得不选择截肢。研究发现DM创面中存在大量差异表达的非编码RNA(ncRNA)。LncRNA GAS5在DM足部溃疡患者皮肤组织中表达下调,上调LncRNA GAS5促进高糖处理的内皮细胞增殖和管形成,加速创面愈合〔10〕。LncRNA MALAT1通过激活HIF-1α信号通路促进DM小鼠成纤维细胞的活化和创面胶原表达〔11〕。miR-296-5p可提高DM创面的愈合率〔12〕。因此,ncRNA可能是促进DM创面愈合的有效分子工具。本研究检测到DM患者创面组织、高糖处理的HMECs中LncRNA DLX6-AS1表达显著升高,miR-374a-3p表达显著降低,提示LncRNA DLX6-AS1和miR-374a-3p异常表达可能是DM患者创面愈合不良的原因之一。功能实验表明,高糖处理可抑制HMECs增殖、迁移和侵袭,下调CyclinD1、MMP-2和MMP-9蛋白水平,表明高糖通过抑制HMECs生物活性来阻止创面愈合。研究表明LncRNA DLX6-AS1通过多种机制参与细胞生物活性的调控。例如,在急性肾损伤中敲低LncRNA DLX6-AS1可抑制脂多糖诱导的肾小管上皮细胞毒性和细胞焦亡〔13〕。LncRNA DLX6-AS1通过靶向参与缺氧复氧诱导的神经元凋亡〔14〕。此外,下调lncRNA SNHG5可通过调控miR-374a-3p来缓解脓毒症诱导的急性肾损伤〔15〕。本研究发现下调LncRNA DLX6-AS1或上调miR-374a-3p表达均能够促进HMECs增殖、迁移和侵袭,表明下调LncRNA DLX6-AS1或上调miR-374a-3p可能通过增加HMECs增殖、迁移和侵袭能力来促进创面愈合。
LncRNA可作为miRNA的分子海绵参与DM创面愈合进展〔16,17〕。本研究证实miR-374a-3p是LncRNA DLX6-AS1的直接靶基因,且miR-374a-3p表达受到LncRNA DLX6-AS1负性调控。下调LncRNA DLX6-AS1与上调miR-374a-3p对CyclinD1、MMP-2和MMP-9蛋白表达及HMECs增殖、迁移、侵袭的影响相吻合,且下调miR-374a-3p显著减弱LncRNA DLX6-AS1低表达对HMECs生物学功能和CyclinD1、MMP-2和MMP-9蛋白表达的影响,表明靶向miR-374a-3p是LncRNA DLX6-AS1调控HMECs增殖、迁移和侵袭的重要机制。
综上,DM患者创面组织中LncRNA DLX6-AS1表达增加,miR-374a-3p表达减少。下调LncRNA DLX6-AS1通过促进miR-374a-3p表达可诱导HMECs增殖、迁移和侵袭。因此,靶向抑制LncRNA DLX6-AS1/miR-374a-3p途径可能是促进DM患者创面愈合的重要策略。
