皮肤黑色素瘤中SKA3表达及潜在分子机制分析
2022-09-28张凤友罗文奇陈肖瑜杜春平党裔武
张凤友,罗文奇,陈肖瑜,杜春平,党裔武
皮肤黑色素瘤(skin cutaneous melanoma, SKCM)是起源于黑色素细胞的恶性肿瘤,其具有高度侵袭性、早期易转移等特点,导致SKCM患者预后不佳和病死率高[1]。因此,SKCM的早期诊断和治疗尤为重要。纺锤体与着丝粒相关蛋白3(spindle and kinetochore associated complex subunit 3, SKA3)是SKA蛋白家族的重要成员之一,其主要通过调节微管结合因子来维持有丝分裂期间染色体的精确分离,确保有丝分裂的生物学进程[2]。研究表明SKA3与肿瘤的发生、发展密切相关,SKA3过表达可促进肿瘤细胞的增殖和侵袭,是预后不良的预测因素,其在乳头状甲状腺癌[3]、乳腺癌[4]、肺癌[5]、肝癌[6]等肿瘤中高表达。目前,关于SKA3在SKCM中的文献报道甚少。本文通过免疫组化法及公共数据库数据分析SKA3在SKCM中的表达、对预后的影响及其潜在分子机制,为进一步研究SKA3在SKCM中的诊疗、发生发展的作用机制提供线索和依据。
1 材料与方法
1.1 材料收集2017年1月~2021年2月广西医科大学附属肿瘤医院存档的43例SKCM根治性手术标本及其配对的正常皮肤标本,患者术前均未行放、化疗或分子靶向治疗。本实验经广西医科大学附属肿瘤医院伦理委员会批准,患者均签署知情同意书。
1.2 方法
1.2.1免疫组化 采用免疫组化SP 9000法染色,SKA3抗体(稀释比1 ∶400,bs-7848R,北京Bioss公司)。结果判读:(1)按阳性细胞百分比计分:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。(2)按阳性细胞百分比计分:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘:0~3分为阴性,4~12分为阳性。
1.2.2公共数据提取 从基因芯片表达数据库(GEO)获得SKCM组织中SKA3基因芯片的表达数据。筛选出3个数据集信息如下:GSE114445(16例SKCM和11例正常皮肤组织样本)、GSE7553(82例SKCM和4例正常皮肤组织样本)及GSE15605(58例SKCM和16例正常皮肤组织样本)。
1.2.3数据分析 GEPIA(http://gepia.cancer-pku.cn)是基于TCGA和GTEx数据库中的肿瘤和正常样本进行基因表达的在线分析网站。GEPIA在线数据分析SKA3 mRNA在SKCM和正常对照组织中的表达差异。利用Linkedomics(http://www.linkedomics.org/login.php)在线数据网站筛选SKA3基因的共表达基因。DAVID(https://david.ncifcrf.gov/tools.jsp)数据库对SKA3基因的共表达基因进行GO基因富集分析和KEGG通路富集分析。String(https://string-db.org/)在线蛋白互作分析软件分析SKA3蛋白上下游的关系。TISIDB(http://cis.hku.hk/TISIDB/)软件分析472例SKCM组织的RNA测序数据,分析SKA3表达与活化CD4+T细胞、不成熟B细胞、肥大细胞、Ⅰ型辅助T细胞以及效应记忆CD8+T细胞的相关性。
1.3 统计学分析采用SPSS 20.0软件进行统计学分析。χ2检验分析SKA3蛋白表达与SKCM临床病理特征的相关性。单因素方差分析TCGA和GTEx数据库中SKA3 mRNA在SKCM组和正常对照组间的差异。独立样本t检验分析SKA3 mRNA表达在GEO高通量芯片表达数据集肿瘤组和正常对照组间的差异。Kaplan-Meier法和Log-rank检验比较SKA3高表达组和低表达组间的总生存期和无瘤生存期。Spearman相关分析筛选与SKA3共表达的基因,筛选标准为:P<0.05,r>0.4或<-0.4。Spearman法分析SKA3表达与免疫细胞浸润的相关性。
2 结果
2.1 TCGA和GTEx数据库分析SKA3 mRNA在SKCM组织中的表达及其与患者预后的关系GEPIA数据库显示,与正常对照组相比,SKA3 mRNA在SKCM组织中明显高表达,差异有统计学意义(TPM中位数值:SKCM组=4.840,正常组=0.620,P<0.05,图1)。通过GEPIA在线分析网站分析SKA3 mRNA与SKCM患者预后的关系,其中SKA3 mRNA高表达组与低表达组样本各229例,生存分析结果提示,SKA3 mRNA高表达组SKCM患者的总生存期和无瘤生存期均显著短于低表达组,差异均有统计学意义(总生存期:HR=1.3,P=0.035;无瘤生存期:HR=1.3,P=0.018,图2)。

图1 TCGA和GTEx数据库分析SKA3 mRNA在SKCM组织中的表达:TPM.每百条读数转录本;*P<0.05
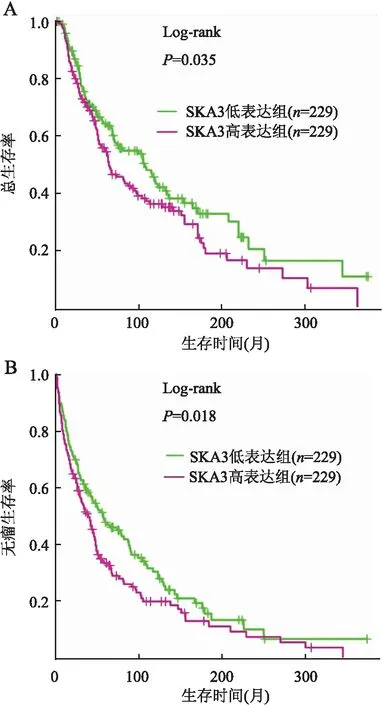
图2 SKA3 mRNA表达与SKCM患者预后的关系:A.总生存期;B.无瘤生存期
2.2 GEO数据库分析SKA3 mRNA在SKCM组织中的表达利用GSE114445、GSE7553、GSE15605三个数据集分析SKA3 mRNA在SKCM和正常对照组织间的表达差异。与正常组织(GSE114445:4.814;GSE7553:6.656;GSE15605:4.940)相比,SKA3 mRNA在SKCM中的表达均上调(GSE114445:5.119;GSE7553:8.473;GSE15605:6.059),差异有统计学意义(图3)。

图3 GEO数据库分析SKA3 mRNA在SKCM中的表达
2.3 SKCM中SKA3蛋白表达及与临床病理特征的关系免疫组化法检测43例SKCM组织和配对正常皮肤石蜡组织中SKA3蛋白表达,结果显示SKA3蛋白在SKCM组织中的阳性率(55.81%)高于正常皮肤组织(2.33%),差异有统计学意义(P<0.001,图4)。SKA3蛋白表达水平与公共数据库中SKA3 mRNA表达水平一致。χ2检验分析显示,SKA3表达与患者年龄(P=0.018)、淋巴结转移(P=0.004)、脉管内癌栓(P=0.034)相关,与患者性别、肿物直径、Breslow厚度、Clark分期、神经侵犯无关(P>0.05,表1)。

AB
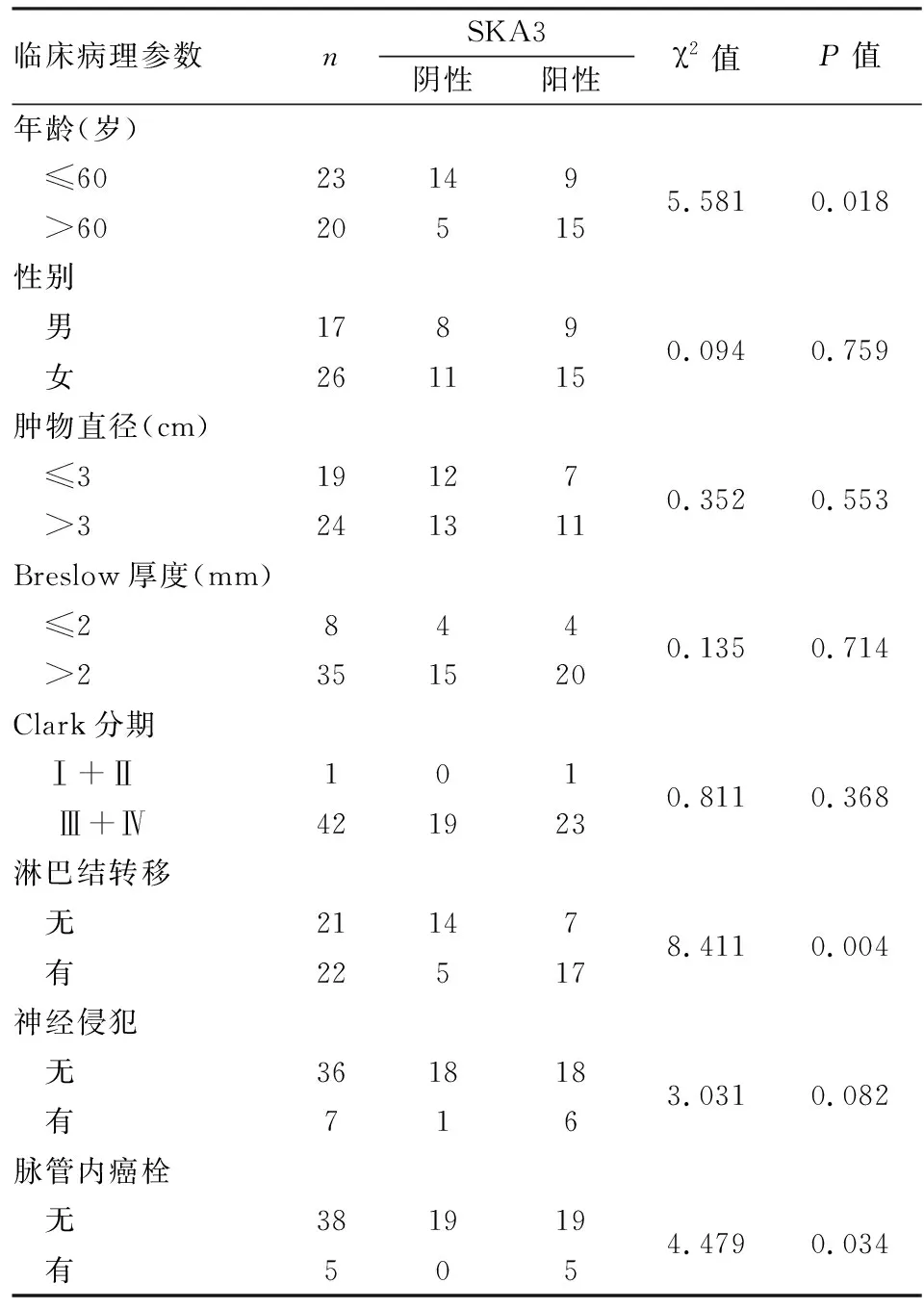
表1 SKA3表达与SKCM临床病理特征的关系
2.4 SKA3共表达基因的功能富集分析Linkedomics数据库中筛选获得SKA3的共表达基因396个,其中呈正相关者有358个(P<0.05,r>0.4),呈负相关者有38个(P<0.05,r<-0.40)。GO基因富集发现,SKA3基因编码的蛋白主要定位于细胞质、纺锤体极、中心体、着丝点等上面;分子功能主要有蛋白质结合、ATP结合、DNA结合、蛋白激酶结合等;而生物学过程主要集中于细胞分裂、有丝分裂、姐妹染色单体凝聚力、DNA复制等。KEGG信号通路主要为细胞周期、DNA复制、卵母细胞减数分裂、p53信号通路等。
2.5 SKA3基因的上下游相关基因用String网站分析SKA3基因上下游相关基因的关系,得到相应的网络图(图5)。PPI富集P值=1.0e-16,相互作用节点数10个,分别为SKA1、SKA2、BUB1B、CCNB1、SPDL1、BUB1、BOD1、NDC80、PLK1、CENPE。其中SKA1、SKA2及BUB1B蛋白与SKA3蛋白联系最为密切(Score=0.99)。
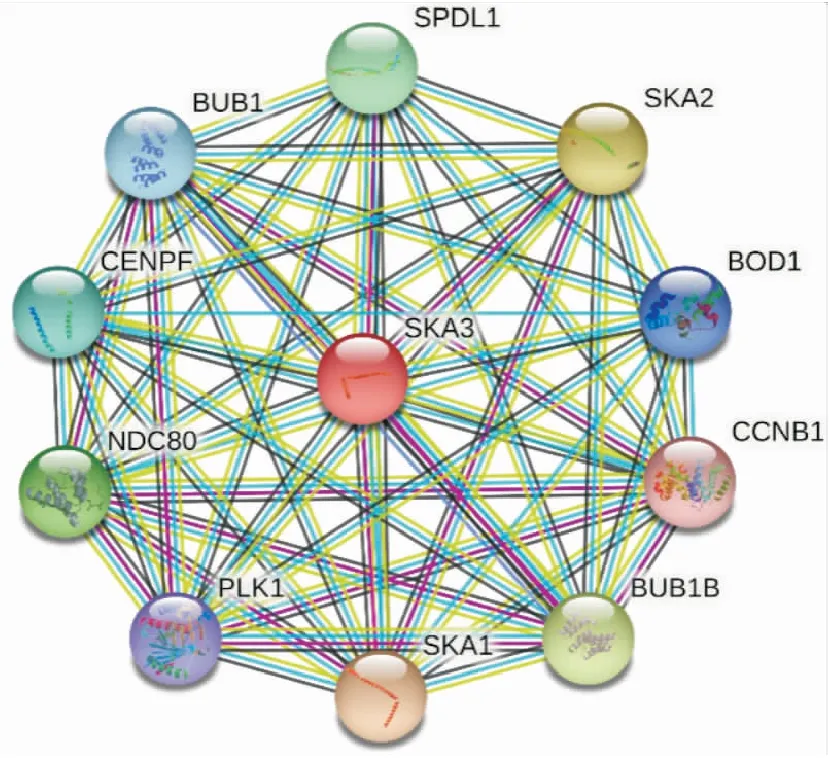
图5 SKA3基因与上下游基因的调控关系
2.6 SKA3与肿瘤免疫细胞浸润的关系SKA3与活化CD4+T细胞的免疫浸润水平呈正相关(r=0.386,P<2.2e-16),与不成熟B细胞(r=-0.255,P=2.06e-08)、肥大细胞(r=-0.248,P=5.2e-08)、Ⅰ型辅助T细胞(r=-0.256,P=1.87e-08)以及效应记忆CD8+T细胞(r=-0.246,P=6.58e-08)的免疫浸润水平呈负相关(图6)。
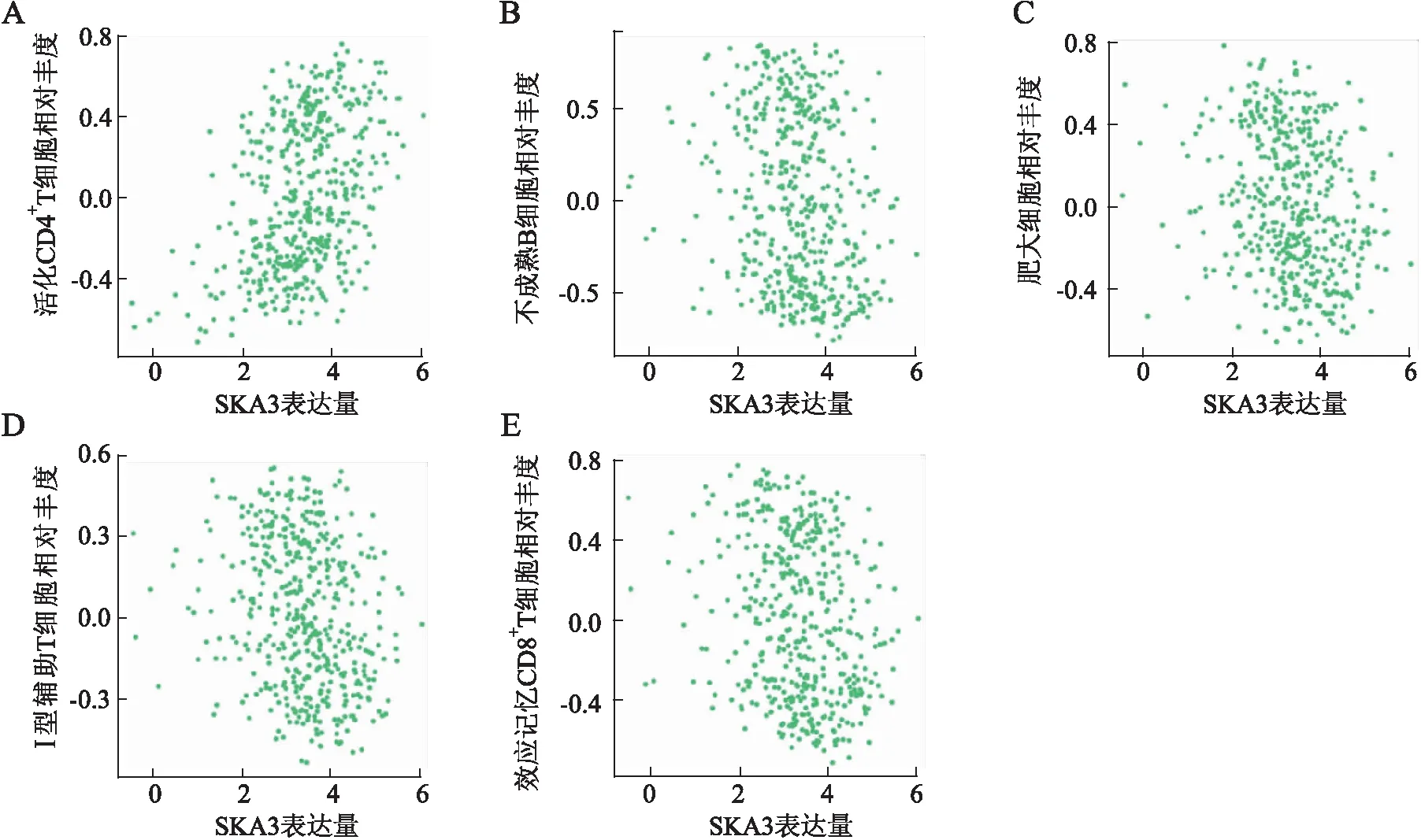
图6 SKA3与肿瘤免疫细胞浸润的关系:A.SKA3与活化CD4+T细胞的免疫浸润水平呈正相关;B.SKA3与不成熟B细胞免疫浸润水平呈负相关;C.SKA3与肥大细胞免疫浸润水平呈负相关;D.SKA3与Ⅰ型辅助T细胞免疫浸润水平呈负相关;E.SKA3与效应记忆CD8+T细胞的免疫浸润水平呈负相关
3 讨论
高度侵袭性和易早期远处转移是SKCM的特征,SKCM的早期诊断和治疗对于延长患者生存周期至关重要[7]。肿瘤的发生与细胞异常分裂密切相关,在有丝分裂中细胞通过双极纺锤体分裂成两个相同的子细胞。在这个过程中,精确的染色体分离依赖于染色体与动态微管尖端之间的牢固连接,SKA3是微管结合调控的关键,通过调节微管结合因子来维持有丝分裂期间染色体的精确分离[2]。SKA3在多种肿瘤中均过表达,据文献报道SKA3基因在肺腺癌中表达上调,与患者年龄、性别、病理分期、N分期和M分期显著相关[5]。本组通过分析公共数据库TCGA、GTEx中的SKCM数据集以及GEO高通量芯片GSE114445、GSE7553及GSE15605三组数据集,均发现SKA3 mRNA在SKCM组织中表达上调。为进一步验证生物信息学结果,本组免疫组化结果显示SKA3蛋白在SKCM中的表达明显高于正常皮肤组织,且与患者年龄、淋巴结转移、脉管内癌栓相关,提示SKA3可能是SKCM发生、发展中的作用因子。SKA3高表达组患者的总生存期和无瘤生存期均低于低表达组,提示SKA3高表达患者的预后更差。以上5个不同数据集的结果均提示,SKA3表达与SKCM患者的预后显著相关。
功能富集分析结果显示,SKA3基因编码的蛋白主要定位于细胞质、纺锤体极、中心体、着丝点等上面;分子功能主要有蛋白质结合、ATP结合、DNA结合、蛋白激酶结合等;而生物学过程主要集中于细胞分裂、有丝分裂、姐妹染色单体凝聚力、DNA复制等。KEGG信号通路主要为细胞周期、DNA复制、卵母细胞减数分裂、p53信号通路等。研究表明,通过调控细胞周期依耐性激酶CDK2及p53蛋白磷酸化,SKA3可促进肝癌细胞的生长和远处转移[8]。Li等[9]研究发现,SKA3通过调节Akt/GSK-3β轴心激活Wnt/β-catenin信号通路,促进胶质母细胞瘤肿瘤细胞的增殖和侵袭。SKA3还可以作为miR-455-3p的靶基因参与调控肾透明细胞癌的恶性进展[10]。王亚等[11]研究发现SKA3在结直肠癌中高表达,敲减SAK3表达可抑制癌细胞的增殖和迁徙,这可能与抑制PI3K/Akt信号通路有关。同样,Liang等[12]体外实验也发现沉默SKA3可显著抑制SKCM细胞的增殖、侵袭和上皮-间充质转化,并诱导其细胞凋亡,沉默SKA3可降低PI3K和Akt的磷酸化水平,Akt抑制显著逆转SKA3过表达诱导的对SKCM细胞的致癌作用。以上证据提示,SKA3可能通过调控细胞周期和多种信号通路参与了恶性肿瘤的进展。本组前期实验发现SKA3在甲状腺乳头状癌的表达上调,且与患者预后和肿瘤的免疫细胞浸润相关[3]。本实验通过分析SKA3与肿瘤免疫细胞浸润的相关性,发现SKA3与活化CD4+T细胞呈正相关,与不成熟B细胞、肥大细胞、Ⅰ型辅助T细胞以及效应记忆CD8+T细胞呈负相关,这提示在SKCM中SKA3也可能与免疫细胞浸润相关,为个体免疫治疗提供了可能的分子靶点。然而SKA3促进肿瘤发生的分子机制仍需更深入的基础实验研究。
综上所述,本实验通过免疫组化染色结合公共数据库测序数据分析发现,SKA3 mRNA和蛋白在SKCM中高表达。SKA3可能是SKCM的潜在诊断和预后分子标志物,对肿瘤发生、发展可能具有一定的促进作用,为SKCM患者的个体化治疗提供新思路。
