胰腺癌中黏附性G蛋白偶联受体家族的表达及其临床意义
2022-09-28张京城
张京城,徐 凯,王 成
胰腺癌恶性程度高、预后差,手术是根治胰腺癌的唯一办法,但大多数患者因早期症状不典型、诊断滞后等原因而错失最佳手术治疗时机;以吉西他滨为代表的化疗方案,虽能延长晚期患者的中位生存期,但患者5年生存率仍低于9%[1]。因此,寻找胰腺癌可靠的生物学标志物和有效的治疗靶点,进一步探索分子调控机制,一直是胰腺癌领域的研究前沿。aGPCRs作为第二大类G蛋白偶联受体家族,近来被发现在乳腺癌[2]、肺癌[3]、前列腺癌[4]等肿瘤中异常表达,其中一些受体与肿瘤的发展密切相关,但其在胰腺癌中的研究却少有报道[5]。本实验结合生物信息学分析与临床样本免疫组化染色,探讨aGPCRs在胰腺癌中的表达及其临床意义,挖掘潜在的临床价值。
1 材料与方法
1.1 生物信息学分析利用Oncomine(www.oncomine.org)、GEPIA2(http://gepia2.cancer-pku.cn/)数据库寻找胰腺癌与正常胰腺组织之间在转录组水平广泛差异表达的aGPCRs;利用K-M plotter(http://kmplot.com/)数据库,通过选择“Auto select best cutoff”和“OS”,获得aGPCRs转录组表达水平与生存期之间Log-rank检验的P值、风险比和95%置信区间,分析差异表达aGPCRs转录组水平与胰腺癌患者预后的相关性。
1.2 临床资料收集2016~2018年安徽省立医院存档的胰腺癌组织及其癌旁组织各58例,胰腺癌组织术后病理检查均证实为胰腺导管腺癌,患者术前均未行放、化疗,经术后随访获取患者预后情况。患者年龄41~80岁,平均(63.09±9.232)岁,其中男性37例,女性21例;肿瘤直径>4 cm者20例,≤4 cm者38例;根据2018年美国AJCC临床分期:Ⅰ+Ⅱ期36例,Ⅲ+Ⅳ期22例;有淋巴结转移者32例,无淋巴结转移者26例;根据国际UICC组织分级:低分化30例,高+中等分化28例;有神经浸润41例,无神经浸润17例。
1.3 免疫组化利用临床胰腺癌及其癌旁组织中mRNA水平广泛差异表达且与患者预后相关的aGPCRs蛋白水平表达情况,采用免疫组化SP两步法进行染色,抗原修复采用高压蒸汽法,兔抗人ADGRA2、ADGRC3、ADGRF1、ADGRG6、ADGRE5、ADGRF4多克隆抗体购自博奥森生物公司,DAB显色试剂盒及通用SP试剂盒购自北京中杉金桥生物公司。以HPA(https://www.proteinatlas.org/)数据库明确为阳性的标本作为阳性对照组,以PBS缓冲液作为阴性对照。
1.4 结果判断染色结果由两位病理医师独立评估。随机选取5个高倍镜视野,根据阳性细胞的百分比进行评分:≤10%为0分,11%~25%为1分,26%~50%为2分,>50%以上为3分;另根据阳性细胞着色强度进行评分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。最终将两项评分相乘,其中≥6分归为高表达组,<6分为低表达组。
1.5 统计学分析采用SPSS 20.0软件进行统计学分析。采用χ2检验或Fisher精确检验分析蛋白表达与临床病理特征的相关性;采用Kaplan-Meier生存曲线及Log-rank检验分析目的蛋白表达与预后的相关性;采用Cox回归模型进行单因素和多因素生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌中aGPCRs mRNA的表达Oncomine、GEPIA2数据库检测发现,胰腺癌组织中11个aGPCRs(ADGRE5、ADGRA2、ADGRC3、ADGRF1、ADGRF4、ADGRG1、ADGRG6、ADGRL4、ADGRF5、ADGRL2、ADGRE2)的mRNA广泛高表达(P<0.05)。K-M plotter数据库检测发现,ADGRE5、ADGRF1、ADGRF4、ADGRG6 mRNA表达与患者预后呈负相关,ADGRA2、ADGRC3 mRNA表达与患者预后呈正相关(P<0.05)。结果提示ADGRE5、ADGRA2、ADGRC3、ADGRF1、ADGRF4、ADGRG6可作为胰腺癌预后的生物学标志物,可能是胰腺癌发生、发展的潜在因子(图1)。

图1 Oncomine数据库(A)、GEPIA2数据库(B)中aGPCRs mRNA表达水平及其与患者预后的相关性(C):N.癌组织;T.正常组织
2.2 胰腺癌组织中ADGRF4、ADGRE5、ADGRC3蛋白表达免疫组化结果显示,ADGRA2、ADGRF1在癌旁组织中的表达水平高于胰腺癌组织,差异无统计学意义;ADGRG6在癌旁组织及胰腺癌组织中均未见明显表达;ADGRF4、ADGRE5、ADGRC3在胰腺癌组织中表达高于癌旁组织,差异有统计学意义(P<0.01,图2)。ADGRF4表达定位于细胞膜和细胞质,部分病例可见胞核强阳性,阳性率为84%(49/58);ADGRE5表达定位于细胞质和细胞膜,阳性率达95%(55/58);ADGRC3表达主要定位于细胞质,阳性率为52%(30/58)。
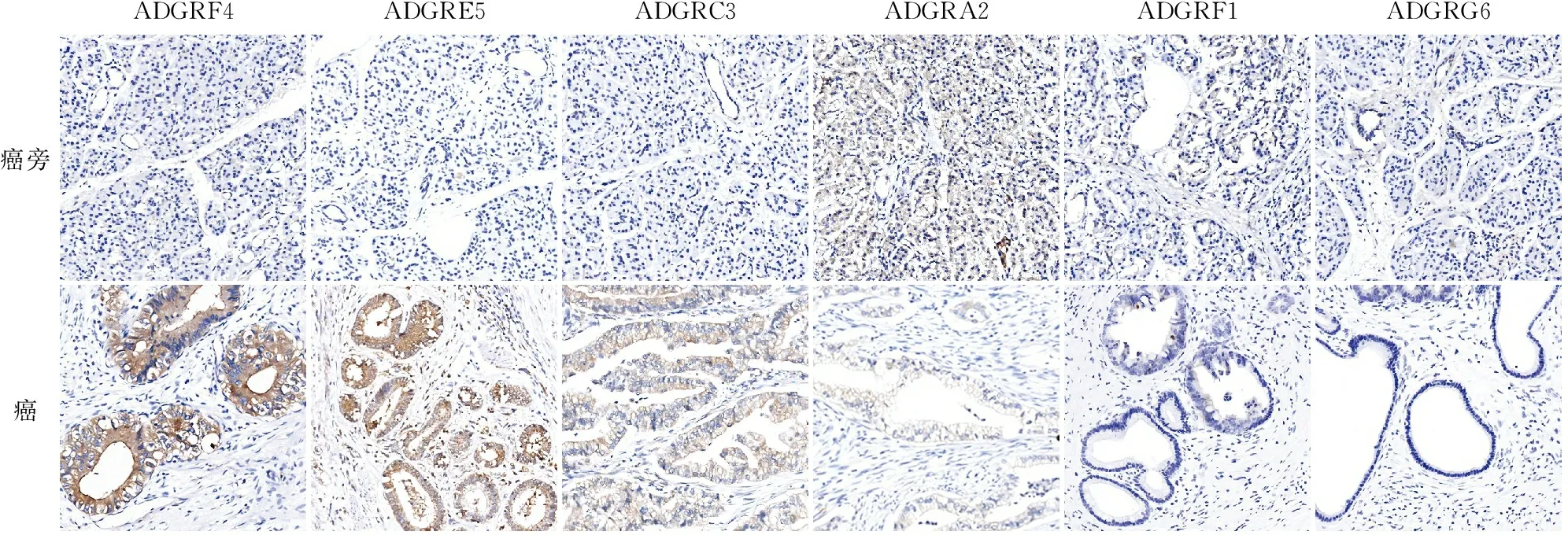
ADGRF4ADGRE5ADGRC3ADGRA2ADGRF1ADGRG6癌旁癌
2.3 ADGRF4、ADGRE5表达与胰腺癌临床病理特征的关系统计分析显示,ADGRC3表达与胰腺癌各项临床病理特征均不相关;ADGRF4表达与患者年龄、性别、TNM分期、淋巴结转移、肿瘤分化程度无关,与肿瘤直径、神经浸润呈正相关(P<0.05);ADGRE5表达与患者年龄、性别、肿瘤分化程度、神经浸润无关,与临床分期、肿瘤直径、淋巴结转移呈正相关(P<0.05,表1)。

表1 ADGRF4、ADGRE5表达与胰腺癌临床病理特征的关系
2.4 ADGRF4、ADGRE5蛋白表达与胰腺癌患者预后的相关性Kaplan-Meier生存分析结果显示,ADGRF4、ADGRE5蛋白表达水平与患者预后呈负相关(P<0.01,图3)。Cox单因素回归分析显示,TNM分期、肿瘤直径、淋巴结转移、ADGRF4表达、ADGRE5表达,均是胰腺癌患者预后的影响因素(P<0.05,表2),Cox多因素分析结果显示,TNM分期、肿瘤直径、ADGRF4表达是胰腺癌患者预后的独立影响因素(P<0.05,表2)。

图3 Kaplan-Meier生存曲线分析ADGRF4(A)、ADGRE5(B)与胰腺癌患者预后的相关性

表2 Cox单因素及多因素分析胰腺癌患者预后相关因素
3 讨论
胰腺癌是一种恶性程度极高的消化系统肿瘤,在我国其发病率呈逐年升高趋势,病死率位居恶性肿瘤的第7位[6]。GPCRs是最大的跨膜蛋白超家族,由于其结构的特殊性和功能的多样化,全球约34%的靶向药物针对GPCRs[7-8],其在肿瘤中的研究具有巨大的潜在价值。aGPCRs因具有一个大的细胞外黏附结构域和七次跨膜结构域被命名,表现为细胞黏附功能和信号转导功能[9]。也因其结构复杂,aGPCRs相关研究一直较少,半数以上受体仍为孤儿受体,未能找到特异性配体[10]。近年,aGPCRs参与恶性肿瘤增殖、转移和肿瘤细胞间通讯的功能逐渐被发现[11-12]。
ADGRF4是ADGRF亚家族成员之一,又被命名为GPR115、PGR18。目前,关于ADGRF4的研究十分有限。2020年Chiba等[13]发现ADGRF4通过调控成釉细胞中CAR6的表达参与牙釉质的矿化过程。在肿瘤领域,有研究通过高通量测序技术发现,ADGRF4在甲状腺癌、结肠癌中表达升高,但并未展开深入的实验性研究[14-15]。本实验通过生物信息学分析结合免疫组化染色首次探讨ADGRF4在胰腺癌中的表达情况,发现ADGRF4在胰腺癌中高表达,是胰腺癌患者预后的独立危险因素,其表达与肿瘤直径、神经浸润呈正相关。神经浸润是指肿瘤细胞侵入神经或神经周围。已往多项研究报道[16-17],胰腺癌的神经浸润率是所有恶性肿瘤中最高的,是胰腺癌的重要特征,也是胰腺癌侵袭性行为和预后不良的重要指标。ADGRF4是否通过影响神经浸润发挥促癌作用,是下一步研究的方向。
ADGRE5是ADGRE亚家族成员之一,又被命名为TM7LN1、CD97,广泛存在于淋巴细胞、单核细胞、粒细胞和平滑肌等细胞的表面[18]。目前关于ADGRE5在肿瘤中的研究相对较多,被发现在包括甲状腺癌、胃癌、结肠癌、前列腺癌中异常表达或存在生化修饰,在肿瘤外缘具有强侵袭作用的癌细胞中表达则更为显著[19],其表达与肿瘤分期、淋巴结转移以及预后密切相关[20]。实际上,关于ADGRE5在胰腺癌中的表达早前亦有报道。Boltze等[21]采用免疫组化法检测50例胰腺癌组织、40例胰腺炎组织、36例正常胰腺组织中ADGRE5的表达,发现ADGRE5在胰腺炎中表达较强,在低分化胰腺癌中弱表达,而在正常胰腺和中、高分化胰腺癌组织中并不表达。Aust等[22]采用免疫组化法检测18例胰腺癌组织和流式细胞术检测胰腺癌细胞系PANC-1、BXPC3中ADGRE5的表达,发现两种细胞系和14例胰腺癌组织中ADGRE5均阳性。本实验发现,ADGRE5在胰腺癌中广泛表达,阳性率高达95%(55/58),本组样本量较上述两项研究稍多,初步解决了ADGRE5在胰腺癌组织中表达的争议问题。机制方面,ADGRE5在肿瘤中的作用机制多样,如通过其细胞外结构域与整合素a5b1和avb3相互作用促进血管内皮细胞迁移和生成[23]、对BCL-2超家族中抗凋亡和促凋亡成员的调节[24]等,本实验中ADGRE5表达与TNM分期、肿瘤直径、淋巴结转移密切相关,是胰腺癌患者预后的危险因素之一,ADGRE5可能广泛参与胰腺癌发生、发展等多个环节,其深入机制仍有待于进一步探究。
综上所述,本实验以胰腺癌作为研究对象,利用生物信息学分析系统性初筛、临床样本验证,在mRNA和蛋白水平探讨aGPCRs在胰腺癌中的表达模式及其生物学意义。实验结果表明,ADGRE5、ADGRA2、ADGRC3、ADGRF1、ADGRF4、ADGRG6 mRNA在胰腺癌组织中高表达,且与患者预后相关,是胰腺癌潜在的预后生物学标志物。ADGRF4、ADGRE5在蛋白水平高表达且与胰腺癌临床病理特征密切相关,是胰腺癌患者预后的危险因素,随着对其结构和功能机制的深入研究,有望成为胰腺癌治疗的重要靶点。
