RACK1通过调控脂质合成促进子宫颈癌ME180细胞侵袭、迁移及增殖
2022-09-28徐丽秀李金秋哈提拉吐尔逊阿仙姑哈斯木
徐丽秀,李金秋,哈提拉·吐尔逊,阿仙姑·哈斯木
子宫颈癌作为新疆地区高发肿瘤,严重影响该地区女性的生活质量。晚期子宫颈癌细胞侵袭能力增强及淋巴结转移的发生,给子宫颈癌的治疗带来巨大挑战[1]。因此,寻找子宫颈癌早期诊断的特异性指标或有效的治疗靶点,形成子宫颈癌早期诊断及治疗的有效策略是亟待解决的问题。有研究报道,不同阶段的肿瘤细胞需要改变它们的代谢嗜好来适应自身所处环境的能量短缺[2]。其中,肿瘤细胞内脂质蓄积现象常常存在于恶性程度较高的肿瘤类型[3]。本组前期实验发现,子宫颈癌细胞中脂滴的蓄积明显提高子宫颈癌细胞C33a和SiHa的侵袭、迁移能力[4]。
活化C激酶受体1(receptor for activated C kinase, RACK1)在包括子宫颈癌在内的实体肿瘤的增殖和生长中起重要作用。RACK1已被作为多种肿瘤的生物标志物[5],RACK1与OXER1结合增强PI3K/Akt信号活化,促进乳腺癌的恶性进展[6]。然而,RACK1在子宫颈癌脂质代谢中的作用机制仍未明确,RACK1是否通过参与脂质代谢来影响子宫颈癌细胞的侵袭、迁移等生物学行为尚未见文献报道。本实验以子宫颈癌ME180细胞为研究对象,明确RACK1对脂质代谢的调控作用以及对子宫颈癌细胞的恶性生物学行为的影响,为提高对子宫颈癌恶性进展过程中脂质代谢改变的认识水平提供理论依据。
1 材料与方法
1.1 一般资料收集新疆医科大学第一附属医院存档的25例子宫颈癌手术切除标本及25例癌旁正常子宫颈上皮组织(距癌组织>3 cm),将组织置于-80 ℃冰箱保存用于qRT-PCR实验。本实验经新疆医科大学第一附属医院伦理委员会批准,所有患者均知情同意。
1.2 试剂BODIPY试剂购自美国罗氏公司;慢病毒由上海吉凯公司负责构建;FASN兔抗人一抗购自美国Abcam公司;ACC1和β-actin兔抗人一抗购自武汉三鹰公司;油酸(OA)购自美国MCE公司;Coy’5A培养基购自武汉普诺赛公司。ME180细胞购自武汉普诺赛公司,SiHa和H8细胞由新疆医科大学第一附属医院临床研究院提供并保存。
1.3 方法
1.3.1细胞培养 培养ME180细胞的Coy’5A培养基及培养H8与SiHa细胞的DMEM培养基中均添加10%胎牛血清及1%青霉素-链霉素。
1.3.2qRT-PCR 使用Trizol法从组织和细胞样本中提取总RNA,随后利用逆转录试剂盒将1 μg总RNA转录为cDNA。采用SYBR Green PCR Kit对cDNA进行qRT-PCR扩增分析。以β-actin为内参基因进行归一化处理后得到对应基因的相对表达量。本实验中使用的PCR引物序列详见表1。
1.3.3慢病毒转染及分组 sh-RACK1慢病毒及其对照慢病毒(sh-NON)由上海吉凯基因负责构建。
按照吉凯公司提供的慢病毒转染手册进行转染实验,转染72 h后,用5 μg/mL嘌呤霉素筛选转染成功的子宫颈癌ME180细胞,作用时长为1周。将筛选存活下来的ME180细胞使用2.5 μg/mL嘌呤霉素继续培养。
1.3.4Western blot法 细胞于细胞裂解和蛋白酶抑制剂混合物中裂解30 min,将得到的蛋白上清进行定量后样品使用8%SDS-PAGE凝胶进行电泳分离,然后转移至PVDF膜。PVDF膜经5%脱脂牛奶封闭后进行一抗孵育,所用抗体有FASN(稀释比1 ∶5 000)、ACC1(稀释比1 ∶10 000)、β-actin(稀释比1 ∶8 000)。随后与辣根过氧化物标记山羊抗兔二抗(稀释比1 ∶10 000)避光孵育,并通过化学发光仪显影。
1.3.5Transwell实验 Transwell迁移测定:将5×104细胞接种于不含Matrigel的上室内;Transwell侵袭测定:上室加入60 μL的200 mg/mL Matrigel,孵育箱中凝固2 h,随后向室中加入5×104个细胞,24 h后取出24孔板,使用4%多聚甲醛溶液固定细胞10 min,PBS冲洗细胞3次,于1%结晶紫工作液中室温孵育10 min后用PBS清洗,倒置显微镜下观察下室底面细胞数。
1.3.6平板克隆 使用6孔板进行克隆形成实验。将ME180细胞以每孔5×103个细胞进行培养,培养7~10天观察集落大小及数量。
1.3.7CCK-8 OA使用文献[7]报道的方法进行溶解储存。ME180细胞以每孔1×103个细胞的密度接种于96孔板中,并暴露于OA中24 h后,使用CCK-8试验盒检测OA作用24 h的细胞增殖情况。
1.3.8柠檬酸和脂肪酸含量检测 ME180细胞以每毫升1×106个细胞的密度,合计1 mL接种于6 cm培养皿,待细胞贴壁后更换为不含10%胎牛血清的Coy’5A培养基于孵育箱中培养24 h。收集ME180细胞的上清液,利用对应检测试剂盒指导说明检测上清液中柠檬酸和脂肪酸含量。
1.3.9BODIPY染色 去除细胞培养基,使用PBS清洗ME180细胞,用4%多聚甲醛溶液固定细胞10 min后PBS冲洗细胞3次。于BODIPY试剂中避光孵育30 min,用PBS清洗后DAPI避光孵育10 min,PBS清洗10 min后于激光共聚焦显微镜下拍照。
1.3.10电镜观察脂滴含量 取1×106个细胞给予沉淀,加入2.5%戊二醛4 ℃过夜,用PBS漂洗10 min×3次;1%四氧化锇固定1.5 h,PBS漂洗后经不同梯度乙醇(50%、70%、80%、90%、100%)进行脱水处理;分别浸泡于50%丙酮1 h,75%丙酮3 h,100%丙酮24 h后进行切片,于电镜下观察脂滴含量。
2 结果
2.1 子宫颈癌组织中RACK1的表达qRT-PCR检测结果显示,子宫颈癌组织中RACK1 mRNA的表达(2.38±1.78)显著高于癌旁正常子宫颈组织(0.43±0.47)(P<0.001,图1A)。利用qRT-PCR和Western blot法分别从转录及蛋白水平验证RACK1在子宫颈癌细胞(ME180、SiHa细胞)和正常子宫颈上皮细胞(H8细胞)中的表达情况。结果显示RACK1 mRNA在子宫颈癌细胞中高表达,且在ME180细胞中表达最高(ME180vsSiHavsH8为1.67±0.05vs1.39±0.08vs1.00±0.03,P<0.001,图1B)。蛋白表达结果与转录水平结果一致(ME180vsSiHavsH8为1.58±0.08vs1.32±0.08vs0.41±0.08,P<0.001,图1C)。

图1 A.qRT-PCR检测子宫颈癌组织和癌旁正常子宫颈组织中RACK1 mRNA表达水平;B.qRT-PCR检测子宫颈癌细胞和正常子宫颈上皮细胞中RACK1 mRNA表达水平;C.Western blot法检测子宫颈癌细胞和正常子宫颈上皮细胞中RACK1蛋白表达水平
2.2 RACK1表达与子宫颈癌脂质合成的相关性BODIPY染色结果表明,ME180细胞(1.10±0.15)中脂质含量最高,与ME180细胞和SiHa细胞(0.36±0.21)相比,H8细胞(0.15±0.01)内脂质含量最低,差异有统计学意义(P<0.05,图2A);qRT-PCR结果显示子宫颈癌组织中的脂肪酸合成关键因子FASN和ACC1的mRNA表达水平(2.98±1.53、2.41±1.25)显著高于癌旁正常子宫颈组织(0.85±0.37、0.69±0.28)(P<0.001,图2B),进一步分析发现RACK1 mRNA表达分别与FASN和ACC1 mRNA表达呈正相关(r=0.693,P<0.001;r=0.752,P<0.001,图2C)。结果提示RACK1表达与子宫颈癌脂质合成呈正相关。

图2 RACK1表达与子宫颈癌脂质合成的相关性:A.BODIPY染色检测子宫颈癌细胞中脂质含量;B.qRT-PCR检测子宫颈癌组织和癌旁正常子宫颈组织中FASN和ACC1 mRNA表达水平;C.RACK1 mRNA和FASN、ACC1 mRNA表达的相关性分析
2.3 RACK1对子宫颈癌脂质合成能力的影响qRT-PCR结果显示,shRACK1-ME180组细胞中FASN(0.27±0.02)和ACC1(0.24±0.03)的mRNA表达显著低于shNON-ME180组(1.00±0.01、1.00±0.01)(P均<0.001,图3A)。Western blot结果显示shRACK1-ME180组细胞中FASN(0.32±0.03)和ACC1(0.17±0.03)的蛋白表达低于shNON-ME180组(1.77±0.09、1.80±0.08)(P均<0.001,图3A)。BODIPY染色结果表明,与shNON-ME180组(1.09±0.16)相比,shRACK1-ME180组(0.62±0.09)细胞内FITC-绿色荧光信号显著减弱,表明细胞内脂滴含量减少(P<0.05,图3B);电镜下观察结果与BODIPY染色结果一致(图3C)。shRACK1-ME180组细胞内柠檬酸(3.46±0.77)、脂肪酸(0.94±0.07)含量较shNON-ME180组的柠檬酸(5.89±0.47)、脂肪酸(2.13±0.27)含量显著下降(P<0.001,图3D)。结果提示下调RACK1表达可降低子宫颈癌细胞中脂质合成原料的含量,抑制脂肪酸合成关键酶表达进而抑制细胞内脂质的蓄积。

图3 shRACK1对ME180细胞脂质合成能力的影响:A.qRT-PCR和Western blot法检测下调RACK1表达后FASN、ACC1 mRNA和蛋白水平的改变;B.BODIPY染色检测下调RACK1表达后细胞内脂质含量的变化;C.电镜下观察下调RACK1表达后细胞内脂滴含量的改变;D.下调RACK1表达后细胞内柠檬酸、脂肪酸含量的改变
2.4 下调RACK1表达对ME180细胞侵袭、迁移、增殖能力的影响Transwell实验结果显示,shRACK1-ME180组细胞侵袭和迁移能力显著低于shNON-ME180组细胞(图4A)。平板克隆实验结果表明,相较于shNON-ME180组,shRACK1-ME180组细胞克隆数量形成明显减少(图4B)。结果表明,下调RACK1表达能够减弱ME180细胞的侵袭、迁移、增殖能力。
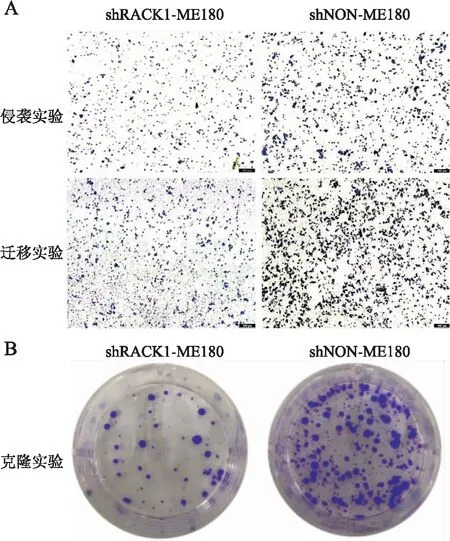
图4 shRACK1对ME180细胞恶性生物学行为的影响:A.Transwell侵袭实验和迁移实验检测下调RACK1表达后细胞侵袭和迁移能力的改变;B.细胞平板克隆实验检测下调RACK1表达后细胞增殖能力的改变
2.5 外源性脂肪酸对shRACK1-ME180细胞侵袭、迁移、增殖能力的影响CCK-8结果显示,不同浓度(0、50、100、200、400 μmol/L)OA作用于shRACK1-ME180细胞24 h,从100 μmol/L OA起能够逆转shRACK1-ME180细胞增殖能力的抑制(图5)。Transwell实验结果显示,添加100 μmol/L OA后,shRACK1-ME180组细胞侵袭与迁移水平恢复至与shNON-ME180组相近(图6A)。平板克隆实验结果表明,相较于shRACK1-ME180组,添加OA促进shRACK1-ME180组细胞克隆形成数量明显增加(图6B)。结果表明,外源性脂肪酸的补充能够恢复因RACK1下调所抑制的ME180细胞侵袭、迁移、增殖能力。

图5 CCK-8实验检测OA对ME180细胞增殖能力的影响

图6 OA对shRACK1-ME180细胞恶性生物学行为的影响:A.侵袭实验和侵袭实验检测OA对下调RACK1表达后细胞侵袭、迁移能力的改变;B.细胞平板克隆检测OA对下调RACK1表达后细胞增殖能力的改变
3 讨论
肿瘤细胞中脂质代谢异常是肿瘤恶性生物学特征之一[8],肿瘤恶性演进过程中常伴有脂质合成增加,以中晚期阶段尤为突出[9]。BODIPY染色发现具有转移特性子宫颈癌ME180细胞内脂滴含量显著高于SiHa细胞,以上结果提示ME180细胞中脂质蓄积增加可能与ME180细胞的转移特性有关,由此推测子宫颈癌细胞的恶性进展过程伴随着代谢形式的改变。为探讨RACK1表达是否通过改变细胞内脂质含量进而影响子宫颈癌恶性进展,加入正常子宫颈上皮H8细胞验证以上3株细胞中RACK1表达水平,进一步探讨RACK1与细胞内脂质蓄积是否相关。结果显示具有转移特性子宫颈癌ME180细胞中RACK1表达最高,其次为SiHa细胞,H8细胞表达最低,BODIPY染色结果与细胞内RACK1表达显著相关,提示ME180细胞中脂质蓄积增加可能与ME180细胞的转移特性有关,由此推测子宫颈癌细胞的恶性进展过程伴随着代谢形式的改变,且RACK1可能是调控这种现象的关键致癌因子。因此,本实验以ME180细胞为研究对象,探索RACK1是否参与子宫颈癌细胞的脂质代谢调控进而影响子宫颈癌细胞的恶性生物学行为。
RACK1作为一种经典支架蛋白,通过介导蛋白间相互作用参与细胞中多种活动[5];研究发现RACK1在结肠癌和胃癌中作为抑癌基因发挥作用[10-11],而在结肠癌、乳腺癌、口腔鳞状细胞癌等肿瘤中扮演着癌基因的角色[5,12-13]。Wu等[10]发现RACK1与Galectin-1结合活化下游信号通路促进子宫颈癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)的发生,且提高细胞侵袭能力以及淋巴管生成,导致癌细胞的淋巴结转移。而周小庆等[11]研究发现子宫颈癌中RACK1表达显著低于正常子宫颈上皮组织。以上文献提示RACK1在子宫颈癌中的作用有待进一步探究考证。本实验发现RACK1在子宫颈癌组织中显著过表达;细胞水平进一步验证发现与正常子宫颈上皮细胞相比,两种子宫颈癌细胞中RACK1高表达,特别是在ME180细胞中RACK1表达最高,提示RACK1可能与子宫颈癌细胞恶性进展相关。近期研究发现RACK1与AMPK上T172磷酸化位点结合,活化AMPK阻止胆固醇通量的细胞外溢,降低泡沫细胞内的胆固醇蓄积,减少动脉粥样硬化的发生[14];RACK1可以干扰肝细胞和巨噬细胞内脂质累积,阻碍疾病的进展[15]。然而RACK1在肿瘤中脂质调节的研究较少,特别是在子宫颈癌中RACK1与脂质代谢的关系尚未可知。本实验利用临床样本发现,RACK1表达与FASN和ACC1表达呈正相关性,下调RACK1表达可以显著抑制子宫颈癌ME180细胞的脂质合成关键酶FASN和ACC1的转录水平以及蛋白表达;BODIPY实验表明抑制RACK1表达使细胞内的脂质蓄积明显降低;电镜结果进一步证实BODIPY实验结果。
正常细胞内脂质含量较少且优先利用外源性脂肪酸合成脂质满足自身所需,但肿瘤细胞除了利用外源性脂肪酸合成脂类外,还会提高自身脂肪酸合成来满足细胞快速增殖所需的能量[16-17]。文献报道胰腺癌细胞依赖于利用脂肪酸从头合成来维持自身恶性表型,而前列腺癌细胞则更倾向于对外源性脂质的摄取[18]。Grunt等[19]发现,卵巢癌细胞短期内受到G28UCM的处理,能够抑制内源性脂肪酸合成,但未影响外源性脂肪酸的摄取能力,然而随着药物作用时间的延长,脂肪酸自身合成及摄取能力均显著降低,肿瘤细胞生长受阻。为进一步明确RACK1对ME180细胞内源性和外源性脂质的调控作用,分别对脂肪酸从头合成能力以及外源性脂肪酸摄取能力进行检测。文献报道外源性补充柠檬酸、脂肪酸可以逆转小檗碱对子宫颈癌细胞脂质合成的抑制作用,进而恢复子宫颈癌细胞的增殖水平[20]。根据以上文献提示,柠檬酸、脂肪酸作为脂质合成的重要原料,检测其含量变化有利于了解RACK1对内源性脂质合成的影响。本实验结果显示,shRACK1-ME180组细胞内柠檬酸、脂肪酸含量均不同程度的降低,与shNON-ME180组比较,柠檬酸含量下降约1.7倍、脂肪酸含量下降约2.7倍,以上结果提示RACK1能够有效抑制脂质合成原料的生成,从而抑制脂质的从头合成。随后实验进一步探讨RACK1下调后对ME180细胞外源性脂肪酸摄取能力的影响。通过向shRACK1-ME180组细胞培养基中补充100 μmol/L OA(外源性脂肪酸),观察ME180细胞侵袭、迁移、增殖能力是否改变。Transwell侵袭及迁移结果显示,添加OA 24 h时shRACK1-ME180组细胞穿至下室底面的细胞数均恢复至与shNON-ME180组细胞数量接近的水平,CCK-8实验与平板克隆结果表明添加OA的shRACK1-ME180组细胞的增殖能力显著提高,且与shNON-ME180组细胞克隆数量相当。提示外源性脂肪酸的添加可以逆转RACK1下调而抑制的ME180细胞侵袭、迁移、增殖能力,以上结果表明下调RACK1表达并未抑制ME180细胞摄取外源性脂肪酸的能力。
综上所述,下调RACK1表达抑制子宫颈癌细胞的脂质合成,进而遏制子宫颈癌细胞的侵袭、迁移、增殖等生物学行为。其中,RACK1下调主要调控脂质合成原料的生成减少,降低脂质从头合成,但未减弱ME180细胞对外源性脂肪酸的摄取能力。本实验为子宫颈癌进展与代谢之间的复杂机制提供一定的理论基础。
