化生性乳腺癌中SOX9、CD133和EpCAM的表达及临床意义
2022-09-28陈翔宇
陈翔宇,王 弦,2,胡 月,3,吴 强,4
乳腺癌是女性最常见的恶性肿瘤,也是女性癌症死亡的主要原因之一[1]。化生性乳腺癌(metaplastic breast cancer, MBC)是乳腺癌中具有肿瘤性上皮向鳞状细胞和(或)间叶成分分化特征的肿瘤[2],其预后差[3],至今无可靠的预后指标。研究表明,MBC中富含乳腺癌肿瘤干细胞(breast cancer stem cells, BCSC),并因此出现上皮向间质分化的特征,同时这种特征使MBC更具有侵袭性和化疗抗性[4]。既往实验发现,SOX9可以调节肿瘤干细胞(cancer stem cells, CSC),促进癌症的进展[5]。在乳腺癌中,SOX9对维持BCSC群的功能至关重要,高表达的SOX9与乳腺癌肿瘤的进展相关[6]。MBC中富含BCSC,但目前尚无SOX9与BCSC标志物相关性的研究。故本实验采用免疫组化法检测MBC中SOX9及BCSC标志物的表达,分析其与MBC临床病理特征和预后的关系。
1 材料与方法
1.1 临床资料收集2011~2020年安徽医科大学第一、二附属医院存档的42例MBC手术切除标本及患者的临床资料,患者手术前均未接受过新辅助化疗。所有肿瘤诊断标准参照WHO(2019)MBC组织学分型。根据肿瘤成分类型分类:鳞状细胞癌22例、梭形细胞癌5例、低级别腺鳞癌1例、伴异源性间叶样分化型7例、含两种及两种以上化生成分MBC 7例。此外,42例MBC中同时具有化生型成分和浸润性乳腺癌非特殊型(invasive breast carcinoma of no special type, IBC-NST)者38例,其中鳞状细胞癌21例,化生成分占30%~90%;梭形细胞癌5例,化生成分占50%~70%;伴异源性间叶样分化型7例,化生成分占40%~80%;含两种及两种以上化生成分MBC 5例,化生成分占70%~90%。每半年以查询病例或电话对患者进行随访。无进展生存期(progression-free survival, PFS)定义为手术至患者出现复发、转移或死亡的时间,随访以手术时间为始,截至2021年3月,随访12~104个月。
1.2 试剂兔抗人SOX9多克隆抗体(北京博奥森公司),鼠抗人CD133单克隆抗体(武汉三鹰公司),鼠抗人EpCAM多克隆抗体(武汉三鹰公司),小鼠/兔聚合法检测通用性试剂盒,DAB显色试剂盒均购自福州迈新公司。
1.3 方法
1.3.1生物信息学分析 从基因表达综合数据库(gene expression omnibus database, GEO)网站(www.ncbi.nlm.nih.gov)选取MBC数据集(GSE 57544),提取SOX9及常用的BCSC标志物[7]CD44、CD24、EpCAM、CD133、ALDH1表达量,分析它们之间的相关性。
1.3.2免疫组化 42例MBC手术标本均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,分别行HE和免疫组化EnVision两步法染色。切片脱蜡水化,柠檬酸高压抗原修复,PBS缓冲液冲洗,滴加一抗,4 ℃过夜孵育,二抗室温孵育20 min,DAB显色,苏木精染色,脱水透明后,镜下观察。
1.4 结果判读SOX9[8]以MBC中化生性成分细胞核出现黄色或棕黄色颗粒为阳性;CD133[9]及EpCAM[10]以MBC中化生性成分胞膜、胞质出现黄色或棕黄色颗粒为阳性。评分标准:判读MBC化生区域细胞阳性率及染色强度。(1)按阳性细胞百分比评分:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。(2)按阳性细胞染色强度评分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘:总分0~1分为阴性,2~12分为阳性,以染色总分的中位数作为区分SOX9、CD133和EpCAM高低表达的指标。ER、PR以化生性区域肿瘤细胞核阳性细胞比例≥1%为阳性。HER-2表达0及1+为阴性,2+为不确定,3+为阳性。42例中有1例HER-2为2+病例,FISH检测为HER-2基因扩增,定为阳性。
1.5 统计学分析采用GraphPad Prism 6.0.1软件及SPSS 21.0软件进行统计学分析,组间比较采用χ2检验或Fisher精确检验,连续变量的差异性分析采用Mann-WhitneyU检验,应用Spearman等级相关检验分析相关性,采用Kaplan-Meier曲线进行生存分析,采用Cox回归模型进行多因素和单因素生存分析,以P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析MBC中SOX9与常见BCSC标志物的相关性提取GEO数据集28例MBC患者的SOX9和常用BCSC标志物的表达量,分析其相关性,结果显示SOX9表达与CD44表达无相关性(rs=0.139,P=0.447),与CD24表达呈正相关(rs=0.647,P<0.01),与CD133表达呈正相关(rs=0540,P<0.01,图1),与EpCAM表达呈正相关(rs=0.554,P<0.01,图1),与ALDH1表达无相关性(rs=0.261,P=0.179)。虽然CD24与SOX9表达呈正相关,但通常以CD44和CD24联合作为BCSC标志物。故本实验选用EpCAM与CD133作为BCSC标志物。

图1 生物信息学分析MBC中SOX9与BCSC标志物CD133及EpCAM的相关性
2.2 MBC中SOX9的表达及其与临床病理特征的相关性在MBC化生成分中SOX9表达定位于肿瘤细胞胞核,呈弥漫阳性(图2)。SOX9阳性率为83.3%(35/42),高表达率为47.6%(20/42),免疫组化染色评分中位数为4,平均数为5±3.4。SOX9表达与淋巴结转移、远处转移、高TNM分期呈正相关(P均<0.05),与患者年龄、肿块直径、Ki-67增殖指数、ER表达、PR表达、HER-2表达及化生成分无关(表1),Kaplan-Meier生存分析显示,SOX9表达与患者3年PFS呈负相关(P<0.05,图3)。
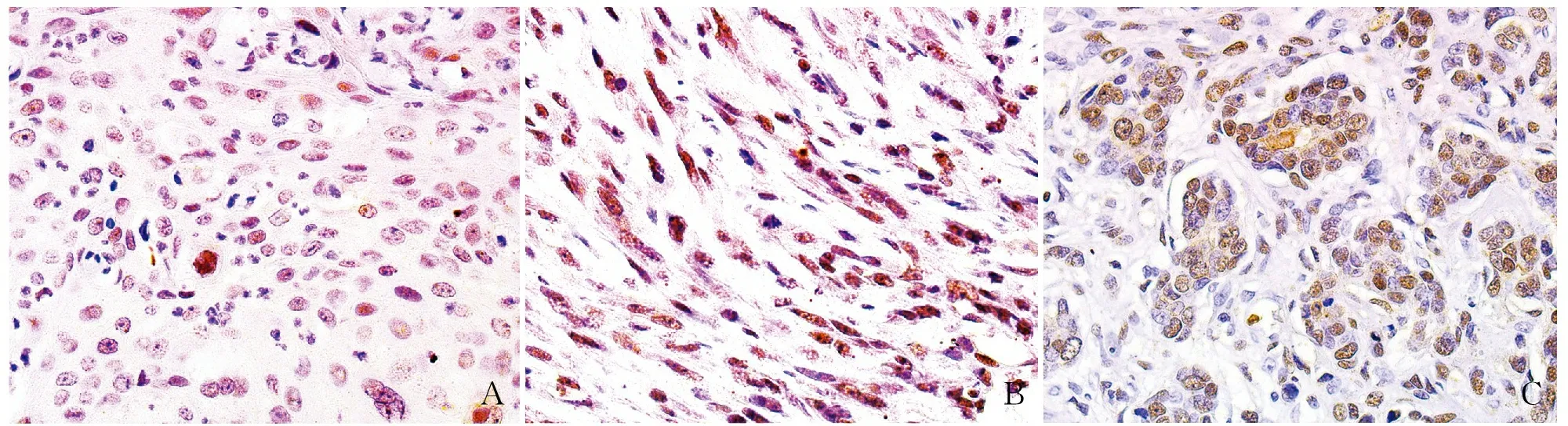
ABC
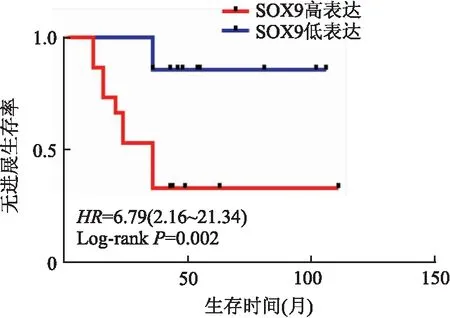
图3 SOX9表达与MBC患者PFS的关系
2.3 MBC中CD133的表达及其与临床病理特征的相关性MBC化生成分中CD133阳性定位于肿瘤细胞胞膜和胞质,呈弥漫阳性(图4),CD133的阳性率为73.8%(31/42例),高表达率为57.1%(24/42),免疫组化染色评分中位数为4,平均数为4.5±2.7。CD133表达与远处转移呈正相关(P<0.05),与患者年龄、肿块大小、TNM分期、淋巴结转移、Ki-67增殖指数、ER表达、PR表达、HER-2表达及化生成分无关(表1),Kaplan-Meier生存分析显示,CD133表达与患者3年PFS呈负相关(P<0.05,图5)。
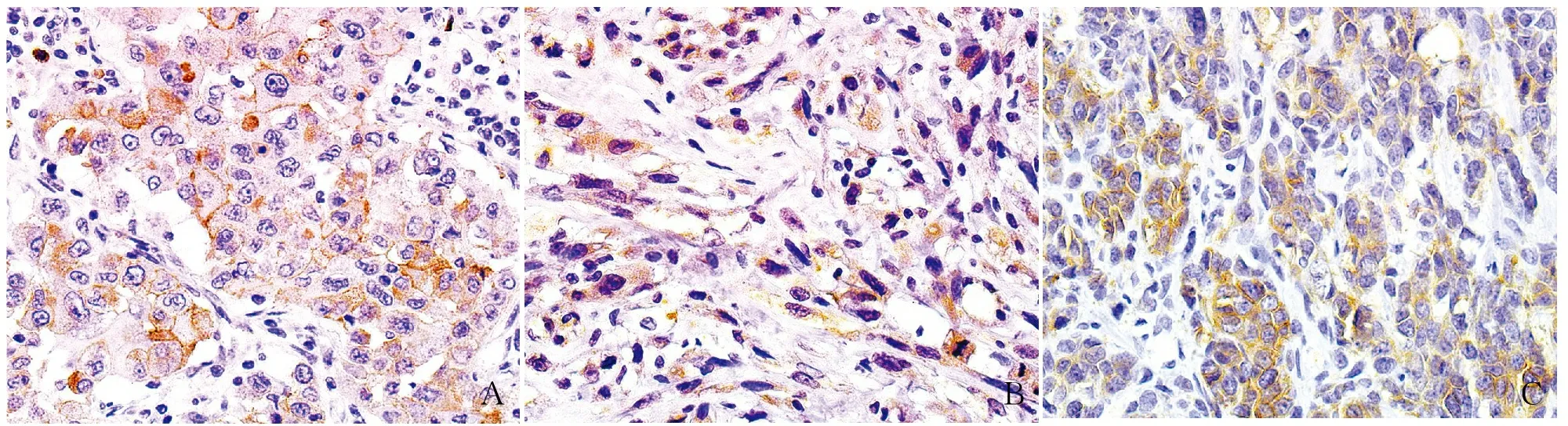
ABC

图5 CD133表达与MBC患者PFS的关系
2.4 MBC中EpCAM的表达及其与临床病理特征的相关性在MBC化生成分中EpCAM阳性主要定位于肿瘤细胞胞膜和胞质,肿瘤细胞中呈弥漫阳性(图6)。EpCAM的阳性率为88.1%(37/42),高表达率为45.2%(19/42),免疫组化染色评分中位数为6,平均数为6±3.5。EpCAM表达与患者年龄、淋巴结转移呈正相关(P均<0.05),与肿块大小、TNM分期、远处转移、Ki-67增殖指数、ER表达、PR表达和HER-2表达无相关性(表1)。EpCAM在两种以上化生成分型MBC中的表达高于单一化生成分型(P<0.05)。Kaplan-Meier生存分析显示,EpCAM表达与患者3年PFS呈负相关(P<0.05,图7)。
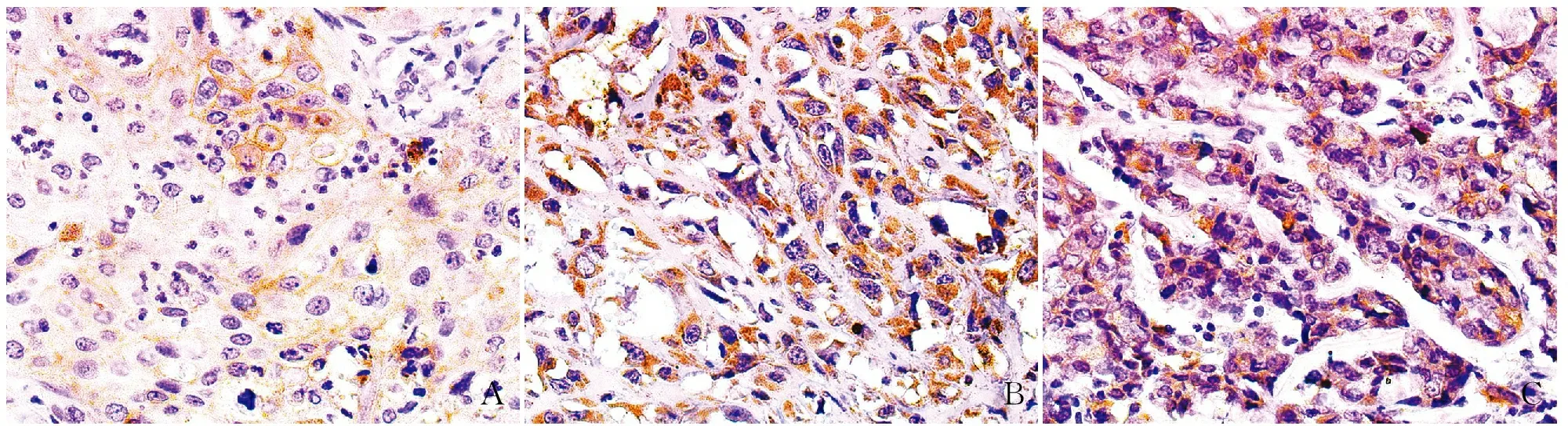
ABC
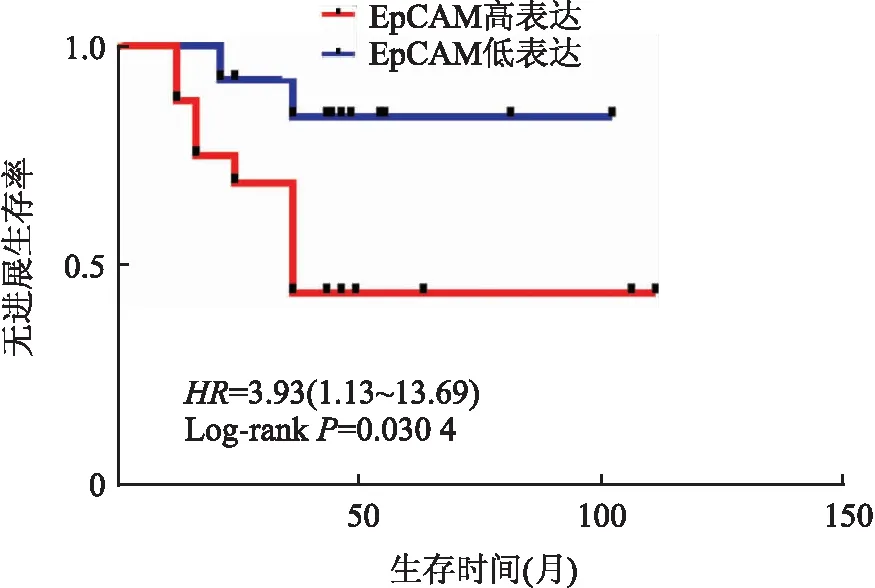
图7 EpCAM表达与MBC患者PFS的关系
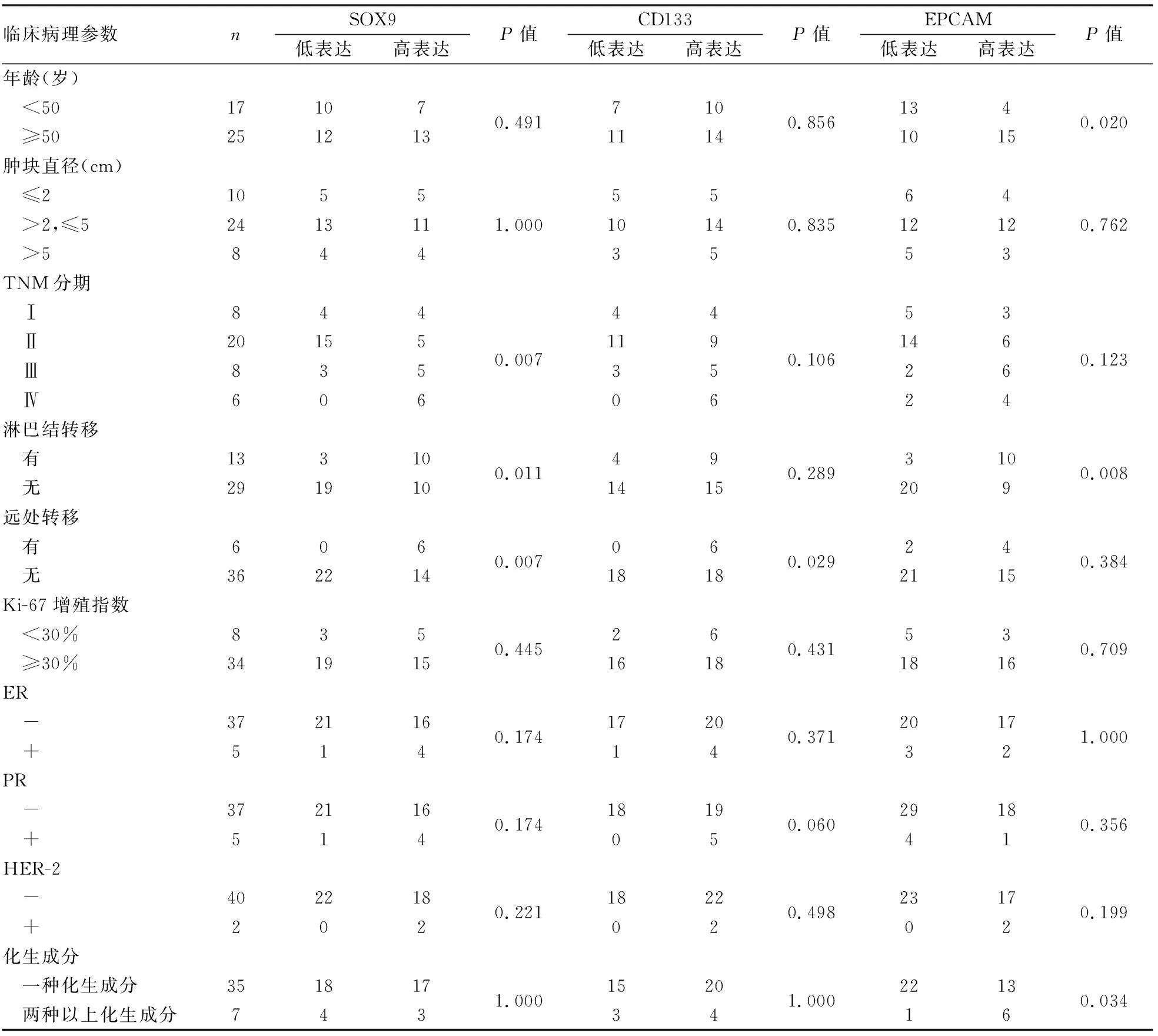
表1 MBC中SOX9、CD133及EPCAM的表达与临床病理特征的相关性
2.5 MBC中SOX9、CD133和EPCAM表达的相关性免疫组化结果显示,SOX9表达与CD133表达呈正相关(rs=0.502,P<0.01,图8),与EPCAM表达呈正相关(rs=0.529,P<0.01,图8)。
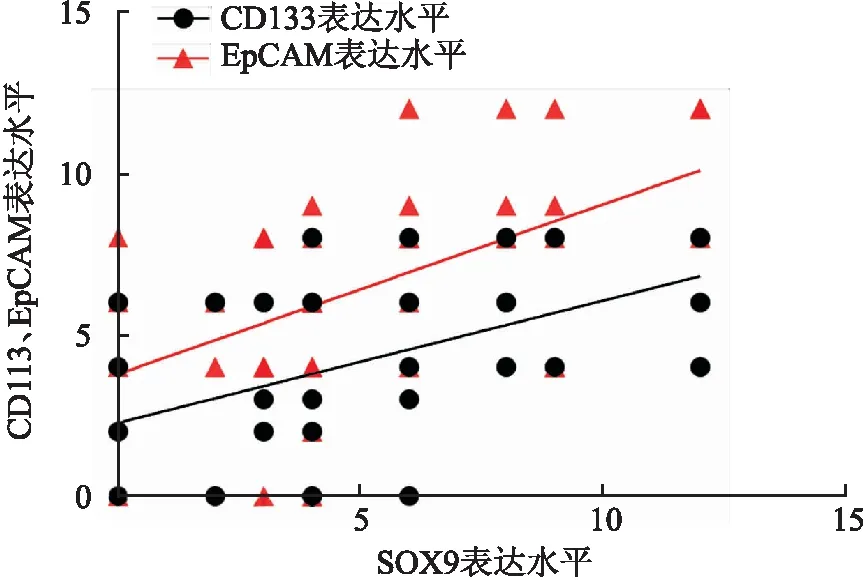
图8 MBC中SOX9与CD133、EpCAM表达的相关性
2.6 MBC与IBC-NST中SOX9、CD133和EpCAM表达的对比分析本实验对MBC化生成分和IBC-NST成分中SOX9、CD133和EpCAM表达进行对比分析,38例同时具有化生成分和IBC-NST成分的病例中,SOX9、CD133和EpCAM在化生成分中的表达评分均高于IBC-NST成分(P<0.05,图9)。
2.7 生存分析Cox单因素生存分析发现,SOX9高表达、CD133高表达与MBC患者的3年PFS相关(P<0.05,表2),选取P<0.12的因素进行Cox多因素分析,结果显示SOX9是影响患者3年PFS的独立危险因素(P<0.05,表2)。
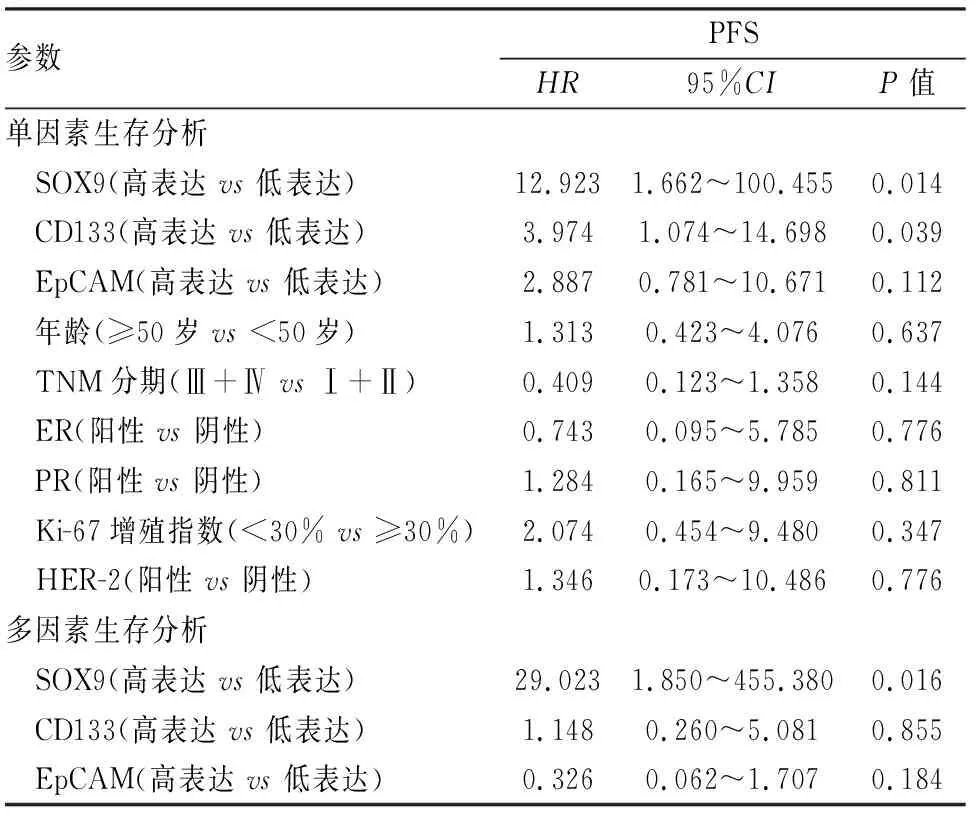
表2 MBC患者PFS的Cox多因素和多因素分析
3 讨论
CSC是肿瘤细胞中的一种亚群,其具有高度的自我更新能力和启动肿瘤发生的能力,对肿瘤的耐药、复发和转移起关键作用[11]。在乳腺癌中,转移是受多种信号通路严格调控的一种过程,大多数细胞具有脱离原本基质便凋亡的特征,但CSC可以存活并在远处建立转移性病变,因此CSC促进了乳腺癌的转移[12];同时,研究表明CSC在乳腺癌中促进了肿瘤血管生成拟态的形成,并可分化为血管内皮细胞,在肿瘤血管的生成中发挥重要作用[13],并且CSC有着抗凋亡分子的高表达以及高效的DNA修复机制,使得其对放疗及化疗表现出高度的抵抗力,这是肿瘤复发的重要因素[14]。普遍认为,MBC富含CSC的特点使其伴随较差的预后[4],因此MBC中CSC调控网络的研究对于预测MBC的预后和防止复发至关重要。
SOX9是SOX转录因子家族成员,在胚胎发育和干细胞维持中起关键作用[5]。越来越多的证据表明,SOX9可以调节CSC,促进癌症的进展。Domenici等[15]发现在IBC-NST中,SOX2-SOX9信号轴控制BCSC的含量,并且是表达BCSC标志物ALDH1所必须的,是维持BCSC的关键调节剂。在三阴型乳腺癌中,Strekalova等[16]证明可以通过限制MAT2A-SOX9轴抑制BCSC群体,从而抑制癌症的进展,这些研究证实了SOX9在维持BCSC并以此促进乳腺癌进展中的重要作用。本实验中,SOX9的表达与MBC患者淋巴结转移、肿瘤远处转移呈正相关,表明SOX9在MBC的转移过程可能具有重要作用。除了促进转移,SOX9还与MBC患者PFS关系密切相关,本组病例显示,SOX9高表达与高TNM分期呈正相关,与患者3年PFS呈负相关。这些与既往SOX9在乳腺癌中表达的研究一致[17]。同时Cox多因素分析显示,SOX9的表达与患者3年PFS密切相关[P<0.05,HR=29.023(1.850~455.380),置信区间较大或与样本量较少有关],是影响患者预后的独立危险因素,这些结果表明SOX9与MBC的进展密切相关。
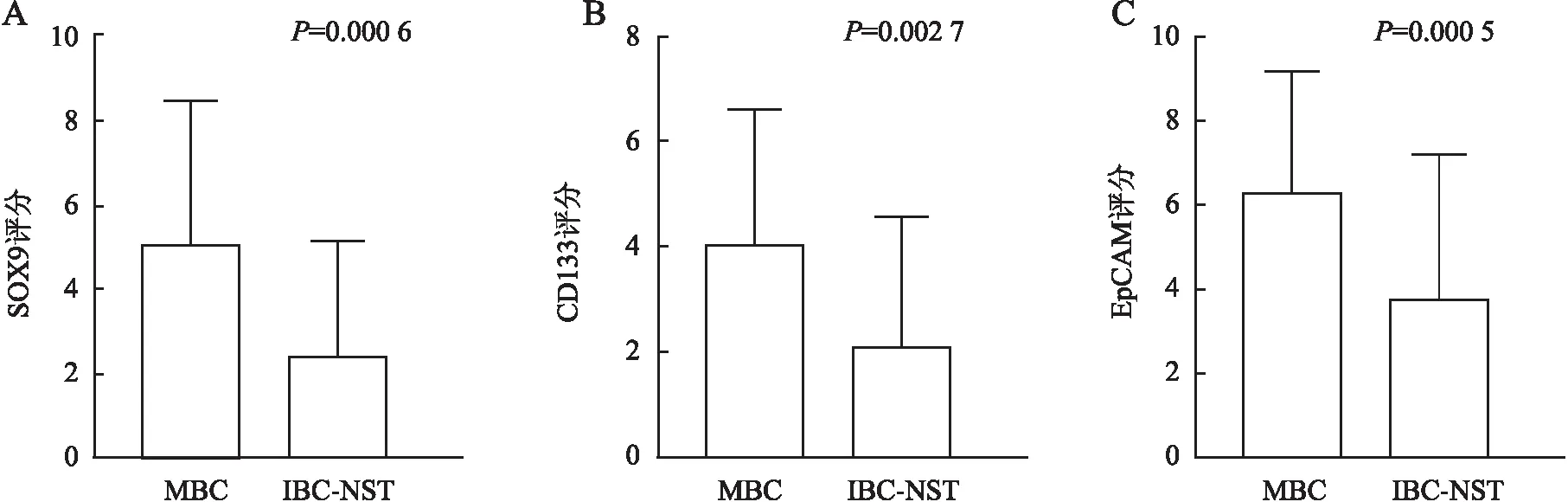
图9 A.SOX9在MBC化生性成分和IBC-NST成分中的表达;B.CD133在MBC化生性成分和IBC-NST成分中的表达;C.EpCAM在MBC化生性成分和IBC-NST成分中的表达
CD133和EpCAM常作为BCSC标志物,Wright等[18]在免疫缺陷小鼠的乳腺癌细胞中分离出的CD133+细胞具有更高的集落形成效率、增殖率和更强的成瘤能力。Hiraga等[19]从乳腺癌细胞系中筛选出的EpCAM+细胞具有自我更新和分化的潜力,给小鼠心内注射EpCAM+乳腺癌细胞,小鼠发生骨转移的概率明显增加,提示乳腺癌CD133+和EpCAM+细胞具有BCSC的特征。乳腺癌中EpCAM与CD133的表达通常与不良预后有关,Brugnoli等[20]研究结果显示,在三阴型乳腺癌中CD133+和EpCAM+细胞具有高增殖率和高侵袭力,并且与三阴型乳腺癌的恶性程度直接相关。本实验中,CD133和EpCAM的表达与患者3年PFS呈负相关;CD133表达与远处转移呈正相关,EpCAM表达与淋巴结转移呈正相关;EpCAM在两种以上化生成分的MBC中表达高于单一化生成分,存在两种以上化生成分是导致MBC复发和生存率降低的不良因素[21],这些结果提示CD133和EpCAM与MBC患者的肿瘤进展相关。
本组生物信息学分析和免疫组化结果均显示SOX9表达与CD133和EpCAM表达呈正相关,这与文献中报道的提示SOX9在癌症中通过调控BCSC并加速肿瘤的恶性进展结果一致[22]。同时,MBC是富含BCSC的肿瘤[4],本实验结果显示,EpCAM和CD133在MBC化生成分中的表达高于非特殊型成分,证明了MBC比IBC-NST富含干性特征,并因此具有更差的预后。这些结果表明,在MBC中SOX9表达与BCSC标志物关系密切,可能作为MBC中的BCSC调控因子,并以此促进MBC的进展。
