伴有极向反转的乳头状肾肿瘤5例临床病理分析
2022-09-28焦万举翁密霞罗丹菊
杨 明,陈 烁,雷 萍,焦万举,郑 琴,王 娜,翁密霞,罗丹菊,聂 秀,黄 博
乳头状肾细胞癌的发病率位居肾脏恶性肿瘤的第2位,占肾细胞癌的10%~15%。WHO(2016)泌尿及男性生殖系统肿瘤分类及诊断标准将乳头状肾细胞癌分为Ⅰ型和Ⅱ型,同时描述了嗜酸性乳头状肾细胞癌的形态学特点[1]。2019年,由Al-Obaidy等[2]报道了一组嗜酸性乳头状肾细胞癌病例,综合其形态学特点,将其命名为伴有极向反转的乳头状肾肿瘤(papillary renal neoplasm with reverse polarity, PRNRP)。同时,研究发现PRNRP具有高频率KRAS基因突变,且预后良好,其组织形态学、免疫表型、分子特征及预后均有别于Ⅰ型/Ⅱ型乳头状肾细胞癌。目前国内相关文献报道较少。本文现报道5例PRNRP,回顾性分析其临床病理学特征,旨在提高临床和病理医师对该肿瘤的组织形态学、免疫表型及分子特征的认识,因其预后良好,应明确诊断,避免误诊。
1 材料与方法
1.1 临床资料收集2018~2021年华中科技大学同济医学院附属协和医院诊治的5例PRNRP。标本均经两位经验丰富的病理医师独立阅片复诊。复习并记录其临床病理学特征及随访资料。同时随机选取6例乳头状肾细胞癌(Ⅰ型3例,Ⅱ型3例)作为对照组。
1.2 方法
1.2.1HE及免疫组化 标本均经10%中性福尔马林固定,常规脱水制片,HE染色,镜下观察。免疫组化染色采用EnVision两步法,所用抗体包括L1CAM(UJ127.11,稀释比1 ∶100),购自英国Abcam公司;GATA3(EP368,稀释比1 ∶200)、CK7(OV-TL 12/30,稀释比1 ∶100)、MUC1(MRQ-17,即用型)、vimentin(V9,稀释比1 ∶200),均购自国药基因公司;EMA(E29,即用型)、P504S(13H4,稀释比1 ∶4)、CD10(56C6,稀释比1 ∶6),均购自武汉珈源生物公司。CAIX(多克隆,即用型)购自福州迈新生物公司。
1.2.2实时荧光定量PCR 采用实时荧光定量PCR对实验组4例PRNRP行KRAS基因突变检测。KRAS基因突变检测试剂盒购自厦门艾德生物医药公司,检测KRAS(NM_004985.3)基因2、3、4号外显子12种突变位点。实验体系设置阴性对照及阳性对照。实验步骤严格按试剂盒说明书进行。
2 结果
2.1 临床特征5例PRNRP患者中男性2例,女性3例,男女比为2 ∶3;年龄54~67岁(平均60.4岁);4例为肾脏局部切除样本,1例为根治性肾切除样本;3例发生于右肾下极,2例发生于左肾下极;4例均为体检发现,1例为腹膜后去分化脂肪肉瘤行肾脏根治性切除发现;5例均合并有肾囊肿。CT示实质期图像均为强化结节影(图1),强化程度低于肾实质,有别于透明细胞性肾细胞癌。所有病例病理T分期均为pT1a期(美国癌症联合委员会AJCC pTNM分期)。术后随访时间2~24个月,4例均未发现肿瘤复发及转移,1例因腹膜后去分化脂肪肉瘤死亡。
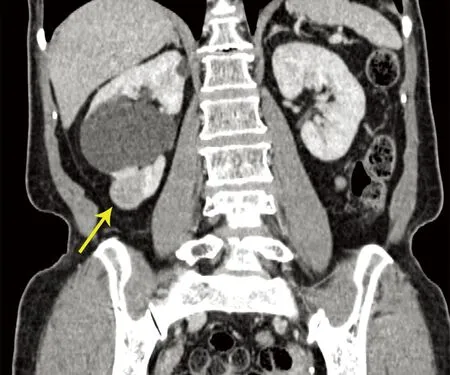
图1 CT示右肾下极见一直径约2.2 cm的实质期强化结节影,强化程度低于肾实质(箭头)
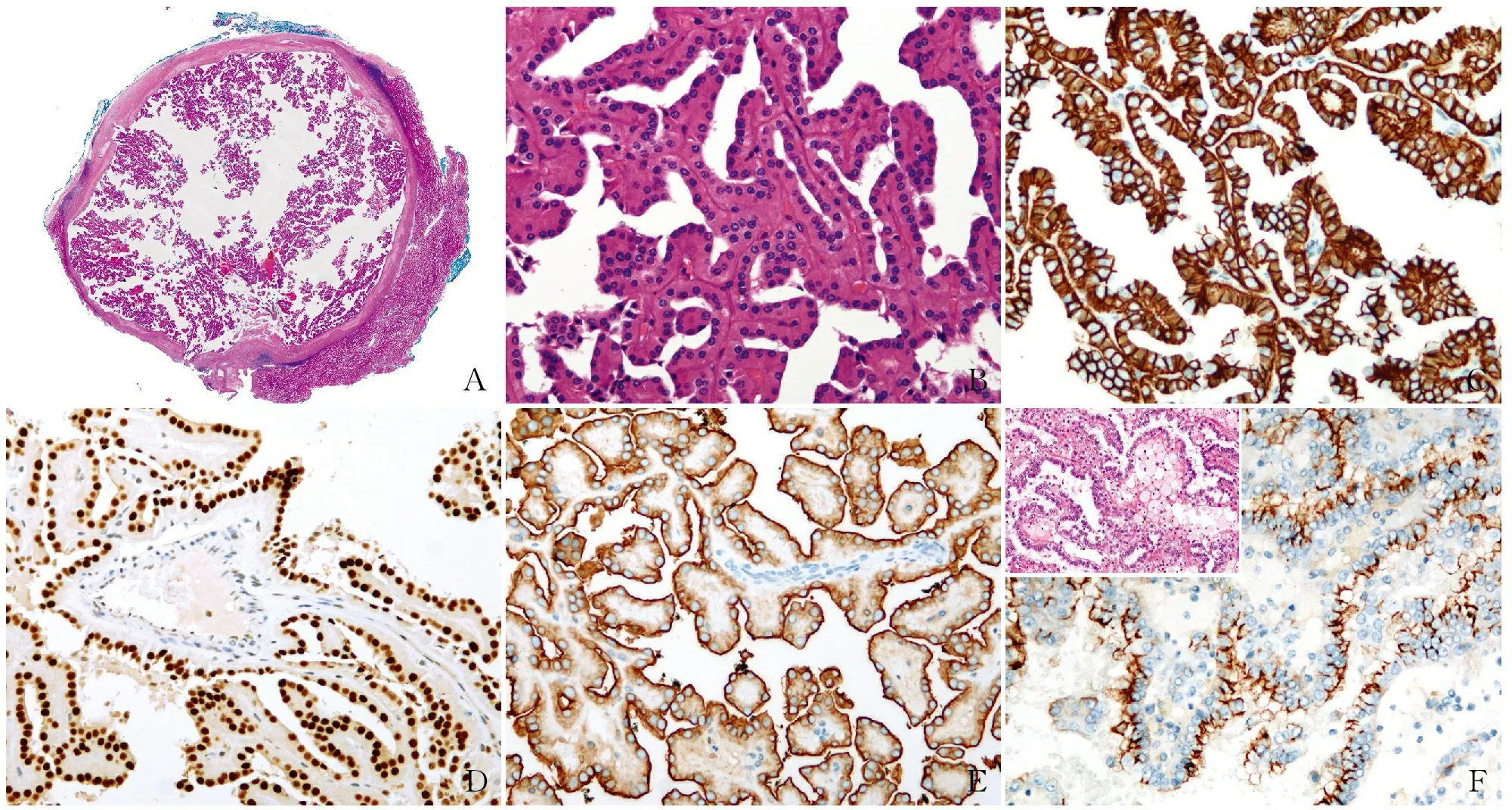
2.2 病理检查眼观:肿块切面呈囊性或包裹性,其内充满松散的灰黄色乳头状物(图2),肿瘤最大径0.1~2.5 cm(平均1.4 cm)。镜检:肿瘤界限清楚,形成包裹性或囊性改变,其内可见伴有血管轴心的分支状乳头结构或管状乳头状结构(图3A)。乳头表面被覆立方状或柱状肿瘤细胞,细胞均匀一致,胞质嗜酸性,形态温和,细胞核远离基膜出现于细胞质顶端(图3B),即出现特征性极向反转的形态学特点,局部乳头轴心出现水肿,可见少许炎性细胞浸润,局灶细胞胞质淡染。肿瘤细胞核级低,核仁不清晰(WHO/ISUP Ⅰ级)。5例PRNRP均未查见泡沫样组织细胞聚集、砂砾体及肿瘤性坏死。
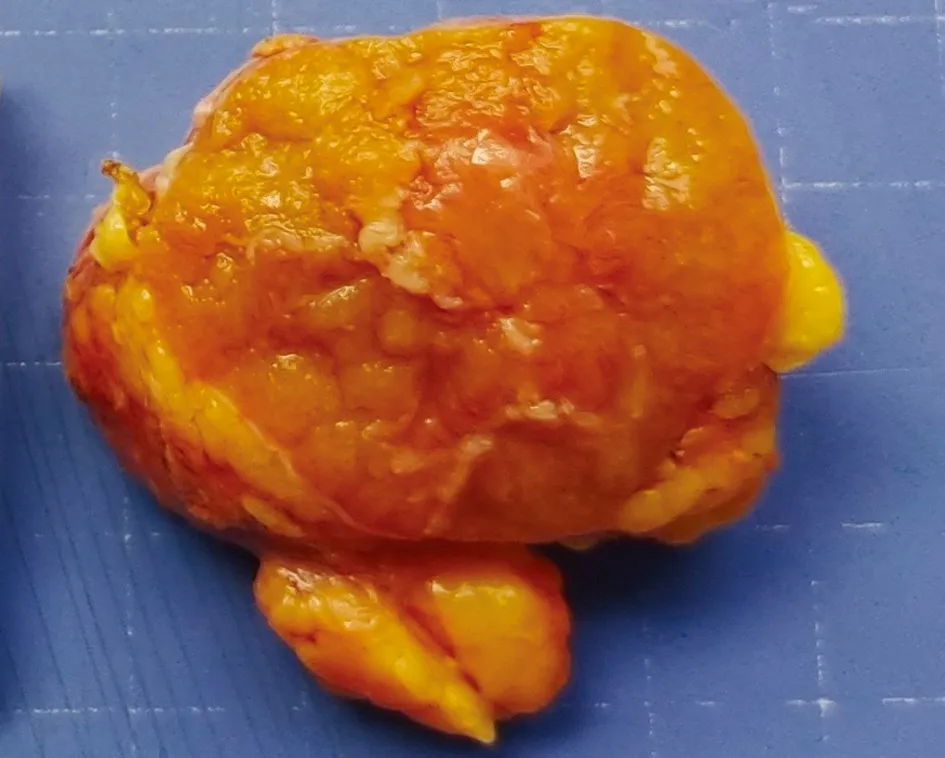
图2 PRNRP肉眼可见囊内充满灰黄色乳头样肿物
ABCDEF
2.3 免疫表型肿瘤细胞L1CAM、GATA3、CK7、MUC1及EMA弥漫阳性(图3C~E)。L1CAM与GATA3对PRNRP和乳头状肾细胞癌(Ⅰ/Ⅱ型)有鉴别诊断价值,对照组均未发现GATA3和L1CAM阳性。MUC1在PRNRP中出现典型极向反转的表达模式(图3E)。对照组MUC1亦显示极向反转的表达模式(图3F)。vimentin和P504S阴性或弱阳性,1例(1/4)CD10出现腔缘阳性,CAIX阴性。
2.4 KRAS基因测序结果4例PRNRP中,3例出现KRAS基因错义突变,突变位点集中于2号外显子。其中1例为G12D(图4A),2例为G12V(图4B)。另外1例样本因肿瘤细胞剩余较少(直径0.1 cm),且核酸提取未达到质控标准而未进行KRAS基因突变检测。
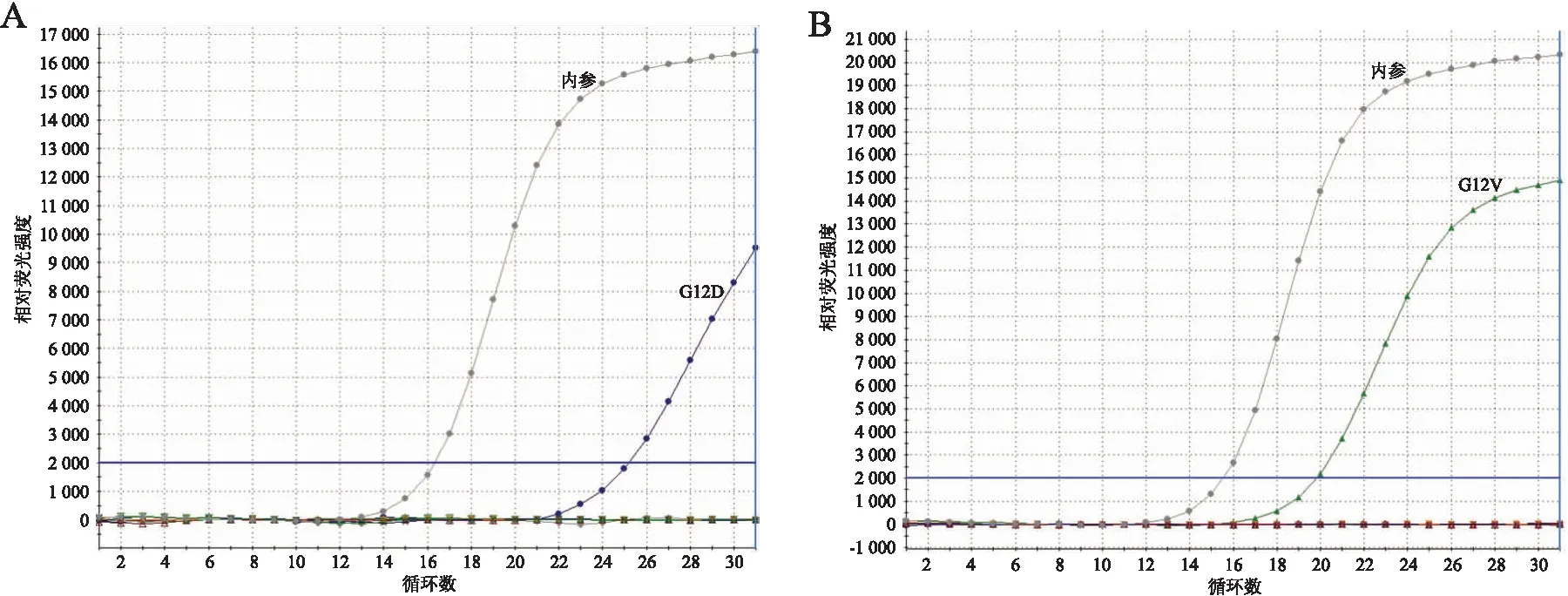
图4 实时荧光定量PCR检测结果:A.例1为KRAS G12D错义突变;B.例4及例5为KRAS G12V错义突变
3 讨论
PRNRP是一组罕见的来源于肾小管上皮的肿瘤,其生物学行为倾向良性或惰性。国外文献报道约100例[3],国内吉荣浩等[4]报道了9例,系国内病例数最多的报道。目前研究提示PRNRP不同于Ⅰ型/Ⅱ型乳头状肾细胞癌,建议作为独立的组织学亚型进行分类。
文献报道,PRNRP男性略多于女性,发病年龄36~82岁,肿瘤直径0.8~8.5 cm。本组肿瘤最小直径为0.1 cm,进一步扩大了肿瘤直径范围。在随访资料中,均未发现肿瘤复发、转移及肿瘤相关性死亡的报道[5]。PRNRP具有典型的形态学改变,如出现以下形态学,提示PRNRP的诊断:(1)肿瘤主要呈乳头状或管状乳头状排列;(2)被覆单层排列的立方状或柱状嗜酸性细胞,细胞形态温和、一致;(3)细胞核远离基膜位于细胞质顶端,即出现极向反转;(4)核仁不清晰,核级为低级别,即WHO/ISUP Ⅰ~Ⅱ级。本组5例均含有上述形态学改变,同时具有包裹性或囊性特征,与文献报道相吻合。本组5例PRNRP均合并有肾囊肿,该特点在已往的文献报道中未着重提出。5例PRNRP均未发现泡沫样组织细胞聚集、砂砾体及肿瘤性坏死,这与Ⅰ型乳头状肾细胞癌有所不同。细胞核极向反转这一形态学改变也出现于其他肿瘤中,如乳腺伴有极向反转的高细胞癌[6]及透明细胞性乳头状肾细胞癌等。正常细胞核一般是不对称分布于细胞内,研究表明,细胞核位置是与其细胞类型、功能状态、胞质含量、细胞周期阶段、迁移及分化状态有关[7]。在细胞周期中,当细胞从DNA合成期(S期)进入DNA合成后期(G2期)时,细胞核上移,为分裂期(M期)做准备[8]。在亚细胞水平,细胞内不均衡的平衡力导致细胞核位置发生差异[9],这种平衡力与细胞骨架及核骨架蛋白有关。目前,对于PRNRP细胞核极向反转的机制尚不清楚,可能因细胞周期刚好停留在M期之前,或是因细胞骨架与细胞核骨架蛋白导致细胞内平衡力不均衡,而出现了特定的分布状态。
免疫组化染色结果示肿瘤细胞L1CAM、GATA3、CK7、MUC1及EMA弥漫阳性。L1CAM与GATA3对PRNRP与乳头状肾细胞癌(Ⅰ/Ⅱ型)的鉴别诊断具有重要意义,对照组均未发现L1CAM与GATA3阳性。L1CAM是神经系统发育中具有重要作用的神经黏附分子。文献报道,L1CAM表达于多种肿瘤细胞,与肿瘤浸润及侵袭有关,提示预后不良[10]。本实验结果显示L1CAM在PRNRP中弥漫阳性,PRNRP预后良好,与L1CAM提示不良预后矛盾。镜下观察发现L1CAM表达于远端小管,而文献[11]报道的PRNRP来源于肾脏远端小管,提示L1CAM与GATA3类似,可能仅仅是PRNRP组织来源的指标,与其预后无关。MUC1在PRNRP中出现典型极向反转的表达模式。MUC1在对照组中也出现灶状阳性,且出现极向反转的染色模式。EMA与CK7在对照组中均弥漫阳性。所以CK7、MUC1与EMA对PRNRP与乳头状肾细胞癌(Ⅰ/Ⅱ型)无鉴别意义。
目前文献报道PRNRP具有高频率KRAS基因突变[12]。吉荣浩等[4]报道了9例中8例出现KRAS基因突变,其突变位点集中于2号外显子。本组4例中3例出现KRAS基因2号外显子突变,与文献报道相吻合。目前研究结果提示KRAS突变是PRNRP的驱动基因突变,且PRNRP不存在染色体的7、17号三倍体,说明PRNRP具有高度一致性的遗传学改变,且与乳头状肾细胞癌不同,是有别于乳头状肾细胞癌的新组织学亚型[4,13]。
鉴别诊断:PRNRP具有特征性形态学改变及免疫表型特征,临床外检工作中诊断并不困难。主要与其形态相似的肾脏肿瘤鉴别:(1)Ⅰ型乳头状肾细胞癌,乳头状纤维血管轴心常出现泡沫样组织细胞聚集、砂砾体,肿瘤性坏死常见,胞质透明、淡染或嗜酸性;免疫组化不表达GATA3与L1CAM可与之鉴别。(2)Ⅱ型乳头状肾细胞癌:属高异质性肾细胞癌,高核级,形态多样,乳头状、管状、实性均可出现,同样免疫组化不表达GATA3及L1CAM可与之鉴别;(3)透明细胞性乳头状肾细胞癌:主呈管状乳头状结构,可出现细胞核上移,形似于早期分泌期形象之子宫内膜,胞质透明,免疫组化标记碳酸酐酶9(CA9)出现特征性“杯状”染色模式;(4)肾脏乳头状瘤,被认为是乳头状癌的前驱病变,肿瘤最大径≤1.5 cm,无包膜,由低核级、胞质透明或嗜碱性肿瘤细胞组成管状/乳头状结构,不出现极向反转的形态学改变,同样免疫组化不表达GATA3及L1CAM可与之鉴别;(5)嗜酸性腺瘤:肿瘤细胞常排列为岛状、管状、腺泡状及微囊状,常见中央瘢痕,免疫组化多不表达CK7可与之鉴别。
PRNRP是目前新报道的罕见肾脏肿瘤,曾命名为嗜酸细胞样乳头状肾细胞癌(oncocytoid-type papillary renal cell carcinoma)、嗜酸性乳头状肾细胞癌(oncocytic papillary renal cell carcinoma)或低级别嗜酸性乳头状肾细胞癌,4型(papillary renal cell carcinoma, type 4/oncocytic low grade),目前被认为是乳头状肾细胞癌的一个组织学亚型[14]。PRNRP的命名尚未统一。根据WHO(2016)泌尿与男性生殖系统肿瘤分类和诊断标准,将肿瘤最大径≤1.5 cm、低核级且无包膜的乳头状或管状乳头状结构的肾肿瘤命名为肾脏乳头状瘤,反之,则诊断为乳头状肾细胞癌。上述标准是否适用于PRNRP尚存争议。的确,在临床外检工作中,用肿瘤大小区分病变是良性肿瘤或是手术可治愈的早期肾细胞癌十分困难。有文献报道直径<3 cm的乳头状肾细胞癌的转移率<1%[15]。本组5例PRNRP中,4例尚未发现有肿瘤复发、转移及肿瘤相关性死亡,1例因去分化脂肪肉瘤而死亡,提示为良性或惰性生物学行为。目前定义为“癌”或是交界性肿瘤尚无定论,因此,建议采用“伴有极向反转的乳头状肾肿瘤”这一诊断名词,同时对肿瘤大小及核级别加以说明,并且备注目前文献报道预后良好,以上信息可供临床参考。但因肿瘤罕见,相对较小的样本量及较短的随访不能反映该肿瘤的真正远期生物学行为,因此有待积累更多病例进一步观察。
综上,本组5例PRNRP是一组具有独特临床病理学特征、免疫表型、分子改变的肾脏肿瘤,其预后良好。提示PRNRP有别于乳头状肾细胞癌(Ⅰ型/Ⅱ型),建议将其作为一种独立的组织学亚型进行分类。
