丹参酮II A对人宫颈癌Siha细胞增殖、代谢与凋亡的影响
2022-09-26刘霁萱李咏梅
刘霁萱,李咏梅
(北华大学基础医学院,吉林 吉林132013)
宫颈癌是全球女性发病和死亡的常见原因,仅在2020年就报告了604,000例新诊断病例和约342,000例死亡[1]。目前,许多用于癌症治疗的放疗方法和化学药物副作用较为严重,但随着人们对中草药了解的不断深入,发现中药的一些有效成分具有许多优点,如多环节、多靶点、多通道、毒性小等特点为抗癌药物的研发提供了新的思路与新靶点[2]。丹参在亚洲被用作传统中药已有数千年的历史。丹参酮IIA(TanIIA)作为其最丰富的有效成分之一,对于许多心血管、神经、呼吸、泌尿、消化和运动系统疾病发挥治疗作用,并且对抑制癌细胞增殖和转移,诱导细胞周期停滞和自噬,诱导肿瘤细胞凋亡等也有显著的作用[3]。以往有研究表明[4],丹参酮IIA可抑制含有HPV18阳性的宫颈癌细胞增殖,但对于HPV16阳性的宫颈癌细胞的抑制作用仍在探索阶段。本实验目的为探索不同浓度丹参酮II A作用于人宫颈鳞癌Siha细胞后对增殖、侵袭及代谢的影响及其可能的诱导机制。
1 材料与方法
1.1 细胞株和药物
人宫颈鳞状癌细胞Siha购于北纳创联生物科技公司。丹参酮ⅡA购自中国药品生物制品检定所,为化学标准品。
1.2 主要试剂
CCK-8试剂盒、二甲基亚砜(DMSO)、BCA蛋白浓度测定试剂盒、cDNA第一链合成试剂盒、DEPC水均购于上海碧云天有限公司;Transwell小室、Matrigel胶,美国Corning公司;Annexin V-FITC/PI凋亡试剂盒,美国BD生物公司;DMEM细胞培养液,Gibco公司;胎牛血清(FBS),GEMINI公司;葡糖糖测定试剂盒、乳酸测定试剂盒,南京建成生物工程研究所;兔抗人PKM2、STAT3、Cyclin D1、Bcl-xl、MMP-2、MMP-9和GAPDH单克隆抗体以及抗兔二抗均购自于ABclonal公司。
1.3 主要仪器设备
CO2培养箱(Form311),Thermo Fisher公司;酶标仪(Infinite M1000 Pro),TECAN公司;倒置显微镜(IX83),奥林巴斯公司;流式细胞仪(EXFLOW-206),达科为公司;凝胶成像仪(GelDoc EZ),PCR仪(T100TM),Bio-Rad公司。
1.4 方法
1.4.1细胞培养 人宫颈癌Siha细胞常规体外培养在含10%胎牛血清的DMEM高糖培养基中,放置于37℃、5%CO2饱和湿度培养箱中。每2天更换新鲜培养液,待细胞生长至密度80%-90%左右,进行传代或冻存。
1.4.2CCK-8法检测细胞增殖 取对数生长期Siha细胞,待细胞生长密度至80%-90%左右,0.25%胰酶消化细胞,进行细胞计数,按照1.0×105/ml浓度接种于96孔板中,每孔加入200 μl细胞混悬液,置于37℃、5%CO2饱和湿度培养箱中培养24 h。24 h后弃去培养液,设置对照组和不同浓度加药组,加药组分别加入含TanⅡA(0.5、1、2、4、8、16 mg/L)浓度的培养液100 μl,药物刺激24 h,对照组不做药物处理,只加入相同体积培养液,每组设置6个复孔,实验重复3次。24 h后显微镜观察细胞生长情况,每孔避光加入10 μl CCK-8溶液,放置于37℃,5%CO2饱和湿度培养箱培养1 h。1 h后,取出96孔板并使用酶标仪检测波长在450 nm处各孔的OD值。
1.4.3划痕实验法检测细胞迁移 取对数生长期的Siha细胞,待其长满培养皿80%-90%,0.25%胰酶消化,按照3×105个细胞每孔数量接种于6孔板中,每孔3 ml,置于37℃、5%CO2饱和湿度培养箱中培养24 h,用200 μl枪头对细胞进行划痕处理,用PBS洗涤细胞三次,将划下的贴壁细胞洗去,实验组每孔加入不同浓度TanⅡ A(1 、2、4 mg/L)与培养基混合液,对照组不做药物处理,只加入相同体积培养液,每孔3 ml,轻轻摇匀。每孔任意选择3个不同视野,做好标记,倒置显微镜下观察划痕情况并拍照(0 h),继续培养24 h后同一视野再次拍照。实验重复3次。
1.4.4Transwell小室实验检测细胞侵袭能力 稀释Martrigel胶(Martrigel胶∶无血清培养基=1∶8),将稀释好的基质胶覆盖在小室的上室,每孔100 μl,放置在细胞培养箱4小时,等待其凝固。取对数生长期的Siha细胞,按照每孔0.5×103个细胞,200 μl的体积接种于上层小室中,加入不同浓度的丹参酮II A(1、2、4 mg/L)进行药物刺激,对照组不做药物处理。下室加入500 μl含20%胎牛血清的培养基以诱导细胞侵袭,继续培养24 h。取出上室,用棉签擦拭小室中未侵袭的基质胶和细胞,弃下室培养液,使用4%多聚甲醛室温固定15 min,弃固定液。然后加入500 μl结晶紫染色液室温避光染色15 min,PBS洗涤细胞3次,洗除未与细胞结合的结晶紫。适当晾干后显微镜下拍照,使用Image J来统计细胞侵袭数量。
1.4.5流式细胞术检测细胞凋亡 收集90%满的对数生长期Siha细胞,细胞计数,调整细胞浓度3×105个/孔,均匀接种于6孔板中,放置培养箱中培养24 h后弃去培养液,加入不同浓度的丹参酮II A(1、2、4 mg/L)与培养基混合液进行药物刺激,每孔3 ml,对照组不做药物处理,加入相同体积培养液。计算时间,24 h后收集细胞,用无EDTA胰酶消化细胞后,加入15 ml离心管内,1 000 rpm,离心5 min,弃上清,PBS清洗两次,加入PBS重悬细胞,再次离心,1 000 rpm,离心5 min,弃上清,用高压后的去离子水将10×Binding Buffer稀释成1×Binding Buffer,加入400 μl重悬细胞,然后加入5 μl Annexin Ⅴ-FITC混匀后,避光,室温孵育15 min,加入10 μl PI,冰上避光孵育5 min,上机检测,调电压,采集细胞凋亡图谱。
1.4.6Western blot检测 不同浓度TanⅡA处理细胞24 h后,离心收集细胞,加入预先配置好的RIPA裂解液(RIPA∶PMSF=100∶1),冰上裂解30 min,4℃下12 000 rpm,离心12 min,收集上清,提取细胞蛋白。BCA法测定蛋白浓度,根据目的蛋白的分子量大小选择12%的分离胶和5%的浓缩胶进行配制,上样,SDS-PAGE电泳,80V电泳30 min,待Marker跑至分离胶,调整为120V继续电泳,观察条带达到凝胶1/3-2/3处时可停止电泳。湿转法至聚偏二氟乙烯膜(PVDF),260 mA,约1.5-2 h,将膜放入封闭液TBST(含5%BSA)中,室温摇床封闭1-2 h。加入稀释一抗(PKM2、STAT3、Bcl-xl、MMP-2均为1∶1000),置于摇床4℃过夜。1×TBST洗涤3次,每次5-10 min。加入HPR标记的二抗,室温孵育2 h,孵育结束后再次进行洗膜,5-10 min,共洗涤3次。ECL显影,扫描记录。以GAPDH表达量为对照观察结果。
1.4.7葡萄糖摄取量及乳酸含量测定 取对数生长期Siha细胞,细胞计数,调整细胞浓度1×105个/ml进行铺板,放入37℃,5%CO2培养箱培养。24 h后按照不同浓度(0、1、2、4 mg/L)分组加入药物同时设置无细胞组以检测单纯培养基数值,放入37℃,5%CO2培养箱24 h后收集细胞,1 000 rpm,离心10 min,取上清,按照葡萄糖检测试剂盒以及乳酸检测试剂盒进行测定,乳酸含量测定同时将空白管、标准管、测定管的测量值分别设置为A、B、C。实验重复3次,按照以下公式计算。
葡萄糖含量(mmol/L)=(△A测定-△A空白)/(△A标准-△A空白)×标准品浓度(mmol/L)×样品稀释倍数。
每组葡萄糖消耗值(mmol/L)=单纯培养基所测数值-各实验组培养基所测数值。
乳酸含量(mmol/L)=(C值-B值)/(A值-C值)×标准品浓度×样本测试前稀释倍数。
1.4.8数据统计分析 采用GraphPad Prism 9软件对所得数据进行统计学分析和数据整合,组间差异用单因素One-Way ANOVA分析,数据均以均数±标准差表示,以P<0.05为差异有统计学意义。
2 结果
2.1 CCK-8法检测丹参酮Ⅱ A对Siha细胞增殖的影响
CCK-8结果可见,丹参酮II A作用于Siha细胞24 h后,Siha细胞的增殖抑制率随丹参酮II A浓度的增加而逐渐升高,与未加药组比较,差异显著,见表1。
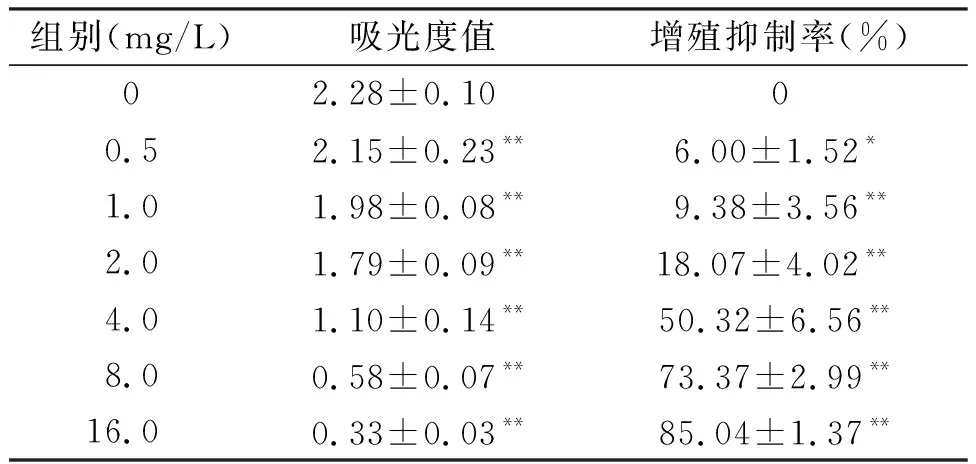
表1 不同浓度丹参酮ⅡA对Siha细胞增殖的影响
2.2 划痕实验检测丹参酮Ⅱ A对Siha细胞迁移的影响
细胞划痕实验结果显示,未加药组向划痕中央移动速度较快,而相较于1、2 、4 mg/L丹参酮ⅡA药物刺激24小时后,随着药物浓度的升高,细胞愈合速度减慢,细胞迁移能力下降。见图1。
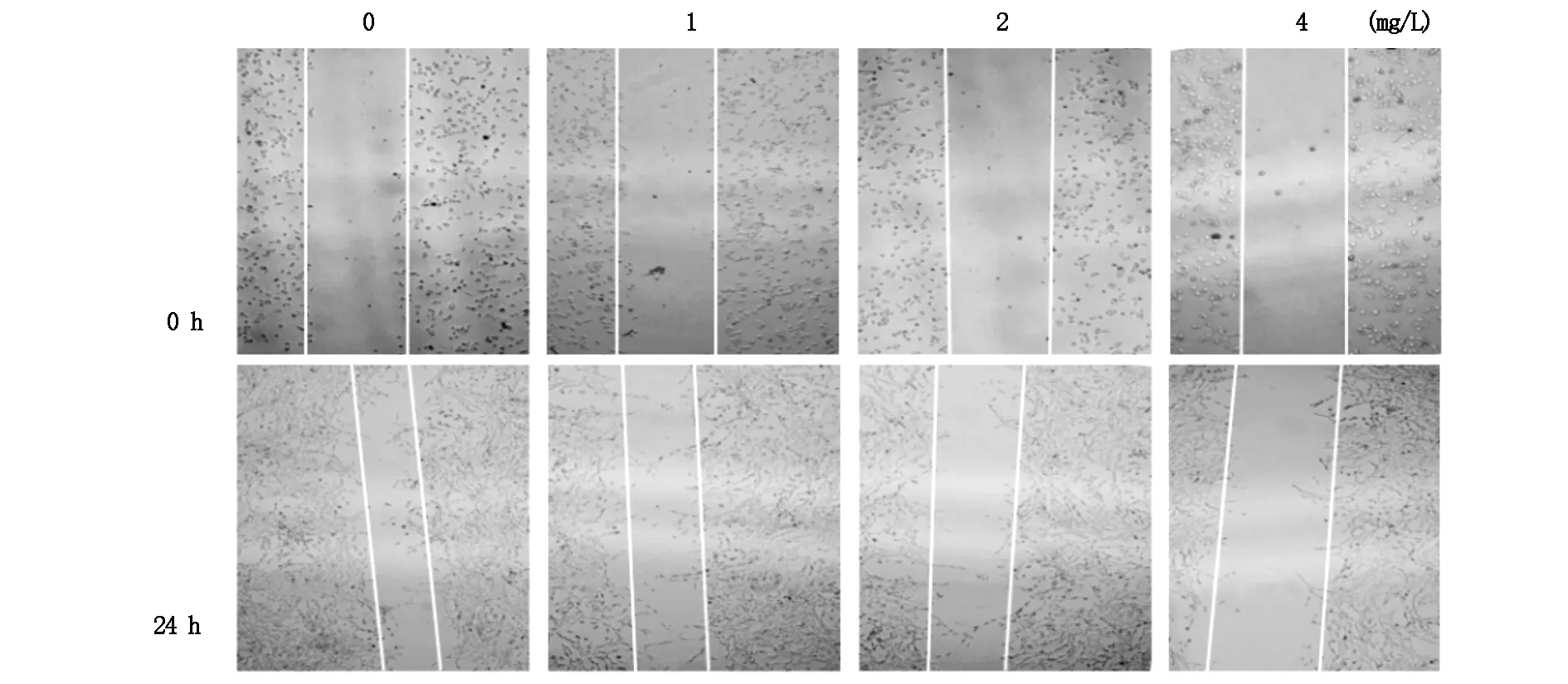
图1 不同浓度丹参酮ⅡA对宫颈癌Siha细胞迁移的影响
2.3 Transwell小室实验检测丹参酮Ⅱ A对Siha细胞侵袭能力的影响
Transwell小室实验结果显示,TanⅡA作用于Siha细胞24 h后,与对照组相比,1、2、4 mg/L浓度组的Siha细胞侵袭能力逐渐减弱,能够穿过人工基底膜的Siha细胞数量逐渐减少,差异具有统计学意义(P<0.01)。见图2、表2。

图2 不同浓度丹参酮Ⅱ A对宫颈癌Siha细胞侵袭能力的影响

表2 各组细胞侵袭数量比较
2.4 Annexin-V/PI双染法检测丹参酮Ⅱ A作用于Siha细胞凋亡的情况
结果表明,与对照组相比,TanⅡA作用后明显引起细胞凋亡,细胞凋亡率上升显著,差异具有统计学意义(P<0.01)。见表3。

表3 不同浓度丹参酮ⅡA对Siha细胞凋亡的影响
2.5 Tan ⅡA不同浓度对Siha细胞内PKM2、STAT3、Bcl-xl、MMP-2蛋白表达的影响
与对照组相比,经不同浓度加药组作用于Siha细胞24 h后PKM2、STAT3、蛋白的表达水平明显上调,Bcl-xl、MMP-2蛋白的表达水平显著下调,并且随着药物浓度的升高,蛋白表达逐渐下降,呈剂量依赖性。如图3。

图3 各组Siha细胞内PKM2、STAT3、bcl-xl、MMP-2蛋白表达比较
2.6 丹参酮Ⅱ A作用于Siha细胞后对葡萄糖摄取量的影响
不同浓度丹参酮ⅡA作用于Siha细胞24 h后进行葡萄糖含量检测,结果显示,与对照组相比,随着TanⅡA剂量增加,葡萄糖摄取量减少,差异具有统计学意义(P<0.01)。见表4。

表4 不同浓度丹参酮ⅡA对Siha细胞葡萄糖摄取量的影响
2.7 检测丹参酮Ⅱ A作用于Siha细胞后对乳酸生成含量的影响
检测结果表明,丹参酮Ⅱ A对Siha细胞的抑制作用随剂量增大乳酸生成含量逐渐减少,与对照组相比,差异有统计学意义(P<0.01),见表5。

表5 不同浓度丹参酮ⅡA对Siha细胞乳酸生成含量的影响
3 讨论
宫颈癌是全球女性中最普遍的癌症之一,在全世界范围内受到广泛重视,目前的治疗策略主要包括外科手术、放疗和化疗,然而肿瘤细胞逐渐对各种化疗药物产生耐药,并且伴随一些副作用和毒性,使肿瘤患者生活质量大幅降低,因此仍需要寻找新的防治策略和方法来减轻患者痛苦、降低宫颈癌患者死亡率。本研究针对宫颈鳞癌Siha细胞,探讨TanⅡ A对其增殖、代谢及凋亡有关的分子机制。
本实验通过CCK-8、划痕实验、Transwell小室实验以及流式细胞术检测结果显示,丹参酮Ⅱ A对于宫颈癌Siha细胞的增殖、迁移及侵袭有一定的抑制作用,并且可以诱导Siha细胞凋亡。
正常细胞只有在缺氧的情况下进行糖酵解,而肿瘤细胞即使在不缺氧的情况下也优先进行糖酵解,消耗更多的葡萄糖和产生更多的乳酸。本实验研究结果提示,TanⅡ A作用后,Siha细胞葡萄糖摄取量与乳酸生成含量减少,这提示了TanⅡ A对其糖酵解产生影响。
报道显示,2008年Lewis C.Cantley[5]通过移植瘤实验发现PKM2具有促进肿瘤生长的优势。在 2013年,Matthew Vander Heiden团队[6]的研究采用了敲除PKM基因中PKM2特有的第十个外显子的策略,发现PKM2的缺失反而会加速肿瘤的生长。2018年Nobuhiro Tanuma团队[7]构建了新的基因敲除小鼠模型,分别以和内源PKM表达接近的水平在小鼠中只表达PKM1或者PKM2亚型。结果显示,在致癌剂或癌基因诱导等多种肿瘤模型中,PKM1都促进了肿瘤的生长,而PKM2则抑制肿瘤生长。研究发现[8],丙酮酸激酶M2激活剂促进四聚体形成并抑制肿瘤发生,PKM2与含磷酸酪氨酸的蛋白质相互作用,抑制酶活性并增加糖酵解代谢物的可用性以促进细胞增殖,这表明高丙酮酸激酶活性可能抑制肿瘤生长。PKM2的小分子激活剂可能通过干扰合成代谢来抑制肿瘤细胞增殖。本实验结果显示,Tan ⅡA作用于宫颈癌Siha细胞后,PKM2与信号转导因子STAT3的蛋白表达增加,提示了Tan ⅡA 对PKM2有促表达作用,若按照Nobuhiro Tanuma[7]团队推测,PKM2可抑制肿瘤生长,并且PKM2的小分子激活剂可能通过干扰合成代谢来抑制肿瘤细胞增殖。那么Tan ⅡA发挥抗肿瘤作用的机制可能是其作为小分子药物对PKM2有激活作用,从而干扰了合成代谢,抑制了宫颈癌Siha细胞的增殖。
另外,有文献报道,抗凋亡蛋白Bcl-xl的过度表达可抑制细胞凋亡,从而使细胞增殖数量和凋亡数量不平衡,即使细胞增殖能力没有改变,但由于凋亡细胞数量的减少,也会导致细胞数量相对增多[9]。基质金属蛋白酶(MMPs)活性的诱导有助于细胞间连接的解体和ECM的降解,从而克服细胞运动的物理限制,参与肿瘤侵袭,因而是抗肿瘤药物的靶标[10]。本研究结果表明,Tan ⅡA作用于Siha细胞后,Bcl-xl和MMP-2的蛋白表达量呈下降趋势,表明TanⅡA抑制Siha细胞的迁移、侵袭能力,诱导细胞凋亡可能与抑制MMP-2和Bcl-xl蛋白表达有关。
综上,丹参酮ⅡA能够对宫颈鳞癌Siha细胞的增殖、迁移和侵袭能力发挥抑制作用,并且诱导Siha细胞凋亡。推测发挥作用的机制可能是丹参酮ⅡA作为小分子药物激活了PKM2的活性,通过影响肿瘤细胞糖酵解干扰了合成代谢,影响其下游信号转导因子STAT3和抗凋亡蛋白Bcl-xl从而发挥抗肿瘤作用,并且通过下调基质金属蛋白酶MMP-2的表达抑制Siha细胞的迁移和侵袭能力。但是,丹参酮ⅡA是如何激活了PKM2,还对糖酵解过程中合成代谢的哪些关键步骤发挥作用,以及其发挥作用的通路和上游分子仍有待深入研究和探讨。
