多指标优选丹参提取工艺研究
2022-03-19闪媛媛张继斌孙代华陈志元
闪媛媛,王 玉,徐 浪,张继斌,孙代华,陈志元
(劲牌持正堂药业有限公司 中药保健食品质量与安全湖北省重点实验室,湖北 黄石 435100)
0 引言
丹参为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎,始载于《神农本草经》,被列为上品,具有活血络祛瘀、通经止痛、凉血消痈、清心除烦等功效,是常用的中药组方药材[1]。2020 年版《中华人民共和国药典》 (一部) 要求以丹酚酸B 和丹参酮类包括丹参酮ⅡA、丹参酮Ⅰ和隐丹参酮作为质量控制指标,说明丹酚酸B 和丹参酮类在丹参的药效中发挥重要作用[2]。现代药理学研究表明丹参在治疗心血管疾病、肝硬化、溃疡、新生儿缺氧性脑病等方面具有显著疗效[3-4]。丹酚酸B 是丹参酚酸类化合物中含量较高的代表性成分,对心脑血管疾病和肝脏疾病等具有较好的临床效用[5-8]。丹参酮类主要包括隐丹参酮、丹参酮ⅡA、丹参酮Ⅰ,其中隐丹参酮是主要的抗癌活性成分,丹参酮ⅡA 具有明显的抗炎、抗氧化、抗肿瘤活性,丹参酮Ⅰ是丹参抑菌有效成分之一,且可以治疗痤疮和心绞痛,具有改善肺部炎症、保护神经等作用[9-13]。韩丽等人[14]使用动态减压法提取丹参中丹酚酸B。高扬等人[15]以热回流法提取丹参中的丹酚酸B 和丹参酮ⅡA 的。然而,关于丹酚酸B 和隐丹参酮、丹参酮ⅡA、丹参酮Ⅰ等3 种丹参酮类同时提取的文献报道较少。试验以丹酚酸B 和丹参酮类(隐丹参酮、丹参酮ⅡA、丹参酮Ⅰ三者之和) 提取率为指标,通过单因素试验和正交试验确定最佳的提取工艺,以期为丹参药材的充分利用提供参考。
1 材料与方法
1.1 材料和试剂
丹参,临沂九州天润中药饮片产业有限公司提供;丹酚酸B 对照品、丹参酮IIA 对照品,中国食品药品检定研究院提供;乙腈、磷酸等试剂为色谱纯、甲醇、乙醇等试剂均为分析纯、纯净水(公司生产);95%食用酒精。
1.2 仪器
6890 型气相色谱仪,安捷伦科技公司产品;AB135-S 型电子天平,梅特勒- 托利多公司产品;FA2004 型电子天平,上海精密科学仪器有限公司产品;SK8200LHC 型超声提取器,上海科导超声仪器有限公司产品;HH-4 型数显恒温水浴锅,常州国华电器有限公司产品。
1.3 丹酚酸B 含量的检测
1.3.1 供试品溶液制备
精密量取丹参提取液样品1 mL 至10 mL 容量瓶中,加50%乙醇稀释并定容,0.22 μm 有机相针式过滤器过滤,取续滤液作为供试品溶液备用。
1.3.2 对照品溶液制备
精密称取丹酚酸B 标准品适量至25 mL 容量瓶中,80%甲醇超声溶解并定容,混匀,配制成丹酚酸B 含量300 mg/L 左右的标准品溶液。
1.3.3 色谱条件
色谱柱:Waters T3 型色谱柱,流动相为乙腈∶0.1%磷酸= 25∶75,流速为1.2 mL/min,检测波长为286 nm,柱温为20 ℃。
1.3.4 丹酚酸B 含量测定
对照品溶液与供试品溶液进样体积均为10 μL,注入液相色谱仪测定。以丹酚酸B 对照品保留时间定性,以标准溶液浓度和色谱峰面积建立标准曲线,计算样品中相应的色谱峰面积,带入标准曲线得到供试品溶液中丹酚酸B 的浓度,再乘以稀释倍数即可得到丹参提取液中丹酚酸B 的含量,计算结果保留到小数点后2 位数字。
1.4 丹酚酮类含量的检测
1.4.1 供试品溶液制备
精密量取丹参提取液样品1mL 至10mL 容量瓶中,加50%乙醇稀释并定容,0.22 μm 有机相针式过滤器过滤,取续滤液作为供试品溶液备用。
1.4.2 对照品溶液制备
取丹参酮ⅡA 对照品适量,精密称定,置棕色量瓶中,加甲醇制成每1 mL 含20 mg 的溶液,备用。
1.4.3 色谱条件
色谱柱:Agilent SB-Aq 型C18色谱柱,以乙腈为流动相A ,以0.02% 磷酸溶液为流动相B ,梯度洗脱程序如下:0~6 min 61% (A)、6~20 min 61%→90%(A)、20~20.5 min 90%→61%(A)、20.5~25 min 61%(A),流速为1 mL/min,柱温为20 ℃,检测波长为270 nm。
1.4.4 丹参酮类测定
测定法分别精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪测定。以丹参酮ⅡA 对照品为参照,以其相应的峰为S 峰,计算隐丹参酮、丹参酮I 的相对保留时间,其相对保留时间应在规定值的±5%范围之内。
相对保留时间和校正因子见表1。
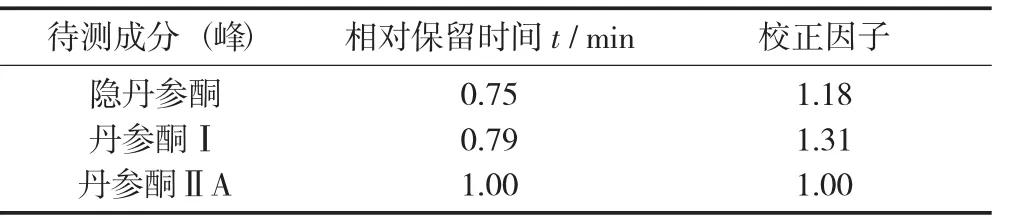
表1 相对保留时间和校正因子
以丹参酮ⅡA 的峰面积为对照,分别乘以校正因子,计算隐丹参酮、丹参酮I、丹参酮ⅡA 的含量。
2 结果与分析
2.1 单因素试验
2.1.1 因素水平表
影响丹参药材提取的因素主要有提取温度、提取时间、溶剂倍数、提取溶剂等。
单因素试验因素与水平设计见表2。

表2 单因素试验因素与水平设计
2.1.2 提取温度对丹参中丹酚酸B 和丹参酮类提取效果的影响
称取丹参药材5 份,每份50 g,分别加入50%乙醇300 mL,在50,60,70,80,90 ℃等不同温度条件下,提取2 次,每次提取1.0 h,收集提取液,按规定的方法分别测定丹参提取液中丹酚酸B 和丹参酮类的含量,计算丹酚酸B 和丹参酮类的提取率。
不同温度下丹酚酸B 和丹参酮类的提取率见表3。

表3 不同温度下丹酚酸B 和丹参酮类的提取率
由表3 可知,随着提取温度的增加丹酚酸B 的提取率呈增加趋势,分析原因为高温条件下更有利于丹酚酸B 的溶出,且在提取的短时间内丹酚酸B未发生分解。但温度对丹参酮类提取率几乎无影响。
2.1.3 提取溶剂对丹参中丹酚酸B 和丹参酮类提取效果的影响
称取丹参药材5 份,每份50 g,分别加入300 mL 20%,35%,50%,60%,70%等不同体积分数的乙醇溶液,在60 ℃条件下,提取1.0 h,提取2 次,收集提取液。按规定的方法分别测定丹参提取液中丹酚酸B 和丹参酮类的含量,计算丹酚酸B 和丹参酮类的提取率。
不同乙醇体积分数下丹酚酸B 和丹参酮类的提取率见表4。

表4 不同乙醇体积分数下丹酚酸B 和丹参酮类的提取率
由表4 可知,不同乙醇体积分数对丹酚酸B 和丹参酮类的提取率影响不同。随着乙醇体积分数的增加,丹酚酸B 的提取率先增加后降低,变化的幅度不大,乙醇体积分数为60%时,提取率最高。丹参酮类提取率随着乙醇体积分数的增加显著增加,乙醇体积分数为70%,提取率最高。
2.1.4 提取时间对丹参中丹酚酸B 和丹参酮类提取效果的影响
称取丹参药材5 份,每份50 g,加入50%乙醇300 mL,提取2 次,提取温度为60 ℃,提取时间分别为0.5,1.0,1.5,2.0,2.5 h,收集提取液。按规定的方法分别测定丹参提取液中丹酚酸B 和丹参酮类的含量,计算丹酚酸B 和丹参酮类的提取率。
不同提取时间下丹酚酸B 和丹参酮类的提取率见表5。

表5 不同提取时间下丹酚酸B 和丹参酮类的提取率
由表5 可知,随着提取时间延长,丹酚酸B 和丹参酮类的提取率均是先增加后降低,提取时间为1.5~2.0 h 时,提取率较高。
2.1.5 溶剂倍数对丹参中丹酚酸B 和丹参酮类提取效果的影响
称取丹参药材5 份,每份50 g,分别加入50%乙醇200 mL(4 BV),300 mL(6 BV),400 mL(8 BV),500 mL(10 BV),600 mL(12 BV),在60 ℃条件下,热提取1.0 h,提取2 次,收集提取液。按规定的方法分别测定丹参提取液中丹酚酸B 和丹参酮类的含量,计算丹酚酸B 和丹参酮类的提取率。
不同溶剂倍数条件下丹酚酸B 和丹参酮类的提取率见表6。
由表6 可知,随着溶剂倍数的增加,丹酚酸B和丹参酮类的提取率均呈现上升趋势,在溶剂倍数增加至6 BV 后,再增加溶剂倍数,丹酚酸B 和丹参酮类提取率提升的幅度有限。

表6 不同溶剂倍数条件下丹酚酸B 和丹参酮类的提取率
2.2 正交试验
根据单因素试验结果,正交试验设计以提取温度、溶剂体积分数、提取时间、溶剂倍数为考查因素,设计四因素三水平正交试验。称取50 g 丹参药材,按照正交试验设计表进行提取试验,提取2 次,提取结束后合并提取液,量取各提取液体积,按规定的检测方法测定丹酚酸B 和丹参酮类含量。
因素与水平设计见表7,直观分析见表8。

表7 因素与水平设计
由表8 可知,影响丹酚酸B 提取率大小的因素依次是提取温度(A) >溶剂体积分数(B) >提取时间(C) > 溶剂倍数(D),最佳提取条件为A3B1C3D1。丹参酮类提取因素影响大小依次为溶剂体积分数(B) >提取时间(C) >提取温度(A) >溶剂倍数(D),最佳提取条件为A1B2C3D3。综合丹酚酸B 和丹参酮类的提取率,并以各自提取率的1/2加和之后的提取率作为最终的选择依据,得出最佳提取条件为提取溶剂70%乙醇,提取温度80 ℃,每次提取2 h,溶剂倍数为6 BV。

表8 直观分析
2.3 正交试验验证和提取次数的优化
按正交试验得到的工艺条件,对提取次数进行优化和正交工艺验证。分别称取丹参饮片药材50 g的样品3 份,前2 次提取液和第3 次提取液分开收集,分别检测丹酚酸B 和丹参酮类的含量,计算丹酚酸B 和丹参酮类的提取率。
提取次数优化和正交验证试验结果见表9。
由表9 可知,第3 次提取丹酚酸B 和丹参酮类提取率的提取率平均值分别为11.5%和5.99%,需进行第3 次提取。3 组验证试验丹酚酸B 和丹参酮类的提取率平均值分别为82.40%和92.67%,已基本提取完全。

表9 提取次数优化和正交验证试验结果
2.4 温度对丹参提取液中丹酚酸B 和丹参酮类的稳定性影响
考虑丹酚酸B 和丹参酮类化合物对温度和加热时间的敏感性,开展丹参提取液在不同温度和不同加热时长下的稳定性考查,进一步验证提取工艺的合理性。准确吸取丹参中试第一批提取液5 mL 于试管中,共7 份,取一支做空白对照,其余6 支均分后分别置于65 ℃和80 ℃水浴中保温,连续加热8 h,分别在2,4,8 h 取出一支试管,自来水迅速冷却,转移到10 mL 容量瓶中定容,检测丹酚酸B和丹参酮类质量浓度,计算其降解率。
温度对丹酚酸B 和丹参酮类的影响数据见表10。
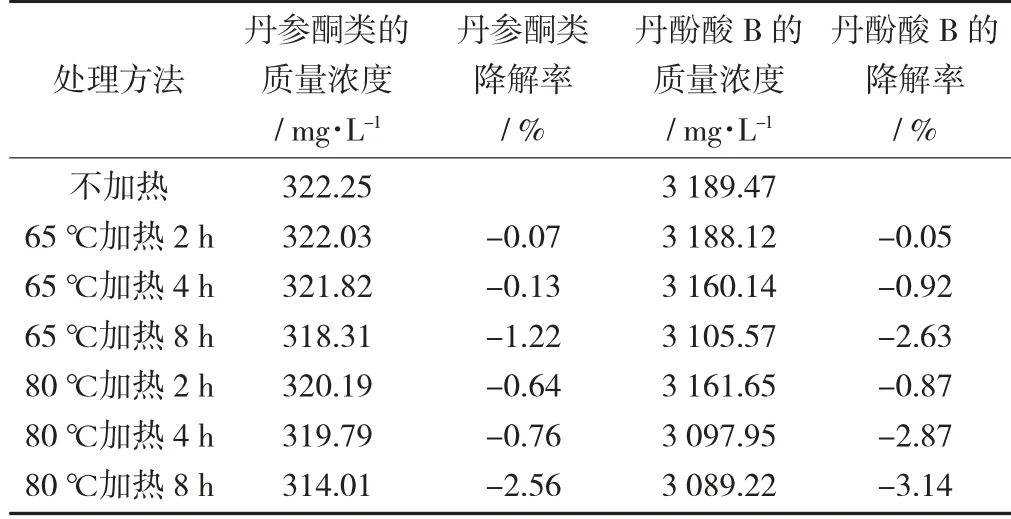
表10 温度对丹酚酸B 和丹参酮类的影响数据
由表10 可知,丹参提取液分别在65 ℃和80 ℃下恒温加热8 h,相同加热时间下,低温65 ℃条件下丹酚酸B 和丹参酮类的降解率略小于高温80℃,但2 种温度条件下丹酚酸B 和丹参酮类的质量浓度变化很小,由此可以说明短时间内,65 ℃和80 ℃恒温加热对丹参提取液中丹酚酸B 和丹参酮类的稳定性没有影响,此提取工艺中的提取温度和提取时间参数合理。
2.5 丹参提取工艺中试验证
丹参提取工艺确定:提取时溶剂为70%乙醇,溶剂倍数为药材量的6 BV,提取温度为80 ℃,提取3 次,每次2 h。为验证工艺条件进行3 批中试,每批次药材量为5 kg。收集提取液,检测丹酚酸B和丹参酮类质量浓度,计算丹酚酸B 和丹参酮类的提取率。
中试试验验证见表11。

表11 中试试验验证
由表10 可知,3 批中试的丹酚酸B 和丹参酮类的提取率平均分别为82.62%和94.49%。通过3 批次小试验证和3 批次中试验证研究结果,表明该提取工艺稳定、可行,重现性良好。
3 结论
试验以丹酚酸B 和丹参酮类(丹参酮ⅡA、丹参酮Ⅰ和隐丹参酮之和) 提取率为考查指标,以提取温度、提取时间、溶剂倍数和溶剂为考查因素,设计单因素试验、正交试验进行全面考查,确定最佳提取工艺为提取溶剂70%乙醇,溶剂倍数6 BV,提取温度80 ℃,提取3 次,每次提取2 h。
温度对丹酚酸B 和丹参酮类稳定性的影响研究结果表明,提取工艺中的提取温度和提取时间参数合理。验证试验中丹酚酸B 和丹参酮类提取率均较高,表明采用此提取工艺可以同时将水溶性和脂溶性成分基本提取完全,且工艺简单稳定,重现性好,适用于工业化大生产。
