技巧性有氧训练对PD大鼠运动行为和中脑内质网应激的影响
2022-09-23李艳霞李沛珊陈思宇朱正权杨新玲
李艳霞,高 华,李沛珊,陈思宇,朱正权,杨新玲*
(1新疆医科大学第二附属医院康复医学科,乌鲁木齐 830063;2新疆医科大学第五附属医院神经内科;3新疆医科大学第七附属医院康复医学科;4新疆医科大学附属肿瘤医院神经外科;*通讯作者,E-mail:poplar862@sohu.com)
帕金森病(Parkinson’s diseases,PD)是目前仅次于阿尔兹海默病的一种常见的神经系统退行性疾病[1],在我国65岁以上人群的患病率为1 700/10万,并随年龄增长而升高,给家庭和社会带来沉重的负担[2]。该病是年龄老化、遗传缺陷和环境毒素相互作用的结果,其发病机制仍未完全明了,也无根本的防治措施[3]。而内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡已被证明与神经退行性疾病的发病机制有关,包括帕金森病[4]。帕金森病的主要病理改变为黑质致密部多巴胺能神经元变性丢失、细胞内α-突触核蛋白等蛋白积聚和路易小体形成,蛋白积聚可诱发氧化应激和内质网应激,并介导多种信号途径参与多巴胺(dopamine,DA)神经元变性[5]。内质网应激导致了纹状体DA神经元的大量损失和基底神经节的运动控制功能障碍[6]。
康复与运动疗法对帕金森病运动和非运动症状改善乃至对延缓病程的进展可能都有一定的帮助,特别是帕金森病患者多存在步态障碍、姿势平衡障碍、语言和(或)吞咽障碍等轴性症状,可以从康复和运动疗法中获益[7]。研究表明,有氧运动可激活骨骼肌中的中央转录辅激活因子(PGC-1α),使纤维连接蛋白Ⅲ型结构域蛋白5(FNDC5)基因的表达上调[8],骨骼肌释放的全身因子FNDC5及其分泌形式鸢尾素(Irisin)增多,而FNDC5/Irisin可以通过血脑屏障,在神经元分化和成熟过程中发挥积极的调节作用。
本实验主要探讨技巧性有氧训练(skilled aerobic exercise,SAE)能否通过上调FNDC5表达,调节PD大鼠内质网功能,减少多巴胺神经元的凋亡,改善PD大鼠的运动功能,本研究以PD大鼠模型为研究对象,采用技巧性有氧训练对PD大鼠进行干预,评估PD大鼠的运动功能、大鼠骨骼肌FNDC5的表达水平、血清Irisin含量、中脑组织酪氨酸羟化酶的表达、内质网应激指标表达情况,旨在了解运动训练能否通过调节内质网应激、减少多巴胺神经元的凋亡,从而改善PD大鼠的运动功能。
1 材料与方法
1.1 实验试剂
L-抗坏血酸(Sigma公司,美国)、免疫组化染色试剂盒(北京中杉金桥)、DAB显色试剂盒(福州迈新生物)、RIPA裂解液、蛋白酶抑制剂(武汉博士德生物)、6-OHDA(大连美仑生物)、阿扑吗啡(Sigma公司,美国)、SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒(北京全式金生物)、兔抗鼠GAPDH、Bip/Grp78、TH、CHOP、FNDC5、Irisin ELISA试剂盒(北京博奥森生物)。
1.2 实验分组
将60只SD大鼠随机分为假手术组、模型组、假手术组+技巧运动组、模型组+技巧运动组,每组15只。
将30只大鼠使用水合氯醛将大鼠进行腹腔麻醉,然后将大鼠固定于大鼠立体定位仪上,剃除大鼠头部毛发,用手术刀切开皮肤露出颅骨,选择右侧两点:①黑纸致密部(SNC),坐标为前卤后平均(5.3±0.1)mm,矢状缝右侧平均(1.5±0.1)mm,硬膜下平均(7.9±0.1)mm;②腹侧被盖区(VTA),坐标为前卤后平均(4.8±0.1)mm,中线右侧平均(0.9±0.1)mm,硬膜下平均(7.4±0.1)mm,用微量注射器吸取10 μl的6羟基多巴胺(6-hydroxydopa mine,6-OHDA)(使用含有1%抗坏血酸的生理盐水溶解,浓度为2 μg/μl),针头垂直入颅,缓慢进针,按上述两点以1 μl/min的速度推注6-OHDA各5 μl,针头停留1 min,防止回流,然后缓慢退针。针孔按压止血后缝合头皮,碘伏消毒。术后腹腔注射50 000 U的青霉素以预防感染。造模后随机将其中15只分为模型组进行28 d随意运动,15只分为模型+技巧运动组进行为期28 d的技巧性有氧训练。
将30只大鼠进行麻醉、固定、坐标定位,方法同模型组,用微量注射器注射含有1%抗坏血酸的生理盐水10 μl(每点各注射5 μl)。造模后随机将其中15只分为假手术组进行28 d随意运动,15只分为假手术+技巧运动组进行为期28 d的技巧性有氧训练。
1.3 运动训练
1.3.1 技巧性有氧训练 造模后第3天开始,假手术+技巧运动组和模型组+技巧运动组大鼠进行技巧性有氧训练,轮径34.4 cm,有不规则间距的梯级,梯级宽0.3 cm,通过OOOOXOX的模式(见图1),O表示有梯级,X表示缺失梯级(缺失间隔1.3 cm)。运动训练为期28 d,每周连续5 d,间隔两天不训练,20 min/d。开始训练时将大鼠放在规则的跑轮上(见图2),每次5 min,每日4次,间隔2 min。大鼠习惯了以2 m/min的起始速度训练,之后每天增加1 m/min或2 m/min,直至速度达到8 m/min。第14天开始将大鼠放置在不规则的跑轮上训练,仍以2 m/min的起始速度训练,逐渐提高转轮速度,进行适应性挑战训练,且不会造成大鼠的紧张状态(监测排便和排尿作为急性应激反应的迹象)。

图1 不规则梯级跑轮Figure 1 Running wheel with irregular steps

图2 规则梯级跑轮Figure 2 Running wheel with regular steps
1.3.2 随意运动 造模后第3天开始,将假手术组和模型组大鼠放在规则梯级的跑轮上跑步。运动训练为期28 d,每周连续5 d,20 min/d。大鼠在跑轮上随意运动,不要求速度。
1.4 实验动物的行为测试
1.4.1 圆柱体实验 假手术组、假手术+技巧运动组、模型组和模型+技巧运动组的大鼠分别于运动第7,14,28天放置在一个透明的树脂玻璃桶内(直径20 cm,高30 cm)。观察并统计3 min内大鼠左前肢与圆柱体的接触次数,计算左前肢接触圆柱体比率:
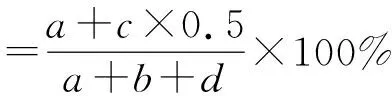
其中a为大鼠左前肢与圆柱体的接触次数;b为双侧前肢与圆柱体交替接触的次数;c为双侧前肢同时与圆柱体的接触次数;d为右前肢与圆柱体的接触次数。
1.4.2 APO诱导旋转实验 分别于运动第7,14,28天给予大鼠腹腔注射0.05 mg/kg阿扑吗啡,诱发大鼠向左侧单项旋转,记录开始旋转后30 min内大鼠的旋转圈数。
1.5 免疫组化检测中脑黑质部酪氨酸羟化酶(TH)表达
大鼠运动28 d结束后,取中脑黑质部组织经固定、包埋、切片后,二甲苯浸泡脱蜡、水化、抗原修复,3%H2O2去离子水浸泡去除内源性过氧化物酶,在稀释的一抗(TH 1 ∶170)中在4 ℃冰箱中浸泡过夜,滴加辣根过氧化物酶标记的二抗,室温静置孵育20 min。DAB显色3~10 min,自来水终止显色,苏木精复染3 min,脱水、透明、中性树胶封片,显微镜下观察拍片。
1.6 Western blot法检测中脑黑质部Bip/Grp78、CHOP蛋白表达水平和大鼠左后肢股四头肌组织中FNDC5表达水平
大鼠运动28 d结束后,分别取各组大鼠的脑黑质部组织和大鼠左后肢股四头肌组织,每组3例样本,样本经液氮研磨之后,取约100 mg样本加入到预冷的1.5 ml离心管中,然后加入400 μl RIPA裂解液(RIPA ∶PMSF ∶广谱磷酸酶抑制剂为100 ∶1 ∶1),充分混匀,4 ℃放置60 min后,12 000 r/min,4 ℃,离心15 min收集上清。BCA法测定蛋白浓度。样本加入适量5×SDS-PAGE loading buffer(含β-巯基乙醇),100 ℃沸水加热处理5 min,使蛋白充分变性后放入-80 ℃冰箱保存。按配方配制15%,12%,8%分离胶与5%浓缩胶。
加样:预染蛋白marker 9 l,样品每孔上样蛋白50 g。电泳:80 V恒压使溴酚蓝至分离胶处,恒压100 V,90 min,溴酚蓝到达较底部时,停止电泳。SDS-PAGE电泳结束后,将PVDF膜在甲醇中浸泡10 s,蒸馏水中漂洗1 min,然后将聚丙烯酰胺凝胶、滤纸以及处理过的PVDF膜在Transfer Buffer中浸泡10 min,制备转膜“三明治”,转膜时采用恒压转膜,电压100 V,Bip/Grp78、Actin使用0.45 μm PVDF膜,CHOP、FNDC5使用0.22 μm PVDF膜,CHOP、FNDC5、β-actin转膜时间为60 min,Bip/Grp78转膜时间为80 min。转膜后将PVDF膜水洗3次,5 min/次。
使用含5%脱脂奶粉的封闭液,封闭转印膜1 h,然后TBST洗3次,5 min/次。加入用TBST稀释一抗,β-actin(1 ∶1 000)、CHOP(1 ∶500),Bip/Grp78(1 ∶500)、FNDC5(1 ∶500)。4 ℃摇床孵育过夜。1×TBST漂洗3次,5 min/次。加入适当稀释的二抗(1 ∶5 000),室温孵育1 h。1×TBST漂洗3次,5 min/次。将DAB显色液A液和B液混合,加2 ml至膜上,用ChemiScope mini化学发光仪检测、拍照。使用Image J图像分析软件进行分析。每个实验重复3次。
1.7 ELISA法检测血清Irisin的含量
大鼠运动28 d结束后,将大鼠腹腔注射水合氯醛麻醉后剪开腹壁,剥离出腹主动脉,每只大鼠抽取血液约3 ml至抗凝管中。放在冰上,尽快离心(5 000 r/min)10 min,吸出血清,严格按照Irisin ELISA试剂盒说明书进行操作。每组6只大鼠,每只3个复孔,设置空白孔、标准孔和待测样品孔。每孔加样100 μl,在恒温箱中37 ℃孵育90 min。加入生物素化抗体工作液,恒温孵育1 h,充分洗板后每孔加入酶结合物工作液100 μl,恒温孵育30 min。再加入90 μl底物溶液,继续在恒温箱内避光孵育15 min。每孔加入终止液50 μl,蓝色迅速变为颜色深浅不一的黄色。反应终止后立即使用酶标仪检测在450 nm波长处各孔的吸光度值(OD值)。通过标准曲线计算样品中各指标浓度。
1.8 数据统计
2 结果
2.1 大鼠运动行为的检测
与假手术组比较,模型组大鼠较假手术组左前肢接触圆柱体的比率明显下降(P<0.05);经28 d技巧性有氧训练,与模型组比较,模型组+技巧运动组大鼠左前肢接触圆柱体的比率明显升高(P<0.05,见表1)。
表1 运动训练7,14,28 d四组大鼠左前肢接触圆柱体比率的比较
在大鼠的旋转实验中,与假手术组比较,模型组大鼠的旋转圈数均明显升高(P<0.05);经技巧性有氧训练14,28 d,与模型组比较,模型组+技巧运动组大鼠的旋转圈数明显下降(P<0.05,见表2)。

表2 运动训练7,14,28 d四组大鼠APO诱导旋转实验旋转圈数的比较圈)
2.2 技巧性有氧训练对内质网相关蛋白表达的影响
运动28 d,与假手术组比较,模型组大鼠中脑内质网应激相关蛋白Bip/Grp78、CHOP的表达明显升高(P<0.05);与模型组比较,模型+技巧运动组大鼠中脑Bip/Grp78、CHOP的表达明显下降(P<0.05,见图3)。
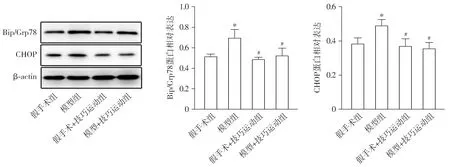
与假手术组相比,*P<0.05;与模型组相比,#P<0.05图3 运动28天四组Bip/Grp78和CHOP表达水平的比较Figure 3 Comparison of the expression level of Bip/Grp78 and CHOP after training for 28 d among four groups
2.3 技巧性有氧训练对骨骼肌的FNDC5蛋白和Irisin血清含量的影响
运动28 d,与假手术组相比,模型组大鼠骨骼肌的FNDC5蛋白表达和血清中Irisin的含量均明显下降(P<0.05);与模型组相比,模型+技巧运动组骨骼肌FNDC5蛋白表达和血清中Irisin的含量明显升高(P<0.05,见表3和图4)。
2.4 中脑TH蛋白免疫组化
与假手术组比较,假手术+技巧运动组TH阳性的神经元数量无明显差异,模型组表达TH阳性神经元数量减少,TH蛋白的IHC评分明显降低,差异有统计学意义(P<0.05);与模型组比较,模型+技巧运动组表达TH阳性的神经元数量增多,TH蛋白的IHC评分明显升高,差异有统计学意义(P<0.05,见图5和表4)。
表3 运动28 d四组血清Irisin含量的比较
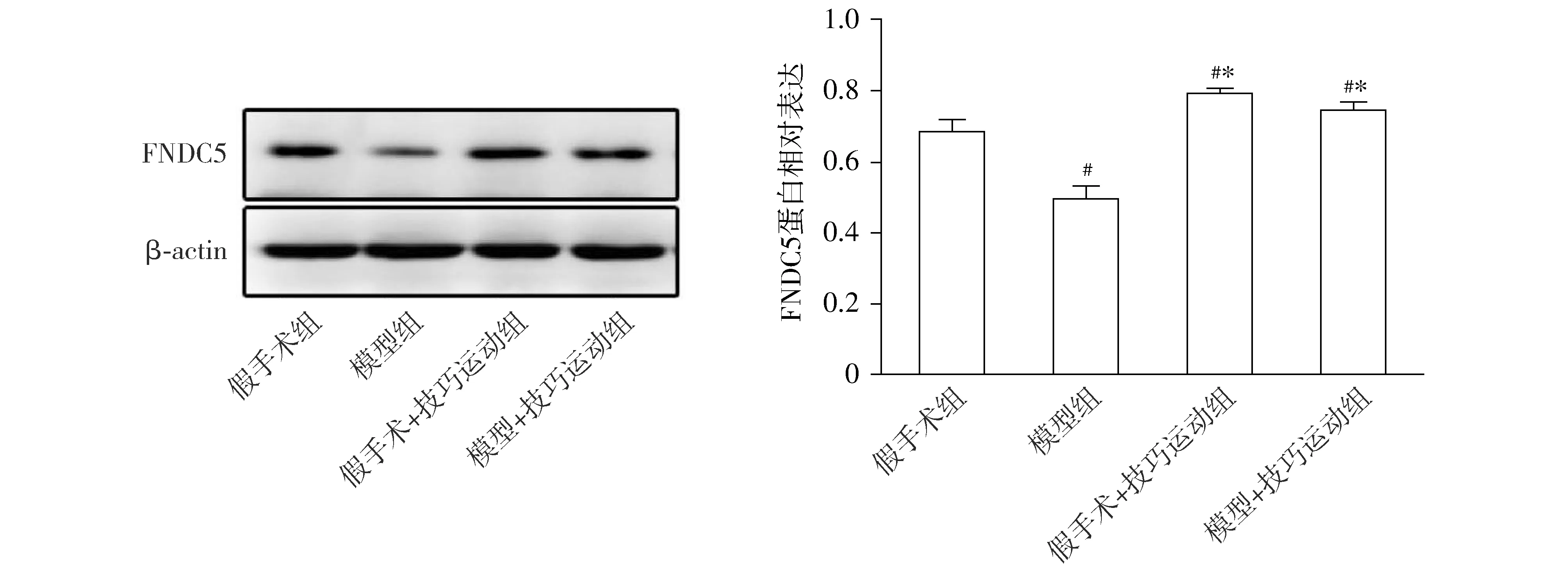
与假手术组相比,#P<0.05;与模型组相比,*P<0.05图4 运动28天四组大鼠骨骼肌FNDC5表达水平的比较Figure 4 Comparison of the expression of FNDC5 in rat skeleton muscle after training for 28 d among four groups
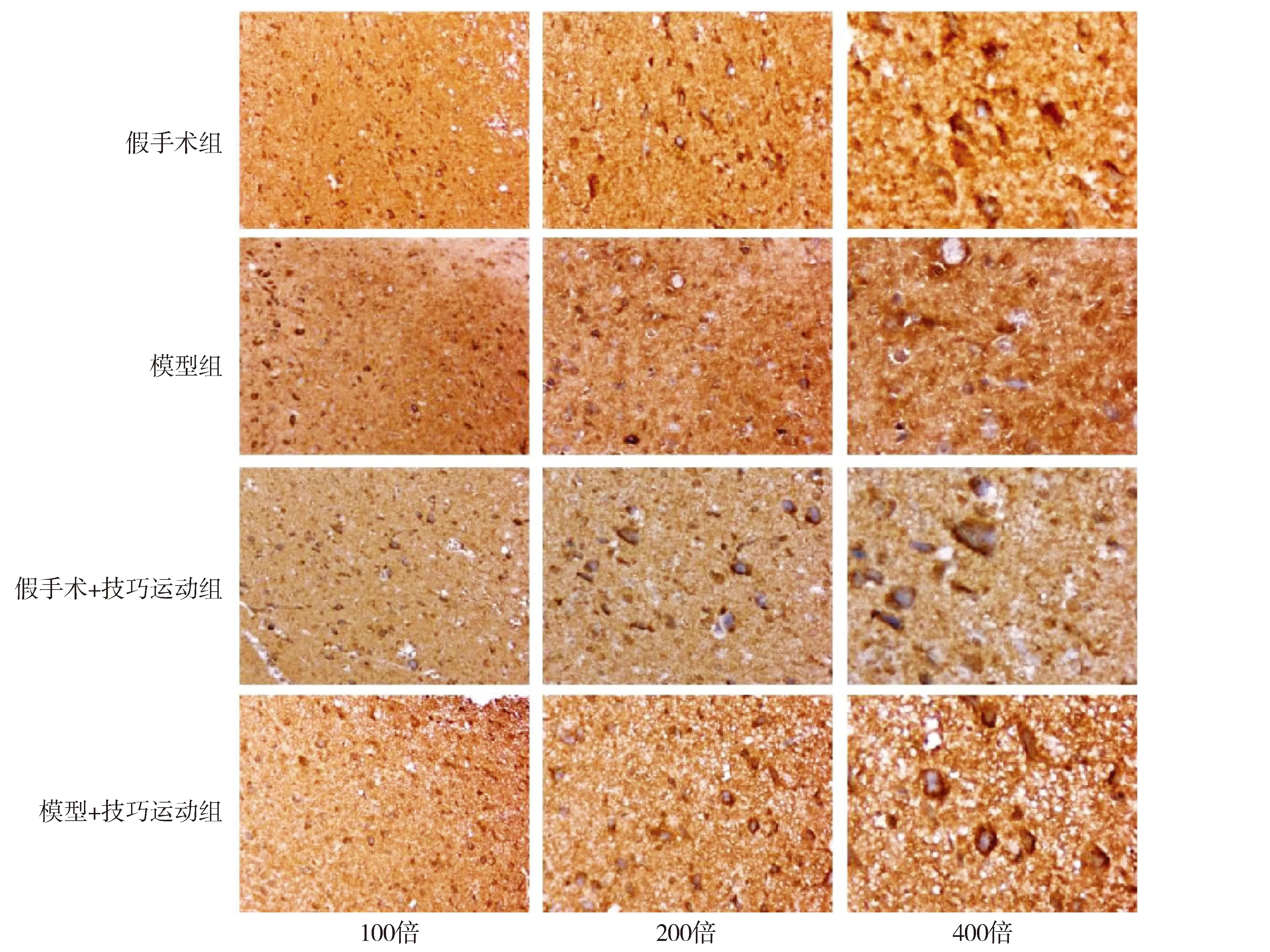
图5 运动28 d四组大鼠中脑TH的免疫组化染色结果比较Figure 5 Comparison of expression of TH in rat midbrain after training for 28 d by immunohistochemical staining among four groups

表4 运动28 d四组大鼠中脑TH表达水平的比较
3 讨论
目前,帕金森病的治疗方法和手段包括药物治疗、手术治疗、运动疗法、心理疏导及照料护理等[1]。药物治疗仍是PD的主要治疗方法,而康复治疗被认为可以改善PD患者多种功能障碍,提高生活自理能力[9]。包括自行车或跑步等有氧训练和肌肉强化康复与运动疗法对帕金森病症状的改善乃至对延缓病程的进展可能都有一定的帮助[10]。有积极的证据表明指导帕金森病患者进行平衡和步态训练能有效减少跌倒[11]。运动训练改善帕金森病患者的运动功能及临床症状,主要是通过改变基底神经节的运动环路和神经可塑性[12-14]。
运动方式和复杂性是帕金森病(PD)神经康复预后的关键因素。运动训练(exercise training,ET)包括运动技能训练和有氧运动,与简单的非技巧性有氧运动(non-skilled aerobic exercise, NSAE)相比,技巧性的有氧训练(skilled aerobic exercise,SAE)使动物能更好地恢复运动缺陷,使前额皮质前边缘区、躯体感觉皮质和小脑区的区域脑血流增加[15]。运动训练(包括运动技能训练和有氧运动)被认为可以协同改善PD患者运动控制的随意和不随意部分。本实验研究显示:SAE可使PD模型大鼠的患侧前肢的运动功能改善,且使APO诱导的旋转次数减少。
在本实验中SAE可增加PD大鼠骨骼肌中FNDC5的表达和血清中Irisin的含量。既往研究发现,通过Western blot和质谱分析也发现人类脑脊液中Irisin的存在。在原始小鼠胚胎的成熟过程中,皮质神经元的培养或人胚胎神经干细胞分化为神经元的过程中,FNDC5水平都有升高。在小鼠胚胎干细胞的神经前体形成过程中过表达FNDC5,使脑源性神经营养因子(BDNF)、GFAP和神经元成熟的标志物(Map2、β-tubulin Ⅲ和Neurocan)等增加[16]。通过过表达原代皮质神经元的FNDC5上调BDNF的表达,用RNAi敲低FNDC5下调BDNF的表达,证实了FNDC5是BDNF的重要调控因子。而BDNF是一种重要的神经营养因子,能增强神经元的存活、迁移和树突生长,调节突触的可塑性和认知功能,在神经元的稳态和功能维持,特别是神经发生方面起重要作用,是运动对大脑有益影响的重要调节因子[17]。
内质网(endoplasmic reticulum,ER)是细胞内重要的细胞器,主要参与调节蛋白质合成以及合成后蛋白质的折叠等。病理刺激(如氧化应激、脂质积聚等)会引起未折叠蛋白或错误折叠蛋白在内质网的聚集,产生ERS,激活未折叠蛋白反应(unfolded protein response,UPR)来保护由ERS引起的损伤,严重的ERS可以启动凋亡程序。葡萄糖调节蛋白78(Bip/Grp78)和C/EBP同源蛋白(CHOP)是ER应激的分子标志物,它们的水平增加提示ER应激诱导[18]。TH是多巴胺神经元的标志蛋白,本研究表明了帕金森大鼠模型中脑组织TH表达较假手术组明显降低,ERS相关分子Bip/Grp78和CHOP的表达上调,起到促凋亡的作用。而28 d SAE后PD大鼠中脑组织TH表达较模型组明显升高,Bip/Grp78和CHOP的表达有所下调。可能与SAE潜在地减少了多巴胺能神经元变性,诱导PD模型动物在包括运动皮层、基底神经节、中脑、小脑、红核的运动区域内的结构和功能的适应(可塑性)有关[13]。
因此,中长期的SAE可能通过上调PD大鼠骨骼肌中FNDC5的表达和血清中Irisin的含量,降低PD大鼠中脑内质网应激,减少多巴胺神经元的凋亡,从而改善PD大鼠的运动功能。但Irisin如何作用于中脑DA神经元,降低内质网应激的作用机制需要在今后的研究中进一步探讨。
