SIRT-1调控紧密连接蛋白保护肠缺血再灌注后引起的屏障损伤
2022-09-15李晓伟许华张传强
李晓伟,许华,张传强
南京医科大学附属江苏盛泽医院普外科,江苏苏州 215228
作为机体防御的重要屏障,肠道黏膜屏障在维持肠道菌群平衡、抵御病原菌侵袭方面发挥着重要的作用。研究报道,手术应激、创伤等多种病理条件会损伤肠黏膜,增加肠黏膜通透性,导致微生物、毒性物质能够顺利通过肠壁,引起炎症反应,甚至导致多器官功能障碍[1]。作为肠黏膜屏障的基础屏障,机械屏障受到破坏后会增加肠道通透性,导致大量细菌滋生,诱发菌群易位[2]。目前临床公认claudin家族是构成机械屏障的重要蛋白,主要分布在空回肠,与多数肠道疾病的形成及发展有关[3]。以往有学者在动物试验研究中发现大鼠小肠I/R后,SIRT1会呈现出降低趋势,考虑其能够对小肠I/R病理生理过程起到调控作用[4]。本研究选取2014年7月—2021年7月因肠系膜血栓导致的部分小肠坏死行手术治疗患者5例,旨在分析SIRT-1调控紧密连接蛋白claudin-4保护肠缺血再灌注后引起的屏障损伤,现报道如下。
1 资料与方法
1.1 一般资料
本研究经医院伦理委员会审批同意,选取南京医科大学附属江苏盛泽医院因肠系膜血栓导致的部分小肠坏死行手术治疗的5例患者作为研究对象,男3例,女2例;年龄28~64岁,平均(42.54±5.32)岁,所选病例患者或家属已知情同意。术中切除坏死肠管及部分正常肠管作为样本,对肠内容物予以生理盐水冲洗,提取部分坏死和正常肠黏膜,在液氮中保存。
1.2 纳入与排除标准
纳入标准:①所有患者经CT、MRI检查均确诊为肠系膜血栓;②患者交流无障碍,可配合研究;③患者均行手术治疗;④资料齐全,无重大器质性疾病。排除标准:①重要脏器严重受损;②合并精神类疾病;③恶性肿瘤疾病;④存在全身感染症状者;⑤治疗期间配合度、依从性不佳或中途退出;⑥免疫功能异常或凝血障碍;⑦妊娠妇女。
1.3 方法
1.3.1 Western Blot在6孔板内接种坏死肠管及正常肠管标本,经过24 h处理后,采用PBS进行3次漂洗,在每孔中加入1 mL含有浓度为1 mmol/L的苯甲基磺酰氟的RIPA裂解液(北京索莱宝科技有限公司),经过15 min冰浴处理后,按照12 000×g在4℃环境下进行离心处理,时间以15 min为宜。对上清液蛋白水平采用蛋白测定试剂盒(北京索莱宝科技有限公司)予以检测,蛋白上样后,设置电压为80 V,进行2 h电泳处理,然后调整为100 V恒压,进行1 h湿转直至形成PVDF膜,完成转膜后,采用脱脂奶粉(50 g/L)进行1 h封闭,然后在其中加入一抗(上海优宁维生物科技股份有限公司),保存于4℃冰箱中过夜。进行3次TBST洗膜,10 min/次。在其中加入二抗(上海西唐生物科技有限公司),室温环境下进行1 h孵育。再次进行3次TBST洗膜,10 min/次。将ECL化学发光试剂(陕西普罗安蒂生物科技发展有限公司)加入以显影。利用复日FR-988生物显微图像分析系统(浙江恒岳仪器有限公司)采集发光信号。
1.3.2 免疫荧光将同代细胞在盖玻片上接种,细胞生长融合后加入处理因素,将盖玻片取出后,经过PBS漂洗3次,10 min/次,然后采用多聚甲醛(40 g/L)(济南双盈化工有限公司)实施固定,时间为15 min,经过PBS漂洗后,在其中加入浓度为5 g/L的Triton-X-100(上海索宝生物科技有限公司),经过10 min处理与PBS漂洗,采用小牛血清清蛋白(北京凯诗源生物科技有限公司)进行封闭处理,在室温状态下共封闭1 h,然后将兔抗claudin-4抗体(北京义翘神州科技股份有限公司)加入,并加入适量抗体稀释液,切面后,在4℃环境下过夜。经过PBS漂洗,将FITC二抗(1∶200)(上海世泽生物科技有限公司)加入,在室温下进行1 h孵育。再次实施PBS漂洗。采用蒸馏水冲洗,封片采用甘油,在显微镜下予以观察。
1.3.3 PCR SIRT1-siRNA转染,Sense序列5’CCCUGUAAAG CUUUCAGAATT-3’,Anti sense序列5’UUCUGAAAGC UUUACAGGGTT-3’。
1.3.4 HE染色 采用二甲苯I、II(沈阳依莱普克斯化工有限公司)进行10 min脱蜡处理,分别采用100%、90%、80%、70%不同浓度酒精各进行5 min覆水处理,并用自来水进行冲洗,5 min/次,反复3次。给予HE染色,时间以5 min为宜。采用5%乙酸(济南宏博利化工有限公司)进行1 min分化,冲洗后,滴加适量乙酸,确保将玻片组织完全覆盖。伊红染色1 min,然后进行脱水处理,自然风干后封片,以5 min为宜。
1.3.5 TER检测选择生长状态良好的Caco-2细胞,在6孔Transwell小室(北京百奥思科生物医学技术有限公司)内接种,密度为(5~10)×105个/孔,将培养基加入Transwell小室、孔中,设置培养条件:O∶2CO∶2N2=20%∶5%∶75%,温度为37℃恒温,进行培养。每2天对培养基进行1次更换,对TER采用Millicel ERS细胞电阻仪进行连续测定,测定前,先在75%酒精中对触笔进行30 min浸泡,TER数值稳定后做好记录。单个孔内TER计算方法为电阻值与有效膜面积的乘积,测定未接种细胞TER数值,为Rcellmonolayer=Rsample-Rcontrol。计算给予白藜芦醇(西安博林生物技术有限公司)干预后TER的值。
1.4 统计方法
采用SPSS 22.0统计学软件处理数据,符合正态分布的计量资料用(±s)表示,进行t检验;采用Kruskal-Wallis法对非正态分布数据进行检验;组间比较采用SNK法检验。P<0.05为差异有统计学意义。
2 结果
2.1 坏死肠管与正常肠管claudin-4表达
claudin-4在缺血坏死肠管中的表达为(0.06±0.01),明显少于正常黏膜(0.22±0.06),差异有统计学意义(t=14.189,P<0.05),见图1。
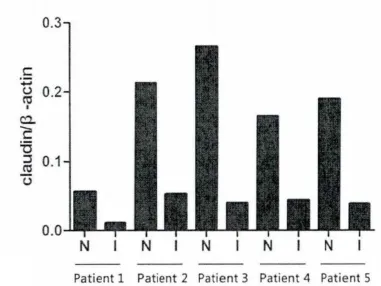
图1 坏死肠管与正常肠管claudin-4表达
2.2 激活SIRT-1表达后claudin-4表达
SIRT-1经过白藜芦醇激活后,SIRT-1表达升高,claudin表达为(0.61±0.12),较正常肠管增多,差异有统计学意义(P<0.05),HE染色可见组织破坏减轻,TER呈现出升高趋势。SIRT-1表达抑制后,claudin-4表达较正常肠管减少,肠道紧密连接结构受到破坏,结构断裂且模糊不清,差异有统计学意义(P<0.05),免疫荧光结果见图2。

图2 激活SIRT-1表达后claudin-4免疫荧光图
2.3 SIRT-1激活后肠黏膜屏障损伤分析
I/R后收集肠组织,实施HE染色后,在200倍光镜下观察,可以发现经过白藜芦醇处理后,小肠黏膜呈现完整的形态,绒毛整齐排列。充血症状明显缓解,且细胞结构破坏不明显。经过HE染色可见水肿及出血较未激活减轻,可见肺泡结构,炎性细胞少量存在,肺水肿症状缓解。
2.4 激活和抑制SIRT-1对TER的影响
采用Cac0-2细胞缺氧复氧6 h,对TER值进行检测,可以发现SIRT-1激活后,TER为(1 213.29±46.34)Ω·cm2,高于未激活的(992.49±24.65)Ω·cm2,差异有统计学意义(t=24.624,P<0.001);SIRT-1抑制后,TER降低为(426.50±33.21))Ω·cm2,与未激活比较差异有统计学意义(t=161.956,P<0.001)。
3 讨论
作为机体防御重要屏障,肠黏膜屏障能够对肠道内细菌及内毒素易位起到预防作用。大量临床研究证实受多种病理条件影响,TNF-α会呈现出高表达,对肠上皮细胞凋亡具有诱导作用,在黏膜固有炎性反应及上皮细胞脱落中具有一定的参与作用,是导致肠道上皮细胞通透性增加的主要因素,会导致肠屏障功能受损,诱发肠源性感染[5-6]。
作为屏障功能的重要蛋白,Claudin家族与多种肠道疾病形成有关。以往有学者在研究中发现多数肠道疾病伴随claudin蛋白表达,其中claudin-1、claudin-2表达能够反映出炎症反应的严重程度,疾病越严重,claudin-1、claudin-2表达量增加越明显[7-8]。肠道上皮形成屏障蛋白为Claudin-4,其与CPE结合后会通过质膜孔隙,上皮细胞Ca2+开放后,会导致不可控流入,引起细胞凋亡。claudin蛋白受损后会促使CPE与claudin蛋白基的外侧膜结合,加剧细胞损伤[9]。马远航[10]在研究中观察了SIRT-1调控claudin-4对患者肠屏障的影响,首先建立了一个缺氧、复氧模型,在1%浓度O2下进行12 h培养,然后复氧0、6、12、24、48 h,采用蛋白印迹法对SIRT-1、claudin-4表达进行检测,结果显示复氧6 h时,SIRT-1、claudin-4表达值达到最低值,为(0.12±0.01),复氧12 h时为(0.18±0.02),提示缺氧12 h、复氧6 h对细胞屏障功能损伤最为严重。采用药物对SIRT-1表达进行抑制,显示SIRT-1下调后会导致claudin-4表达减少,降低肠上皮细胞跨上皮电阻值,加重肠上皮屏障损伤。本研究调查研究结果,坏死肠管肠黏膜claudin-4表达量为(0.06±0.01),少于正常肠管的(0.22±0.06)(P<0.05),提示肠缺血后,claudin-4与肠屏障损伤密切相关。作为第三类组蛋白去乙酰化酶sirtuin蛋白家族成员,SIRT-1对HDAC有着较高的依赖性,催化结构域高度保守,能够对多种类型底物产生去乙酰化作用[11-12]。其通过抑制炎性因子生成途径或减轻细胞病理损伤,可对炎性反应起到抑制作用。以往有学者在研究中发现SIRT-1通过对肾脏疾病患者claudin-1基因启动区域组蛋白的调控,能够对claudin蛋白转录水平表达产生影响,使得屏障功能得到改善,提示SIRT-1在细胞屏障功能调节方面具有一定的效果[13-14]。本研究通过对SIRT-1的激活,结果显示claudin-4表达较正常肠管增多(P<0.05),肠I/R所致的黏膜屏障损伤得到改善。当SIRT-1受到干扰及抑制后,claudin-4减少。提示SIRT-1可通过对claudin-4的调控,改善肠道屏障损伤[15-16]。临床多采用TER对肠黏膜屏障功能予以评估,其降低提示肠黏膜通透性增加,伴随肠黏膜屏障损伤[17-18]。本研究HE染色可见组织破坏减轻,TER呈现出升高趋势;SIRT-1表达抑制后,TER呈现出降低趋势,SIRT-1表达的激活或增加TER表达,说明SIRT-1能够对TER调控可对肠黏膜屏障起到保护作用。
综上所述,SIRT-1通过对紧密连接蛋白claudin-4表达的调控,可对肠缺血再灌注后引起的屏障损伤起到保护作用,可作为临床治疗肠道疾病引起的SIRS及MODS的新靶点。
