乳腺癌肝转移的临床病理特征及影响因素
2022-09-15李鹏周丽丽
李鹏,周丽丽
1.淄博市妇幼保健院外科,山东淄博 255000;2.桓台县中医院儿科,山东淄博 256400
乳腺癌是目前严重威胁我国女性生命健康的恶性肿瘤,其为导致女性死亡的最常见恶性肿瘤前3位,尤其在西方发达国家,其发病率与致死率均为女性肿瘤的首位[1]。随着诊疗手段与技术的发展,目前乳腺癌患者确诊时以早期局限居多,极少有远处转移者,然而少部分患者确诊时已经合并远处转移[2],同时部分患者手术治疗后仍出现远处转移,其转移部位则以骨、肺、肝、脑等常见,对于乳腺癌预后则一旦发生远处转移则将显著增加患者病死率,尤其是河北哪个肝转移者[3],其预后多较不理想,如未得到及时处理则绝大多数患者仅可存活6个月左右[4]。随着我国乳腺癌患者的发病率、检出率等增高,其合并远处转移者的数量亦随之增多[5]。选择2019年3月—2021年7月淄博市妇幼保健院收治的乳腺癌患者80例为研究对象,探讨乳腺癌肝脏转移者病理特征,并分析其影响乳腺癌肝转移者预后的相关因素,现报道如下。
1 资料与方法
1.1 一般资料
选择淄博市妇幼保健院收治的乳腺癌患者80例为研究对象。所有入组者其临床资料获取均通过医院医学伦理委员会批准,且取得医务科、病案室许可。入组患者及家属知情同意并签署知情同意书。根据是否发生肝转移分为两组,其中存在肝转移者40例,无肝转移者40例,两组相关资料见表1、表2。
1.2 纳入与排除标准
纳入标准:入组者均通过病理组织学检查确诊,并结合医学影像学检查明确合并肝转移;患者既往体健。排除标准:存在严重心肺功能不全、精神异常者;预计生存时间在1个月以内者;男性患者;原发病灶非乳腺者;同时合并其他部位原发恶性肿瘤者;临床资料不完整者。
1.3 方法
首先通过常规肝脏超声检查初诊乳腺癌肝转移病灶,随后实施增强CT检查,并结合PET/CT针对存在的肝转移病灶进行精确定位,与此同时结合患者血清肿瘤标记物CA-125,CA-153、癌胚抗原和甲胎蛋白等检查,并在明确肝脏病灶后通过经皮肝穿刺病理组织活检确诊。
1.4 观察指标
首先根据乳腺癌患者是否合并肝转移,统计其年龄、肿瘤大小、腋下淋巴结数量、病程、手术方式和病变部位等一般资料,并对是否合并肝转移者的组织分化与分级等进行比较,结合免疫组化验查分析免疫学指标中的ER阳性、PR阳性和Her-2阳性比例,分析肝转移发生时间与肿瘤大小、腋下淋巴结数量及病程的相关性,针对影响乳腺癌术后肝转移的影响因素再实施多因素Logistic回归分析,明确影响乳腺癌术后肝转移的相关影响因素和独立危险因素。
1.5 统计方法
采用SPSS 20.0统计学软件处理数据,符合正态分布的计量资料以(±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验;肝转移发生时间与肿瘤大小、腋下淋巴结数量及病程的相关性分析以Pearson法进行,针对影响乳腺癌术后肝转移的危险因素进行单因素和多因素Logistic回归分析,P<0.05为差异有统计学意义
2 结果
2.1 肝转移和无肝转移患者一般资料比较
肝转移者肿瘤大小大于无肝转移者,腋下淋巴结数量多于无肝转移者,病程长于无肝转移者,差异有统计学意义(P<0.05)。且手术方式以保乳术居多,见表1、表2。
表1 肝转移和无肝转移患者一般资料比较(±s)

表1 肝转移和无肝转移患者一般资料比较(±s)
类型肝转移(n=40)无肝转移(n=40)t值P值年龄(岁)42.5±5.8 43.1±6.1 0.451 0.653肿瘤大小(cm)5.1±1.1 3.5±0.7 7.761<0.001腋下淋巴结数量(个)5.2±1.4 3.5±0.5 7.232<0.001病程(年)1.5±0.1 0.3±0.1 53.666<0.001
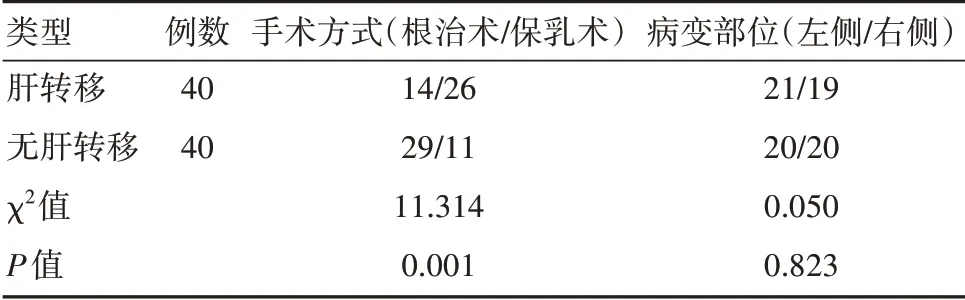
表2 肝转移和无肝转移患者一般资料比较
2.2 肝转移和无肝转移患者分化情况、组织分级和免疫学指标比较
肝转移者其低分化、组织学分级Ⅱ级及以上和淋巴结阳性比例高于无肝转移者,ER阳性、PR阳性和Her-2阳性比例低于无肝转移者,差异有统计学意义(P<0.05)。见表3。
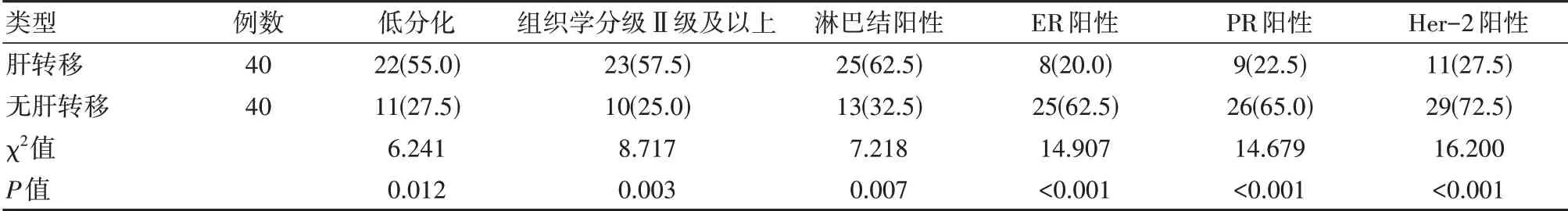
表3 肝转移和无肝转移患者分化情况、组织分级和免疫学指标比较[n(%)]
2.3 肝转移发生时间与肿瘤大小、腋下淋巴结数量及病程的相关性分析
肝转移发生时间与肿瘤大小呈正相关(r=0.659,P<0.001),肝转移发生时间与腋下淋巴结数量呈正相关(r=0.826,P<0.001),肝转移发生时间与病程呈正相关(r=0.716,P<0.001)。
2.4 影响乳腺癌术后肝转移的多因素Logistic回归分析
多因素Logistic回归分析发现,腋下淋巴结数量>3个、手术方式为保乳术、病理类型为低分化、组织学分级Ⅱ级及以上为影响乳腺癌术后肝转移的独立危险因素(P<0.05)。患者病程、淋巴结阳性情况、ER阳性、PR阳性以及Her-2阳性等不是乳腺癌术后发生肝转移的危险因素。见表4。

表4 影响乳腺癌术后肝转移的多因素Logistic回归分析
3 讨论
乳腺癌的发现率随着近年医疗技术水平的改善,有明显增高,其中早期乳腺癌亦得以检出,进而有效降低乳腺癌的病死率。但部分乳腺癌患者虽然及时接受手术治疗,仍有发生术后远隔脏器转移的概率[6]。其中肝转移是乳腺癌手术后较为常见的转移部位,其多数预后不良[7]。因乳腺癌肝转移后患者早期多无明显症状,发现时多处于肝功能严重损伤状态,此时患者的肝转移病灶已处于十分严重阶段,对于常规的化疗、靶向药物干预等效果有限[8-9]。既往研究证实,不同病理类型的乳腺癌患者其发生肝转移的概率不尽相同[10]。而目前针对病理数据与乳腺癌肝转移的相关性的报道相对较少,尤其是病理相关指标与乳腺癌术后肝转移的相关性及对预后的评估方面,有待进一步深入研究。
针对乳腺癌是否发生肝转移者,本研究发现肝转移者肿瘤大小大于无肝转移者,腋下淋巴结数量多于无肝转移者,病程长于无肝转移者,且手术方式以保乳术居多。杨平[11]研究称乳腺癌合并肝转移者,其肿瘤大小为(5.0±1.0)cm,腋下淋巴结数量为(5.0±1.5)个,且其病程为(1.5±0.1)年,其结果与本研究结果相符。证实乳腺癌患者发病时其病灶相对较大,多合并腋下淋巴结转移,且病程较长,而且进行手术治疗时其多选择保乳手术。另外肝转移者其低分化、组织学分级Ⅱ级及以上和淋巴结阳性比例分别为22例(55.0%),23例(57.5%)和25例(62.5%),高于无肝转移者的11例(27.5%),10例(25.0%)和13例(32.5%)(P<0.05),ER阳性、PR阳性和Her-2阳性比例为低于无肝转移者(P<0.05)。叶晔等[12]则认为肝转移者其低分化、组织学分级Ⅱ级及以上和淋巴结阳性比例分别达到55.0%,62.5%及65.5%,两项研究结果具有显著一致性。本研究结果发现乳腺癌肝转移者其病理分化程度以低分化多见,组织学分级Ⅱ级及以上为主,且合并有淋巴结阳性者居多。随后分析肝转移发生时间与肿瘤大小、腋下淋巴结数量及病程的相关性发现,肝转移发生时间与肿瘤大小呈正相关,肝转移发生时间与腋下淋巴结数量呈正相关,肝转移发生时间与病程呈正相关。唐铃丰等[13]亦认为乳腺癌患者肝转移发生时间与肿瘤大小、腋下淋巴结数量及病程均呈正相关。说明肿瘤病灶越大、发病时腋下淋巴结数量越多、患者病程越长其发生肝转移的概率越高。最后针对影响乳腺癌术后肝转移的多因素Logistic回归分析,腋下淋巴结数量>3个、手术方式为保乳术、病理类型为低分化、组织学分级Ⅱ级及以上为影响乳腺癌术后肝转移的独立危险因素。患者病程、淋巴结阳性情况、ER阳性、PR阳性以及Her-2阳性等不是乳腺癌术后发生肝转移的危险因素。徐伟熙等[14]研究亦提示发病时腋下淋巴结数量≥3个,采取保乳术的低分化组织学分级Ⅱ级以上者,是乳腺癌术后肝转移的独立危险因素。
目前针对乳腺癌肝转移的研究其循证医学证据级别均相对较低,尚无随机对照研究结果。故针对乳腺癌肝转移手术治疗选择指导意义有限。且目前尚无明确指南针对乳腺癌手术后肝转移的救治进行阐述[11]。乳腺癌患者肿瘤病灶越大、腋下淋巴结数量越多、病程越长,提示肿瘤组织的恶性程度越高,从而更容易发生远隔脏器的早期转移[12]。同时其病理类型为低分化、组织学分级Ⅱ级及以上者其肿瘤细胞增殖能力越强,恶性程度越高,提示其早期出现肝转移的概率亦越高[13]。而且乳腺癌肝转移者其机体免疫微环境改变,通过肿瘤间质中浸润淋巴细胞比例进而诱导肿瘤组织与机体的免疫应答失衡,对于ER、PR和Her-2三阴性乳腺癌者,其生物学行为活性更高、病理特征以中、低分化常见,对多种抗肿瘤药物耐受,其实施免疫治疗效果较差,即便实施手术治疗,亦存在较高的术后早期远隔脏器转移风险[14-15]。
综上所述,病灶>3 cm、腋下淋巴结数量>3个的低分化、实施保乳术、组织学分级Ⅱ级及以上的乳腺癌患者,其发生肝转移概率较高,需要引起临床重视。
