Wiltse入路腰椎椎体间融合术治疗极外侧腰椎间盘突出症患者的回顾性研究
2022-09-14吕海文
吕海文
河南科技大学第二附属医院骨科,河南洛阳 471000
腰椎间盘突出症是临床上常见疾病,极外侧腰椎间盘突出症作为其中的一种,占所有腰椎间盘突出症的6.9%[1],可引起较为严重的腰腿痛根性症状,临床上多伴有腰背部疼痛、下肢放射性疼痛等,还可出现下肢感觉运动功能障碍,严重时可引起下肢瘫痪或马尾综合征[2]。手术是临床治疗该病的主要手段,腰椎椎体间融合术作为常用手段,不仅能在直视下摘除突出髓核,对神经进行有效减压,还能促进椎间隙高度恢复,提高脊柱稳定性,应用广泛[3]。然而,随着微创理念发展,临床对极外侧腰椎间盘突出症手术入路的研究逐渐增加,如Wiltse入路、传统后正中入路等,且对不同入路的治疗效果存在争议。目前,关于Wiltse入路腰椎椎体间融合术治疗极外侧腰椎间盘突出症的研究多关于手术时间、术中出血量等围术期指标,而对于组织创伤引起的血清生化指标变化程度的报道较少。基于此,本研究回顾性选取河南科技大学第二附属医院收治的106例极外侧腰椎间盘突出症患者,旨在观察手术指标、术后恢复指标、血清学指标变化,分析Wiltse入路的治疗效果,现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性选取2017年6月—2019年4月河南科技大学第二附属医院收治的106例极外侧腰椎间盘突出症患者作为研究对象,将接受传统后正中入路腰椎椎体间融合术治疗的52例患者作为传统组,将接受Wiltse入路腰椎椎体间融合术治疗的54例患者作为Wiltse组。两组患者性别、年龄病程、突出节段、病变类型等一般资料具有可比性(P>0.05),见表1。本研究经医院医学伦理委员会审批通过。
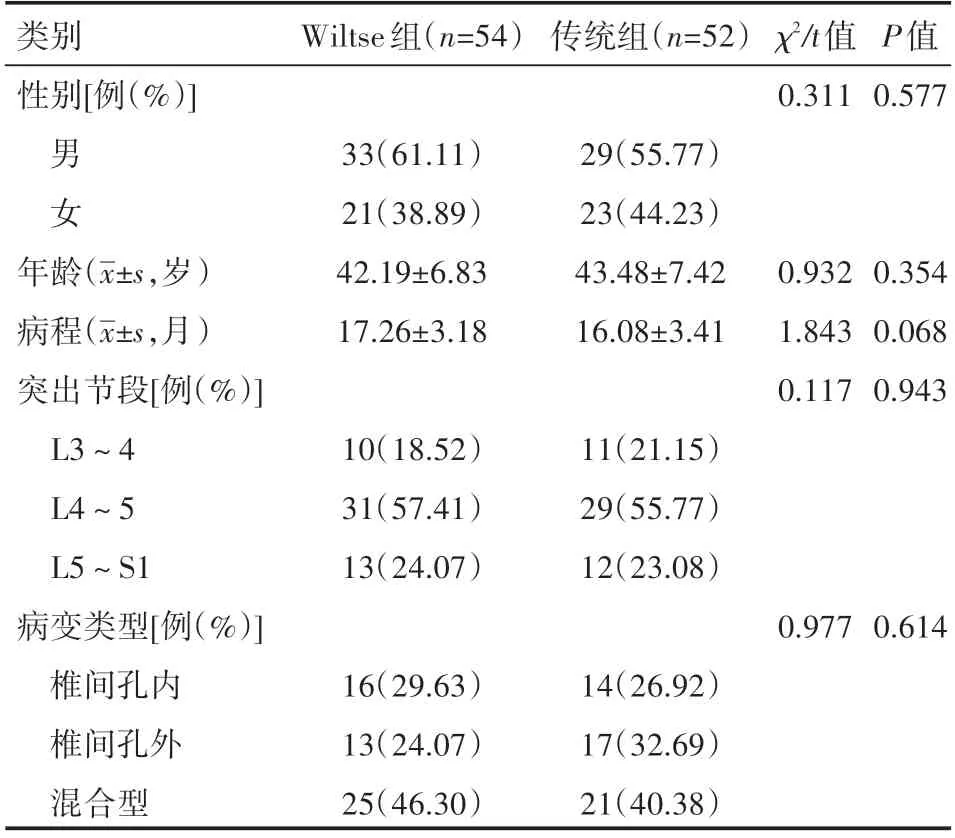
表1 两组患者一般资料情况
1.2 纳入及排除标准
纳入标准:均经MRI、CT等影像学检查确诊;均为单节段突出;伴有骨质增生但无骨桥形成;非手术治疗6~8周以上效果不明显;未合并脊柱不稳;无腰椎先天性发育不良;均行手术治疗,且顺利完成;无凝血、免疫功能障碍;临床资料完整。排除标准:黄韧带钙化;椎体爆裂性骨折;腰椎管狭窄;脊柱侧弯畸形;腰椎滑脱;多节段突出;合并脊柱结核、椎间盘炎等感染性疾病;马尾综合征;L5~S1节段突出但骨盆平片显示髂骨过高,导致穿刺针难以穿刺至病变部位。
1.3 方法
1.3.1 Wiltse组接受Wiltse入路腰椎椎体间融合术治疗。患者入手术室后常规建立静脉通道、监测生命体征。患者行全身麻醉,取俯卧位,垫空腹部。C型臂X线机透视定位椎间盘突出节段,在病变下腰椎中心处作切口,经Wiltse入路进入病变处椎间盘,向突出侧剥离棘突旁肌肉,充分暴露病变部位。采用常规方法置入椎弓根螺钉,之后定位针固定突出处上下椎体。在棘突旁约2.0~2.5 cm处,切开腰背筋膜,暴露椎旁竖脊肌群,手指纵向分离内侧肌间隙(多裂肌与外侧最长肌间),钝性分离,剥离些许深层横突、外侧关节突,暴露椎弓根螺钉进针点。使用C型臂X线机透视,确认进针节段、角度,置入椎弓根螺钉,在健侧处安装连接棒,以辅助撑开该节段椎间隙,暴露患侧关节突关节,根据具体情况,切除下方黄韧带、软组织,切除病侧关节突(上下部分或全部),之后经椎间孔摘除突出椎间盘。完成后对神经进行减压,在患侧斜向对侧处植入椎间隙,加压固定。再次确认内固定装置情况,满意后进行伤口冲洗、置入引流管、缝合等操作。
1.3.2传统组接受传统后正中入路腰椎椎体间融合术治疗。术前准备同Wiltse组,C型臂X线机透视定位椎间盘突出节段,在脊柱后正中5 cm处作切口,切口皮肤、皮下组织,切断棘突上多裂肌附着点,沿棘突双侧,剥离椎旁肌,以便暴露双侧关节突关节,其余操作同Wiltse组。两组患者术后进行常规抗感染、拔管、腰椎功能锻炼,出院后定期随访。
1.3.3检测方法分别于术前、术后1 d、术后3 d和术后7 d采集患者5 mL静脉血,4 000 r/min离心,时间为5 min,取血清,采用酶联免疫吸附试验检测促肾上腺皮质激素(ACTH)、皮质醇(Cor)、肿瘤坏死因子-α(TNF-α),采用比色法测定肌酸激酶(CK),试剂盒由上海酶联生物科技有限公司提供。
1.4 观察指标
(1)比较两组患者手术相关指标,包括手术时间、术中失血量、术后引流量。(2)比较两组患者术后1年健侧多裂肌残存率,包括L3~L4、L4~L5、L5~S1节段。均于术前、术后1年,使用MRI进行检查,使用PACS软件测量病变节段健侧腰椎椎间隙平面多裂肌横断面面积,根据术后1年多裂肌面积/术前面积的方法计算多裂肌残存率。(3)比较两组患者术前、术后6个月和术后1年疼痛程度,包括腰痛、下肢痛,采用视觉模拟量表(VAS,0~10分)评估,得分越高表示疼痛越剧烈。(4)比较两组患者术前、术后6个月和术后1年腰椎功能,采用Oswestry功能障碍指数(ODI,0~50分)评估,得分越高表示功能障碍越严重。(5)比较两组患者术前、术后1 d和术后3 d应激反应水平,包括血清ACTH、Cor、TNF-α。(6)比较两组患者术前、术后3 d和术后7 d血清CK水平。
1.5 统计学方法
采用SPSS 22.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标情况
Wiltse组手术时间较传统组短,术中失血量、术后引流量较传统组少,差异有统计学意义(P<0.05),见表2。
表2 两组患者手术相关指标情况(±s)

表2 两组患者手术相关指标情况(±s)
组别Wiltse组(n=54)传统组(n=52)t值P值手术时间(min)103.26±15.18 119.74±16.35 5.381<0.001术中失血量(mL)134.86±34.91 216.37±40.22 11.155<0.001术后引流量(mL)119.34±30.15 185.29±34.76 10.447<0.001
2.2 两组患者健侧多裂肌残存率情况
术后1年,Wiltse组L3~4、L4~5、L5~S1节段多裂肌残存均较传统组高,差异有统计学意义(P<0.05),见表3。
表3 两组患者健侧多裂肌残存情况(±s)

表3 两组患者健侧多裂肌残存情况(±s)
组别Wiltse组(n=54)传统组(n=52)t值P值L3~L4节段0.94±0.11 0.65±0.10 14.186<0.001 L4~L5节段0.96±0.08 0.73±0.09 13.919<0.001 L5~S1节段0.93±0.12 0.68±0.09 12.099<0.001
2.3 两组患者疼痛程度情况
两组患者术前腰痛VAS评分、下肢痛VAS评分对比,差异无统计学意义(P>0.05);术后6个月、术后1年,Wiltse组腰痛VAS评分、下肢痛VAS评分均低于传统组,差异有统计学意义(P<0.05),见表4。
表4 两组患者手术前后疼痛程度情况(±s)分
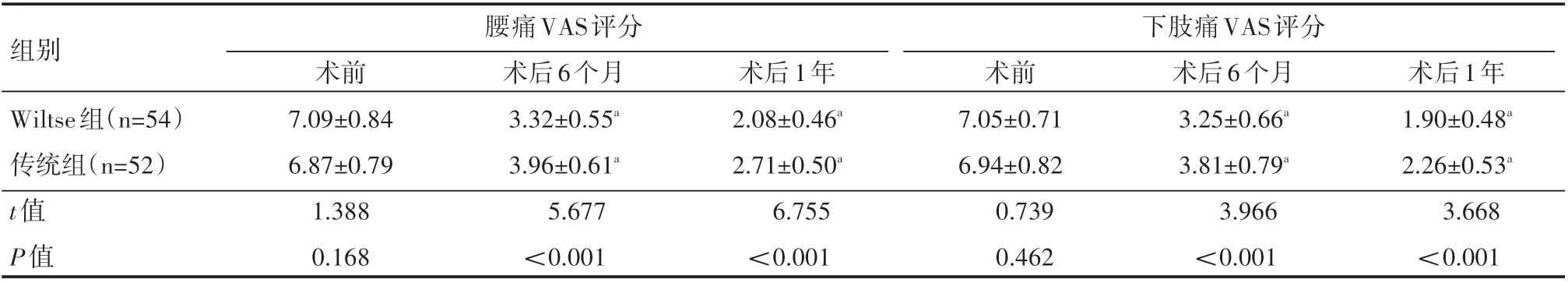
表4 两组患者手术前后疼痛程度情况(±s)分
a表示与同组术前比较,P<0.05。
组别Wiltse组(n=54)传统组(n=52)腰痛VAS评分下肢痛VAS评分t值P值术前7.09±0.84 6.87±0.79 1.388 0.168术后6个月3.32±0.55a 3.96±0.61a 5.677<0.001术后1年2.08±0.46a 2.71±0.50a 6.755<0.001术前7.05±0.71 6.94±0.82 0.739 0.462术后6个月3.25±0.66a 3.81±0.79a 3.966<0.001术后1年1.90±0.48a 2.26±0.53a 3.668<0.001
2.4 两组患者手术前后腰椎功能
两组患者术前ODI评分对比,差异无统计学意义(P>0.05);术后6个月和术后1年,与传统组对比,Wiltse组ODI评分均较低,差异有统计学意义(P<0.05),见表5。
表5 两组患者手术前后腰椎功能情况(±s) 分
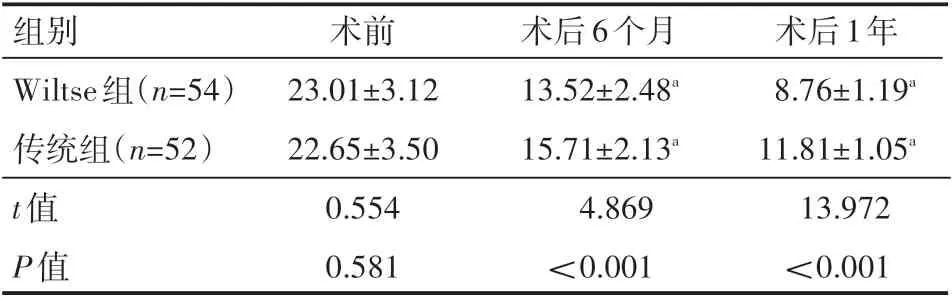
表5 两组患者手术前后腰椎功能情况(±s) 分
a表示与同组术前比较,P<0.05。
组别Wiltse组(n=54)传统组(n=52)t值P值术前23.01±3.12 22.65±3.50 0.554 0.581术后6个月13.52±2.48a 15.71±2.13a 4.869<0.001术后1年8.76±1.19a 11.81±1.05a 13.972<0.001
2.5 两组患者应激反应水平情况
两组患者术前血清ACTH、Cor、TNF-α水平对比,差异无统计学意义(P>0.05);两组患者术后1 d、3 d血清ACTH、Cor、TNF-α水平较术前提高,而Wiltse组低于传统组,且术后3 d低于术后1 d,差异有统计学意义(P<0.05),见表6。
表6 两组患者手术前后应激反应水平情况(±s)
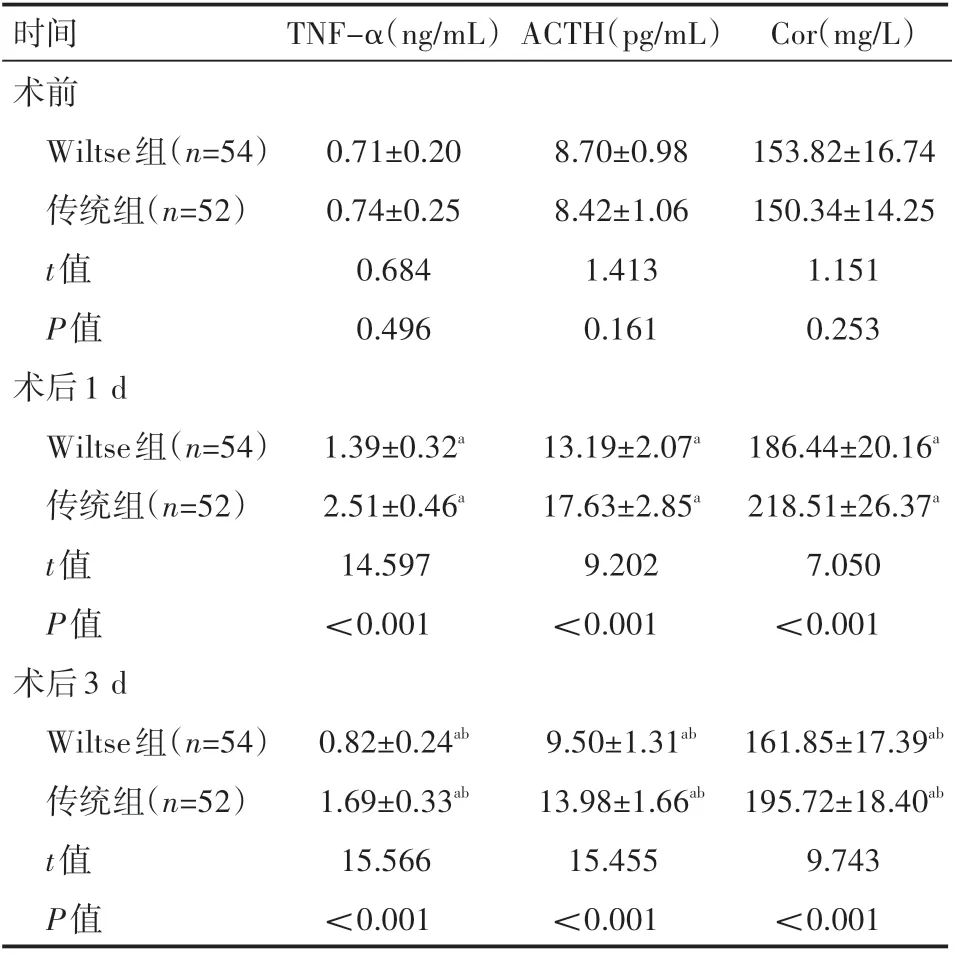
表6 两组患者手术前后应激反应水平情况(±s)
a表示与同组术前比较,P<0.05;b表示与同组术后1 d比较,P<0.05。
时间术前Wiltse组(n=54)传统组(n=52)TNF-α(ng/mL)ACTH(pg/mL)Cor(mg/L)t值P值0.71±0.20 0.74±0.25 0.684 0.496 8.70±0.98 8.42±1.06 1.413 0.161 153.82±16.74 150.34±14.25 1.151 0.253术后1 d Wiltse组(n=54)传统组(n=52)t值P值1.39±0.32a 2.51±0.46a 14.597<0.001 13.19±2.07a 17.63±2.85a 9.202<0.001 186.44±20.16a 218.51±26.37a 7.050<0.001术后3 d Wiltse组(n=54)传统组(n=52)161.85±17.39ab 195.72±18.40ab 9.743<0.001 t值P值0.82±0.24ab 1.69±0.33ab 15.566<0.001 9.50±1.31ab 13.98±1.66ab 15.455<0.001
2.6 两组患者血清CK水平情况
两组患者术前血清CK水平对比,差异无统计学意义(P>0.05);术后3 d和术后7 d,两组患者血清CK水平均较术前有所升高,但Wiltse组均低于传统组,且术后7 d低于术后3 d,差异有统计学意义(P<0.05),见表7。
表7 两组患者手术前后血清CK水平情况(±s)U/L
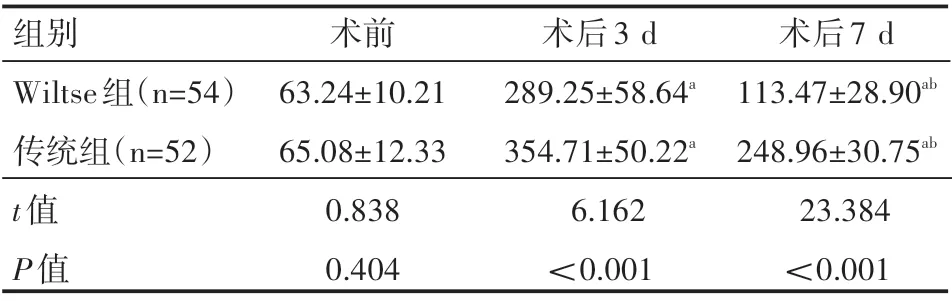
表7 两组患者手术前后血清CK水平情况(±s)U/L
a表示与同组术前比较,P<0.05;b表示与同组术后3 d比较,P<0.05。
组别Wiltse组(n=54)传统组(n=52)t值P值术前63.24±10.21 65.08±12.33 0.838 0.404术后3 d 289.25±58.64a 354.71±50.22a 6.162<0.001术后7 d 113.47±28.90ab 248.96±30.75ab 23.384<0.001
3 讨论
近年来,随着我国人口老龄化、生活方式改变、工作强度加大等变化,腰椎间盘突出症患者逐渐增多,发病率逐年升高,并趋于年轻化。极外侧腰椎间盘突出症作为其中的特殊类型,可压迫同节段神经根,引起一系列临床症状,临床诊断率逐年升高,严重影响患者生活质量。目前临床上尚缺乏统一治疗标准,经腰椎间孔椎体间融合是主要治疗手段之一,效果确切,但临床实践表明,不同手术入路对极外侧腰椎间盘突出症患者治疗效果不同。
为明确Wiltse入路应用价值,本研究对医院收治的106例极外侧腰椎间盘突出症患者的临床资料进行回顾,结果表明,Wiltse入路腰椎椎体间融合术治疗极外侧腰椎间盘突出症,能有效缓解疼痛程度,加快腰椎功能恢复。分析原因为,Wiltse入路腰椎椎体间融合术具有以下优势:(1)术中无需广泛剥离椎旁肌,能减少对周围血管的损伤,从而可减少术中失血量、术后引流量。(2)手术操作简单,能有效缩短手术时间。(3)属于微创术式,能减少损伤多裂肌,稳定腰椎稳定性,从而能减少其引发的腰背部疼痛。(4)术中无需破坏腰椎后韧带复合体,能稳定伸屈、旋转时腰椎稳定性,不仅可缓解疼痛,还能促进腰椎功能恢复[4]。
CK能可逆性催化肌酸、二磷酸腺苷间的反应,骨骼肌受损时,其活性增强,并与组织受损程度呈正相关关系,临床检测其水平可较好地反映手术对肌肉组织造成的损伤程度。本研究结果表明,Wiltse入路腰椎椎体间融合术治疗极外侧腰椎间盘突出症能减少椎旁肌损伤。Wiltse入路选择从多裂肌与最长肌的自然间隙进入,并通过钝性分离迅速暴露病变关节的关节突关节、横突,保留腰椎后部肌肉、韧带完整性,且对椎旁肌神经支配影响较小,从而减少对椎旁肌的损伤[5]。
应激反应是机体受创后重要病理变化之一,且创伤越大,应激反应程度越大。TNF-α属于炎性介质,可参与炎症反应,是手术引起炎症应激的重要指标。ACTH、Cor为典型应激激素,其水平异常表达可引起水钠代谢异常,降低机体耐创伤应激能力[6]。另外,本研究还发现,两组患者术后1 d、3 d血清ACTH、Cor、TNF-α水平较术前升高,而Wiltse组低于传统组,可见Wiltse入路腰椎椎体间融合术治疗极外侧腰椎间盘突出症能减少应激反应。此外,行Wiltse入路腰椎椎体间融合术还应注意到术中的关键在于确定多裂肌间隙,术前需借助影像技术对其进行准确识别,以减少手术创伤;在钝性分离肌筋膜时,应充分使用电凝止血,以剥离关节突关节附着肌肉;若肌间隙显露不明显时,避免贸然切开肌肉,以避免肌肉损伤、加大出血量;对于多裂肌间隙的确认,临床可在棘突旁2.5 cm处进行确认等。
综上所述,Wiltse入路腰椎椎体间融合术治疗极外侧腰椎间盘突出症能优化手术相关指标,减少椎旁肌损伤,缓解临床疼痛程度,促进腰椎功能恢复,减少应激反应。
