探讨MiR-181a、TGFβR2对食管癌细胞ECA109的影响*
2022-09-14李雨蔚徐润侯维蹇顺海陈筱莉何欣蓉
李雨蔚,徐润,侯维,蹇顺海,陈筱莉,何欣蓉
1.川北医学院附属医院病理科,四川南充 637000;2.川北医学院病理教研室,四川南充 637000;3.成都市第二人民医院,四川成都 610011
食管癌是人类最常见的恶性肿瘤之一,我国90%的病例为食管鳞状细胞癌,由于食管癌起病隐匿,80%以上患者确诊时已进入中晚期,因此食管癌患者总体生存时间较短,5年生存率低,严重影响人类的健康。TGF-β/Smad信号通路参与许多病理过程,在肿瘤中发挥着特别广泛的作用[1-2]。因此调节TGF-β途径对食管癌患者具有重要意义,TGF-β有三种亚型(TGF-β1、TGF-β2和TGF-β3)和三种相应的TGF-β受体(TGF-βR1、TGF-βR2和TGF-βR3)。前两种受体具有激酶活性,磷酸化并激活TGF-β/Smads途径下游,而TGF-βR3没有激酶活性。在TGF-β信号转导中,TGF-β依次与TGF-βR2和TGF-βR1结合,形成异基因复合物。因此,TGFβR2与TGF-β结合,发挥关键作用,启动信号转导,在多种肿瘤中发现TGFβR2信号异常,影响肿瘤的生物学特性和患者的生存。微小RNA(miRNA)是TGFβR2功能最重要的调节因子之一[3]。miR-181家族,包括miR-181a、miR-181b、miR-181c和miR-181d,是最早在造血细胞中特异表达的miRNA之一。人类miR-181a和miR-181b基因聚集在一起,位于1号染色体(miR-181a-1和miR-181b-1)和9号染色体(miR-181a-2和miR-181b-2)上,研究发现miR-181a在口腔鳞状细胞癌、高级别软骨肉瘤、乳腺癌、胃癌、食管癌等癌中表达均异常[3-8]。利用生物信息学数据库miRBase预测miR-181a的靶基因,其中包括TGFβR2,并且已有学者在胃癌中采用双荧光素酶报告实验检测发现,TGFβR2为miR-181a的靶基因,但在食管癌中miR-181a与TGFβR2的机制目前尚不清楚,本研究将检测与分析miR-181a、TGFβR2在食管鳞状细胞癌ECA109中的表达及其对细胞增殖的影响,并初步探讨可能的机制。
1 材料与方法
1.1 主要试剂和仪器
DMEM/HIGH GLUCOSE培养基购自美国HyClone公司。新生牛血清购自浙江天杭生物科技有限公司。青霉素—链霉素溶液购自武汉博士德生物工程有限公司。0.25%胰酶购自美国Gibco。增强型CCK-8试剂盒购自江苏碧云天生物技有限公司、组织/细胞RNA快速提取试剂盒购自艾德莱生物。All-in-OneTM miRNA qRT-PCR DetectionKit购自GeneCopoeia。mRNA逆转录试剂盒购自Thermo Scientific。Bestar SybrGreen qPCR mastermix购自DBI Bioscieno; RT-PCR引物、 miR-181a mimics、 mimics NC、miR-181a inhibitor、inhibitor NC由生工生物工程(上海)股份有限公司设计。二氧化碳培养箱(美国Thermo Forma Scientific公司)、全波长酶标仪(Thermo)、荧光定量PCR仪(德国Bio.Rad公司)、倒置显微镜(德国Leica)。
1.2 细胞来源和培养
人正常食管上皮细胞株HEEC和人食管鳞癌细胞株ECA-109来源于川北医学院分子生物学研究所。HEEC、ECA109均为贴壁细胞,培养于含体积分数10%新生牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM/HIGH GLUCOSE完全培养基中,在37℃、5%CO2培养箱中培养。
1.3 细胞转染和分组
按5×105个/孔的细胞密度将ECA109接种于六孔板中培养过夜,待细胞密度达40%~50%,按照Lipo6000TM试剂说明书进行转染。分为五组:blank control组、miR-181a mimics转染组、 mimic NC阴性对照组、miR-181a inhibitor转染组、inhibitor NC阴性对照组。转染6 h后用新鲜的完全培养基替换原培养基继续培养48 h。
1.4 CCK8法检测
按每孔8×103个细胞接种于96孔板,每个样本重复5个复孔,于0、12 h、24 h、48 h各时间点每孔加入10μL的增强型CCK-8试剂,用加了完全培养基和10μL的增强型CCK-8试剂但没有加入细胞的孔作为空白对照,继续培养2 h后,在450 nm波长处用酶标仪测定吸光度值。
1.5 qRT-PCR
总RNA的提取使用组织/细胞RNA快速提取试剂盒提取空白对照组及转染后ECA109中的总RNA,检测RNA的纯度及浓度后于-80℃保存(OD260/OD280比值在2.0~2.2之间)。逆转录及qRT-PCR检测miR-181a、TGFβR2mRNA、Smad2mRNA的表达量使用All-in-OneTM miRNA qRT-PCR Detection Kit试剂盒、Thermo Scientific的mRNA逆转录试剂盒将细胞中提取的RNA逆转录成cDNA,反应条件分别为为37℃60 min、85℃5 min,65℃5 min、25℃5 min、42℃60 min、70℃5 min。将得到的cDNA稀释后,按照All-in-OneTM miRNA qRT-PCR Detection Kit试剂盒、Bestar SybrGreen qPCR mastermix说明书分别进行荧光定量PCR,反应条件分别为95℃10 min,1个循环;95℃10sec、60℃20sec、72℃10sec,40个循环和95℃2 min,1个循环;95℃10sec、55℃30sec、72℃30sec,40个循环,以U6和GAPDH作为内参,miR-181a、TGFβR2mRNA表达量用表示。miR-181a正向引物序列5'-GCGGTAACATTCAACGCTGTCG-3',反向引物序列5'-GTGCAGGGTCCGAGGT-3';TGFβR2正向引物序列 5'-GTGGCTGTATGGAGAAAGAATG-3',反向引物序列5'-CAAGTCAGGATTGCTGGTGTT-3';U6正向引物序列5'-CGCTTCGGCAGCACATATA-3',反向引物序列5'-TTCACGAATTTGCGTGTCAT-3';GAPDH 正向引物序列 5'-CATGAGAAGTATGACAACAGCCT-3',反向引物序列5'-AGTCCTTCCACGATACCAAAGT-3'。
1.6 Western Blot
分别收集转染4 d后的各组细胞于离心管中,PMSF裂解提取蛋白,采用Bradford蛋白定量试剂盒测蛋白的浓度,每孔取12μL蛋白质行SDS-PAGE电泳(80 min 100 V),转膜(80 min 0.2 A),5%脱脂牛奶封闭3 h,加入RabbitAnti-TGFβR2(1:300稀释),4℃过夜后加入二抗羊抗兔IgG(1:5 000稀释),室温孵育1 h,采用特超敏ECL化学发光试剂盒显影,以GAPDH作为内参,采用Image J软件分析目的蛋白和内参的光密度值,以目的蛋白和内参的光密度值的比值表示目的蛋白的相对表达水平。
1.7 统计学方法
采用SPSS 23.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CCK8法检测
采用CCK8法检测ECA109细胞中各组在0 h、12 h、24 h、48 h的增殖情况。如表1展示了各组在0 h、12 h、24 h、48 h时的吸光度值,以s表示。图1显示,miR-181a mimics组与空白对照组、mimic NC组相比,在12 h、24 h、48 h吸光度值升高,差异有统计学意义(P<0.05),空白对照组与mimic NC组之间无明显差异。miR-181a inhibitor组与空白对照组、inhibitor NC组相比,在12 h、24 h、48 h吸光度值降低,差异有统计学意义(P<0.05),空白对照组与inhibitor NC组之间无明显差异。
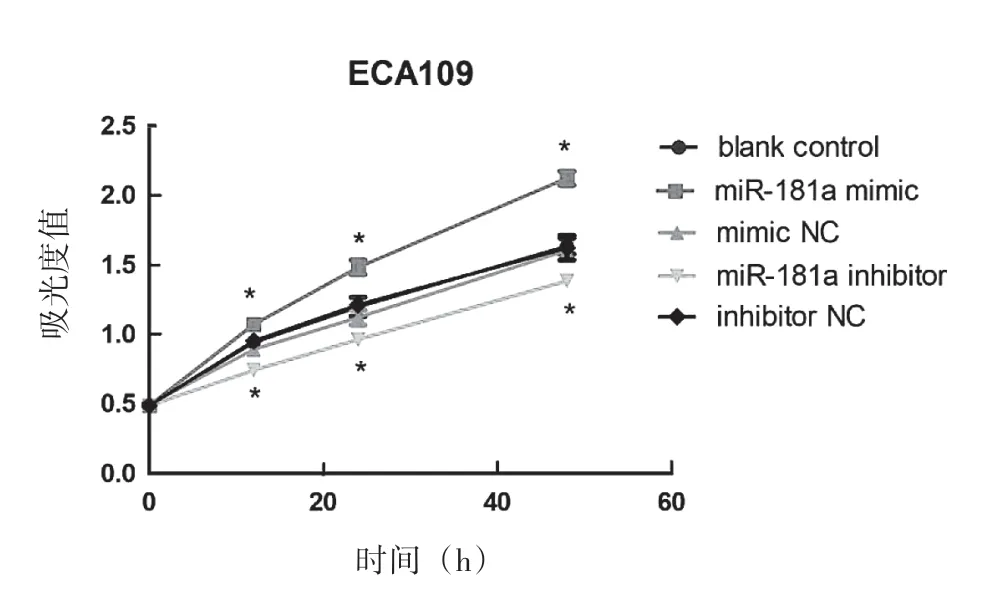
图1 CCK8法检测ECA109五组细胞的增殖水平
表1 转染后ECA109五组细胞增殖能力的比较(±s)
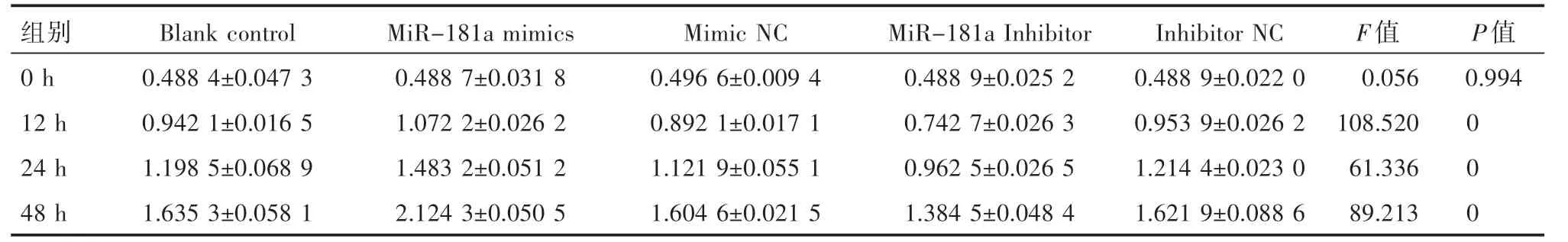
表1 转染后ECA109五组细胞增殖能力的比较(±s)
组别0 h0.488 4±0.047 30.488 7±0.031 80.496 6±0.009 40.488 9±0.025 20.488 9±0.022 00.0560.994 12 h0.942 1±0.016 51.072 2±0.026 20.892 1±0.017 10.742 7±0.026 30.953 9±0.026 2108.5200 24 h1.198 5±0.068 91.483 2±0.051 21.121 9±0.055 10.962 5±0.026 51.214 4±0.023 061.3360 48 h1.635 3±0.058 12.124 3±0.050 51.604 6±0.021 51.384 5±0.048 41.621 9±0.088 689.2130 Blank control MiR-181a mimics Mimic NC MiR-181a Inhibitor Inhibitor NC F值P值
2.2 miR-181a在HEEC、ECA109细胞中的表达情况
如图2所示,qRT-PCR检测结果显示,人正常食管上皮细胞株HEEC,人食管鳞癌细胞株ECA109中miR-181a的表达水平分别为(1.005±0.124)、(3.454±0.197),食管鳞癌细胞株中miR-181a的表达量明显高于人正常食管上皮细胞株的表达量,差异有统计学意义(P<0.05)。
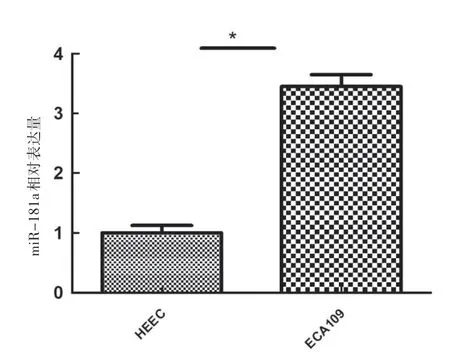
图2 miR-181a在HEEC、ECA109细胞株中的表达情况
2.3 miR-181a在各转染组中的表达情况
如图3a所示,qRT-PCR检测结果显示,ECA109细胞miR-181a mimics转染组miR-181a的表达水平(33.525 3±1.089 7)明显高于空白对照组(1.020 4±0.251 5)、mimic NC组(0.855 9±0.093 0),差异有统计学意义(P<0.001);图3b所示,qRT-PCR检测结果显示,ECA109细胞miR-181a inhibitor转染组miR-181a的表达水平(0.022 1±0.007 6)明显低于空白对照组(1.020 4±0.251 5)、inhibitor NC组(0.955 9±0.309 9),差异有统计学意义(P<0.001)。
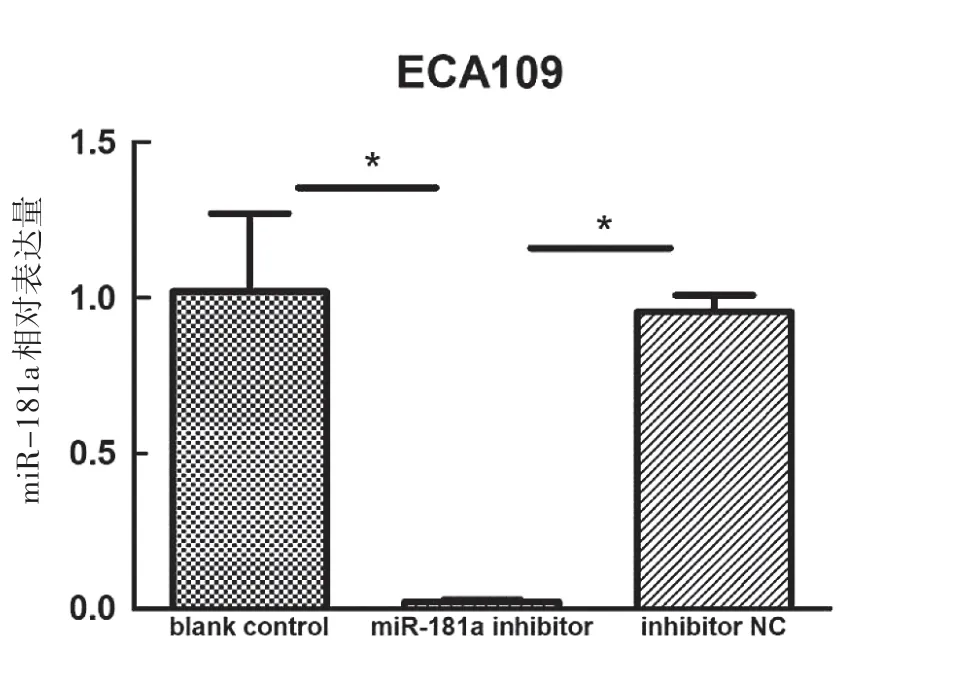
图3b qRT-PCR检测miR-181a inhibitor转染后miR-181a表达
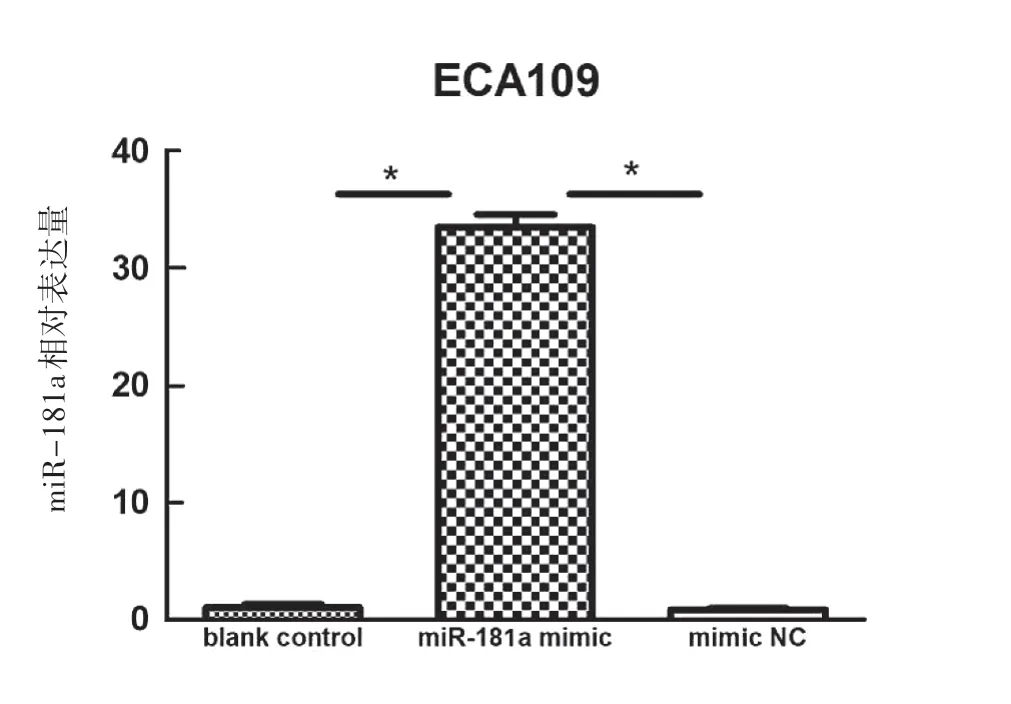
图3a qRT-PCR检测miR-181a mimics转染后miR-181a表达
2.4 TGFβR2在各转染组中的表达情况
如图4a所示,qRT-PCR检测结果显示,ECA109细胞miR-181a mimics转染组TGFβR2mRNA的表达水平(0.466 5±0.037 7)明显低于空白对照组(1.000 8±0.049 2)、mimic NC组(1.052 9±0.098 2),差异有统计学意义(P<0.001)。图4b所示,qRT-PCR检测结果显示,ECA109细胞miR-181a inhibitor转染组TGFβR2mRNA的表达水平(1.606 7±0.062 8)明显高于空白对照组(1.0080±0.049 2)、inhibitor NC组(1.120 7±0.104 8),差异有统计学意义(P<0.001)。如图5、6所示,Western Blot结果显示miR-181a mimics转染组TGFβR2蛋白表达水平较阴性对照组明显下降,差异有统计学意义(P<0.01)。miR-181a inhibitor转染组TGFβR2蛋白表达水平较阴性对照组升高,差异有统计学意义(P<0.05)。
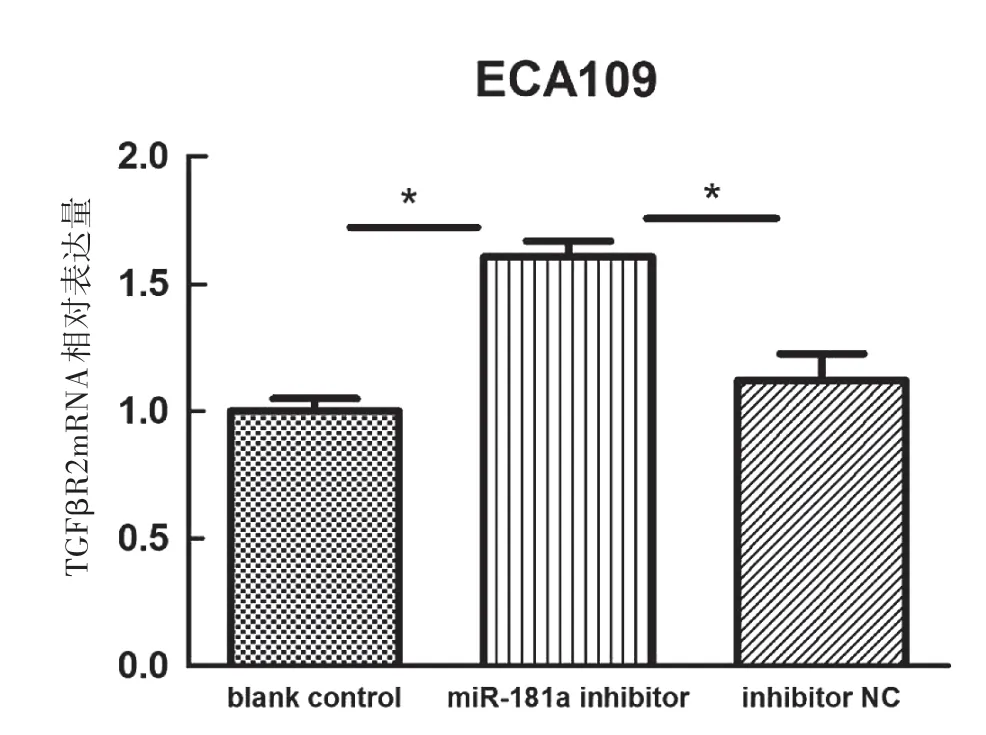
图4b WB检测miR-181amimics转染后TGFβR2蛋白表达
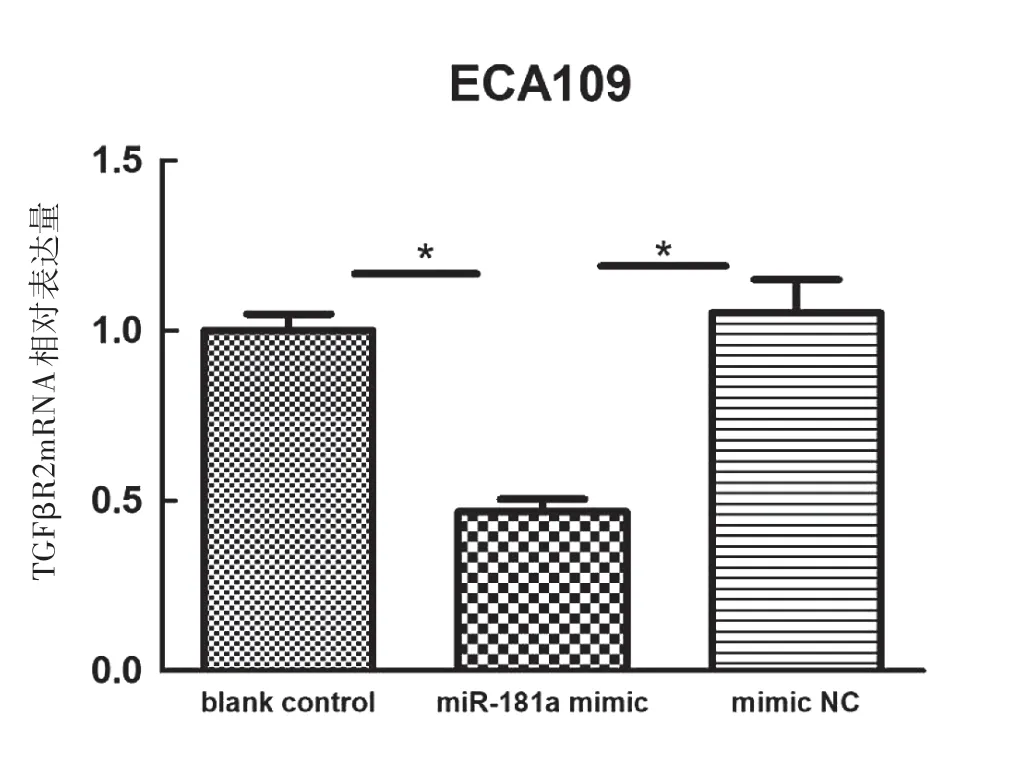
图4a qRT-PCR检测miR-181ainhibitor转染后GFβR2mRNA表达
3 讨论
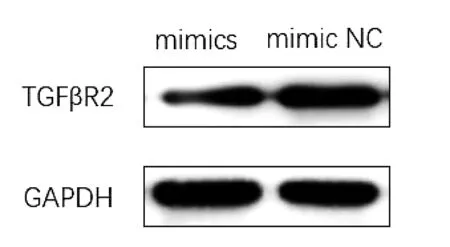
图5a WB检测miR-181amimics转染后TGFβR2蛋白表达
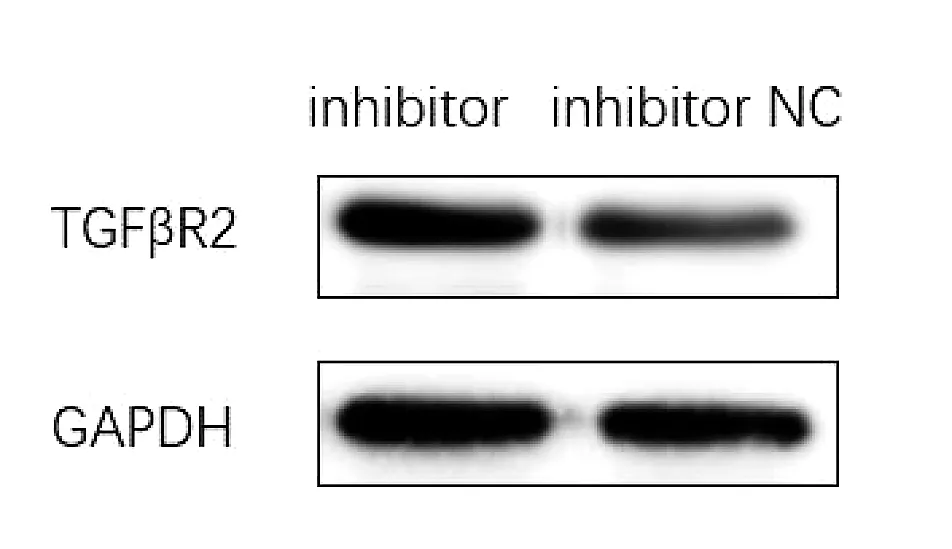
图5b WB检测miR-181a inhibitor转染后TGFβR2蛋白表达
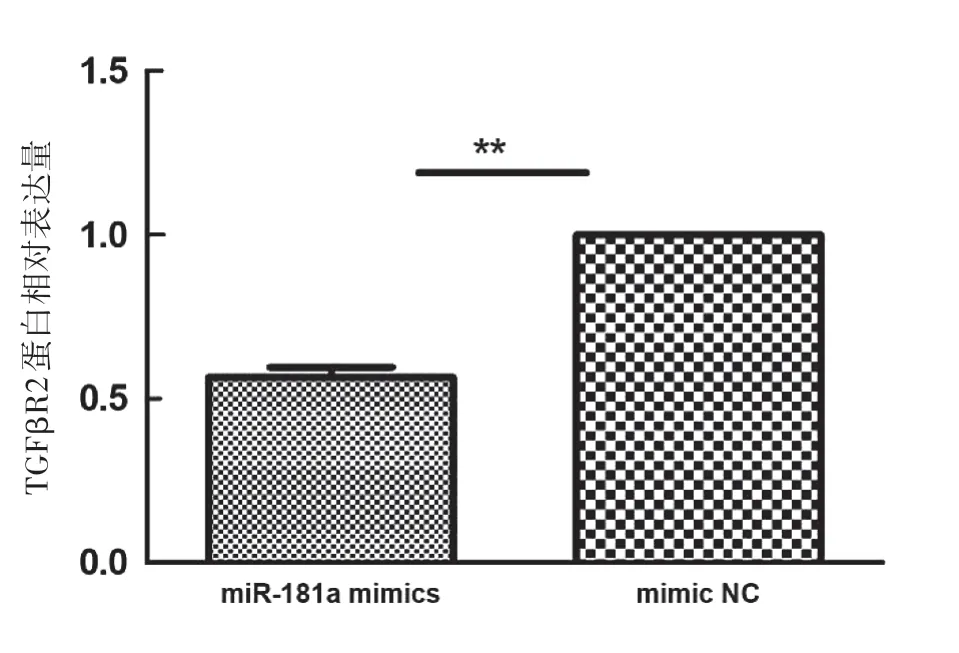
图6a mimics转染组与NC组TGFβR2蛋白相对表达量
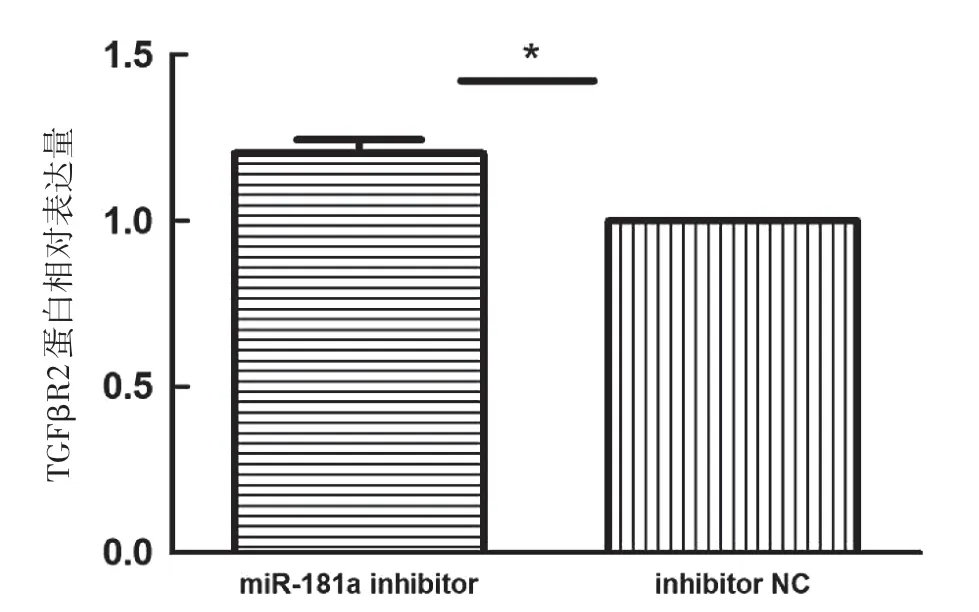
图6b inhibitor转染组与NC组TGFβR2蛋白相对表达量
食管癌是常见的消化道肿瘤之一,在我国癌症死亡原因中排名第四[9]。尽管有包括手术干预、化疗和同时放化疗在内的多模式治疗[10],但治疗效果仍不佳。因此,为了提高晚期食管癌患者的生存率,迫切需要在早期诊断和治疗方面取得进展。在TGF-β信号转导途径中,最重要的受体是TGFβR2,它与TGF-β结合并激活TGF-β信号级联,miRNA是TGFβR2最重要的翻译后调节因子之一。在本研究中采用qRT-PCR检测miR-181a在食管癌细胞ECA109中的表达情况,结果发现miR-181a在食管癌细胞中的表达水平明显高于正常食管上皮细胞。为了进一步研究miR-181a与TGFβR2的关系,本研究将miR-181a mimics、miR-181a inhibitor转染入食管癌细胞ECA109,发现miR-181a mimics组食管癌细胞的增殖能力增强,miR-181a inhibitor增殖能力降低。并通过qRT-PCR、Western Blot检测发现 miR-181a mimics转染组TGFβR2mRNA及其蛋白的表达水平较对照组均明显降低。miR-181a inhibitor转染组TGFβR2mRNA及其蛋白的表达水平较对照组均明显升高。以上结果表明miR-181a在食管癌的发生发展过程中扮演癌基因的作用,并通过影响TGFβR2来促进食管癌细胞的增殖能力。但本研究也存在以下不足之处:首先,本研究未研究TGFβR2表达量的改变是否会影响miR-181a的表达水平。其次,本研究仅在体外实验证实这一现象,今后需要收集更多临床样本,进行体内实验以完善实验数据,并深入探讨食管癌中miR-181a、TGFβR2之间的调控机制。
