PFKFB3在肝癌中的表达水平及对仑伐替尼抗肿瘤活性的影响
2022-09-10刘晓王银中张鹏飞焦同立申萌萌
刘晓,王银中,张鹏飞,焦同立,申萌萌
原发性肝癌的发病率位居我国恶性肿瘤的第4位,致死率位居第2位,其中肝细胞癌(hepatocellular carcinoma,HCC)占85%~90%[1]。仑伐替尼是一种多激酶抑制剂,是晚期HCC的一线治疗药物[2]。靶向治疗药物仑伐替尼能够抑制肿瘤生长和血管生成,从而延缓HCC进展,延长患者生存期[3-4]。然而,仑伐替尼的临床应用在很大程度上受到靶向耐药性的限制[5]。因此,确定HCC对仑伐替尼耐药的分子机制至关重要,有助于提高HCC患者的治疗效果。6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶3(phosphofructokinase-2/fructose-2,6-bisphosphatase,PFKFB3)是糖酵解的有效刺激剂[6]。异常的肿瘤血管可促进肿瘤转移并降低化疗效果,阻断PFKFB3的表达可使血管正常化,减少癌细胞侵袭和血管内转移,从而增强化疗效果[7]。研究显示,阻断PFKFB3的表达后可增强肿瘤对顺铂的敏感性[8]。然而,PFKFB3在HCC中对仑伐替尼耐药是否发挥作用尚不清楚。因此,本研究拟探讨HCC中PFKFB3的表达,观察敲低其表达水平后,HCC对仑伐替尼的敏感性是否受影响,了解HCC对仑伐替尼的耐药机制。
1 对象与方法
1.1 对象 收集2020年8月—2021年6月行手术治疗的HCC患者45例,男性27例,女性18例,年龄(45.6±8.3)岁(32~59岁)。保留患者的HCC组织和癌旁组织,-80 ℃保存。所有患者术前均未接受放化疗。本研究经笔者医院伦理委员会批准(批号:202004125),患者均知情同意。
1.2 方法
1.2.1 主要试剂和材料 HCC细胞系Huh7、MHCC-97H、Hep3B和正常肝细胞L02细胞(中国科学院典藏培养物保型委员会细胞库);RPMI-1640培养基和胎牛血清(北京鼎国昌盛生物技术有限责任公司);si-NC及si-PFKFB3由广州锐博生物技术有限公司完成;Trizol、Lipofectamine 2000(美国Invitrogen 公司);逆转录试剂盒、2×实时PCR预混液(北京天根生化科技有限公司);蛋白提取试剂盒、BCA蛋白定量试剂盒、细胞凋亡检测试剂盒(江苏碧云天技术有限公司);MTT粉末(北京索莱宝公司);PFKFB3 (D7H4Q) 兔单克隆抗体(货号:13123)、β-actin (8H10D10)鼠单克隆抗体(货号:3700)、辣根过氧化物酶标记的抗-鼠IgG抗体(货号:7076)和辣根过氧化物酶标记的抗-兔IgG抗体(货号:7074)(美国Cell Signaling Technology公司)。
si-NC:5’-UUCUCCGAACGUGUCACGUTT-3’
si-PFKFB3:5’-AGCUGCCUGGACAAAACAUG-3’
1.2.2 免疫组织化学染色(immunohistochemical staining,IHC)实验 采用IHC检测HCC组织和癌旁组织中PFKFB3的表达,将组织置于4%多聚甲醛中固定,经石蜡包埋后制备成厚度约4 μm的切片,经脱蜡、水化、渗透和封闭后,滴加PFKFB3 (D7H4Q) Rabbit mAb (1∶200),置于4 ℃冰箱孵育过夜。PBS冲洗,滴加Anti-rabbit IgG,HRP-linked 抗体(1∶400),室温下孵育60 min,PBS冲洗3遍。滴加显色液,置于显微镜下观察。
1.2.3 Western-blot实验 采用Western-blot检测HCC组织中PFKFB3的表达,提取细胞中的总蛋白,BCA蛋白定量取30 μg蛋白,行SDS-PAGE电泳,将蛋白湿转至PVDF膜上。用1% BSA室温封闭2 h、之后经anti-PFKFB3抗体孵育(1∶1 000 稀释,4 ℃孵育过夜)、TBST洗涤3次、二抗孵育(1∶4 000 稀释,室温孵育1 h)、TBST洗涤3次后,在膜上滴加适量化学发光显色液并置于凝胶成像系统中拍照。
1.2.4 细胞转染 配置含有10%胎牛血清的RPMI-1640培养基培养细胞,取对数生长期Hep3B细胞,以每孔5×105个的密度接种于6孔细胞板,分为si-NC组(转染空载质粒)、si-PFKFB3组(转染PFKFB3敲低质粒),每组设置3个平行孔。按照脂质体Lipofectamine 2000的说明书进行操作,转染6 h 后,更换新鲜培养基,继续培养48 h,此时si-NC组细胞称为si-NC细胞、si-PFKFB3组细胞称为si-PFKFB3 细胞。收集si-NC细胞和si-PFKFB3细胞,采用Western-blot检测转染效果。
1.2.5 细胞增殖实验 si-NC组和si-PFKFB3组的细胞以每孔2×103个的密度接种于96孔板中,接种后分别于0、24、48、72 h进行检测。至检测时间点在检测孔中滴加20 μL MTT溶液,孵育4 h。去除上清,每孔加入150 μL二甲基亚砜(DMSO)溶液,震荡5 min使细胞充分裂解,用酶标仪检测570 nm 处细胞的光密度(optical density,OD)值。取对数生长期Hep3B细胞,以每孔5×103个的密度接种于96孔板中,置于恒温箱中孵育24 h,滴加仑伐 替尼,使其终浓度分别为0、5、10、15、20、25 μmol/L。同时设置阴性对照组(DMSO对照)和空白对照组(仅加培养基)。继续孵育48 h,按照以上步骤检测细胞的OD值并计算存活率。si-PFKFB3 细胞和Hep3B细胞接种于96孔板中,将其分为si-PFKFB3组、NC+仑伐替尼组、si-PFKFB3+仑伐替尼组、NC组和阴性对照组,si-PFKFB3 组为接种的si-PFKFB3 细胞、NC+仑伐替尼组为接种的Hep3B细胞并用10 μmol/L仑伐替尼处理、si-PFKFB3+仑伐替尼组为接种的si-PFKFB3 细胞并用10 μmol/L仑伐替尼处理、NC组为接种的Hep3B细胞、阴性对照组为接种Hep3B细胞并用DMSO处理。孵育48 h后,检测每组细胞的OD值并计算细胞存活率。
细胞存活率=1-[(不同浓度处理组-空白对照组)/(阴性对照组-空白对照组)]×100%
1.2.6 细胞凋亡检测 采用Annexin V-FITC和PI双染法检测细胞的凋亡情况。si-PFKFB3和Hep3B细胞以4×105个的密度接种于6孔板中,孵育24 h后,si-PFKFB3组接种的si-PFKFB3细胞不做任何处理、仑伐替尼组为接种的Hep3B细胞并用10 μmol/L仑伐替尼处理、si-PFKFB3+仑伐替尼组为接种的si-PFKFB3细胞并用10 μmol/L仑伐替尼处理,继续培养48 h后收集细胞,分别加入390 μL Annexin V-FITC结合液重悬细胞,再加入5 μL Annexin V-FITC和10 μL PI,轻轻混匀,室温避光,在流式细胞仪上检测细胞凋亡情况。
2 结 果
2.1 HCC组织和癌旁组织中PFKFB3的表达 IHC结果显示,HCC组织中PFKFB3阳性表达率为79.7%(51/64),高于癌旁组织的18.8%(12/64),组间比较差别有统计学意义(χ2=47.543,P<0.001,图1)。
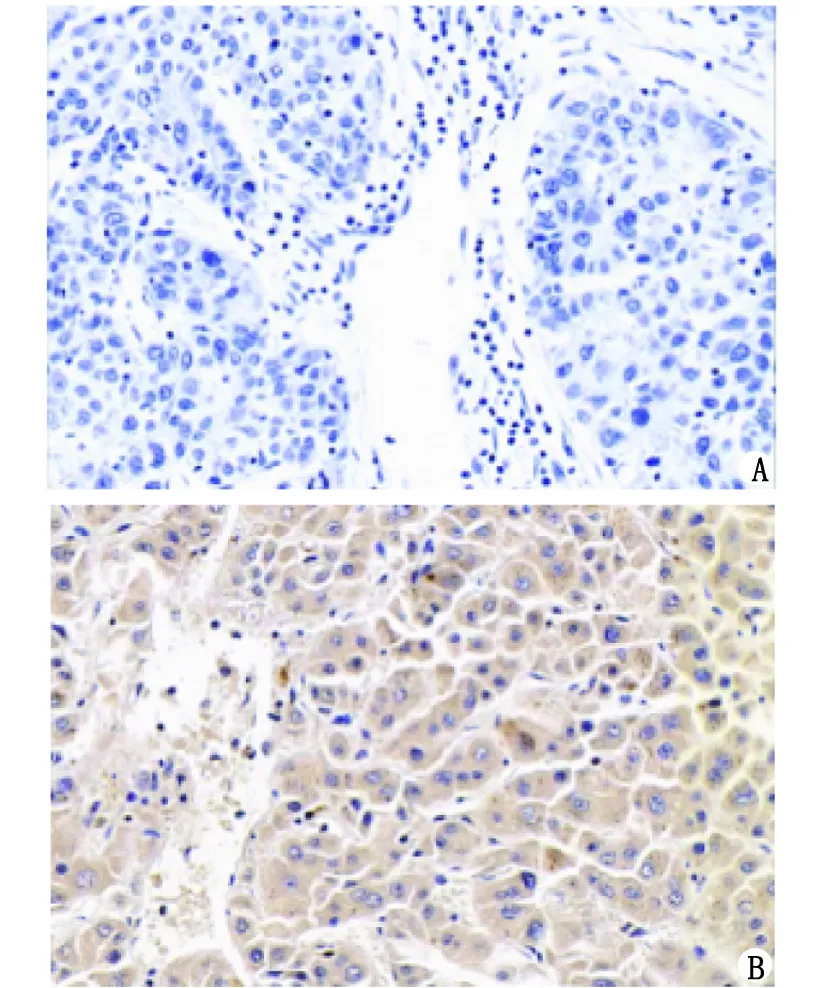
HCC:肝细胞癌;PFKFB3:6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶3。A:肝癌旁组织;B:肝癌组织。图1 HCC组织和癌旁组织中PFKFB3的表达(SP染色 ×400)Fig.1 Expression of PFKFB3 in HCC tissue and para-HCC tissue (SP staining ×400)
2.2 HCC细胞系中PFKFB3的表达 HCC细胞系Huh7、MHCC-97H、Hep3B和正常肝细胞L02中PFKFB3蛋白表达相对灰度值分别为(0.42±0.05)、(0.67±0.11)、(0.95±0.10)和(0.11±0.02),4组间比较差别均有统计学意义(F=4.625,P=0.004),且Hep3B细胞中PFKFB3蛋白相对灰度值的表达水平最高,因此选择Hep3B细胞进行后续实验(图2)。
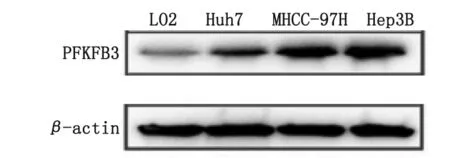
PFKFB3:6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶3;HCC:肝细胞癌。图2 HCC细胞系中PFKFB3的表达Fig.2 Expression of PFKFB3 in HCC cell lines
2.3 敲低Hep3B细胞中PFKFB3的表达对细胞增殖和凋亡的影响 si-PFKFB3组细胞中PFKFB3 mRNA相对表达水平和蛋白相对灰度值分别为(0.24±0.06)和(0.31±0.02),均显著低于si-NC组[(0.86±0.14)和(0.97±0.16),t=9.772、9.125,均为P<0.001]。si-PFKFB3组48、72 h的OD值分别为(0.35±0.09)和(0.42±0.10),均低于si-NC组[(0.68±0.11)和(1.01±0.15),t=4.415、6.351,P<0.001]。si-PFKFB3组细胞凋亡率为(39.12±5.43)%,高于si-NC组的(8.80±0.11)%(t=12.521,P<0.001,图3)。
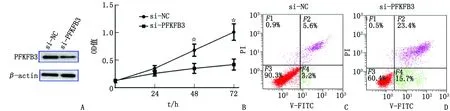
PFKFB3:6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶3。A:si-NC组和si-PFKFB3组PFKFB3蛋白表达;B:si-NC组和si-PFKFB3组细胞OD值;C、D:分别为si-NC组和si-PFKFB3组细胞凋亡率。组间比较,☆:P<0.001。图3 敲低Hep3B细胞中PFKFB3的表达对细胞增殖和凋亡的影响Fig.3 Effects of knockdown of PFKFB3 expression in Hep3B cells on cell proliferation and apoptosis
2.4 敲低Hep3B细胞中PFKFB3后对仑伐替尼抗肿瘤活性的影响 仑伐替尼10 μmol/L时,Hep3B细胞的存活率为(63.34±5.32)%,接近50%,选择此浓度进行后续实验。72 h时si-PFKFB3 组、仑伐替尼组和si-PFKFB3+仑伐替尼组细胞存活率分别为(65.2±5.3)%、(48.3±4.7)%和(6.2±1.4)%,si-PFKFB3+仑伐替尼组细胞存活率低于si-PFKFB3组和仑伐替尼组(t=23.625、16.854,均P<0.001)。si-PFKFB3组、仑伐替尼组和si-PFKFB3+仑伐替尼组细胞凋亡率分别为(34.2±4.9)%、(45.6±5.0)%和(81.9±6.8)%,si-PFKFB3+仑伐替尼组细胞凋亡率高于si-PFKFB3组、仑伐替尼组(t=28.514、21.325,P<0.001,图4)。
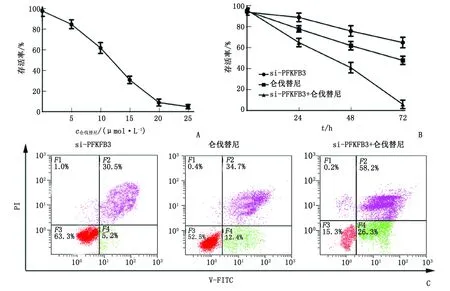
PFKFB3:6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶3。A:仑伐替尼对Hep3B细胞的增殖抑制作用;B:si-PFKFB3组、仑伐替尼组和si-PFKFB3+仑伐替尼组细胞增殖情况;C:si-PFKFB3组、仑伐替尼组和si-PFKFB3+仑伐替尼组细胞凋亡情况。图4 敲低Hep3B细胞中PFKFB3的表达后增强仑伐替尼抗肿瘤活性Fig.4 Knockdown of PFKFB3 in Hep3B cells enhances lenvatinib antitumor activity
3 讨 论
HCC是癌症相关死亡的常见原因,即使进行肝切除和肝移植,其5 a复发率也高达70%[9]。由于缺乏有效的治疗,晚期HCC患者的预后较差,中位总生存期不到1 a。索拉非尼是第一个在晚期HCC中显示出总体生存获益的全身治疗药物,并被批准为晚期HCC患者的一线治疗药物[10]。索拉非尼的临床应用成功,增加了人们对HCC新药开发的兴趣。然而在随机对照Ⅲ期试验中,许多一线药物(如利尼伐尼[11]、舒尼替尼[12]、厄洛替尼[13]、布立尼布[14])和二线药物(如依维莫司[15])在HCC治疗中失败。仑伐替尼是一种酪氨酸激酶抑制剂,在Ⅲ期REFLECT 临床试验中,对未经治疗的晚期HCC患者的总生存期的改善不逊于索拉非尼,并被推荐为治疗晚期HCC的另一种一线药物[16]。尽管仑伐替尼对晚期HCC的客观缓解率有显著益处,但这种益处并不能持续,部分接受仑伐替尼治疗的晚期HCC患者出现耐药性,这一现象促使临床医生探索仑伐替尼耐药的潜在机制。因此,探讨增强HCC对仑伐替尼的敏感性、降低耐药发生的可能机制,具有重要的临床价值。
本研究首先检测到HCC组织中PFKFB3的表达水平增加,在HCC细胞中依然检测到PFKFB3呈高表达的状态。为探索PFKFB3在HCC细胞中可能的作用,笔者利用转染技术将Hep3B细胞中PFKFB3水平敲低,发现细胞的增殖能力减弱,凋亡的细胞增加,推测PFKFB3在HCC中可能具有促瘤作用。有氧糖酵解可消耗葡萄糖并引起乳酸堆积,肿瘤中的乳酸堆积可致糖酵解限速酶磷酸果糖激酶-1的表达增加,促进癌细胞的转移,另外糖酵解的其他产物亦可驱动肿瘤细胞的生长[17]。PFKFB3是糖酵解过程中的关键限速酶,在多种癌症中高表达[18-20]。研究显示,阻断PFKFB3后可减少病理性血管生成,促进正常血管的形成和降低糖酵解,从而改善化疗药的递送和疗效[21-22]。CANTELMO 等[23]研究显示,在肿瘤内皮细胞中表现出高糖酵解代谢,阻断PFKFB3后可减弱肿瘤细胞的迁移、侵袭,并提高肿瘤细胞对化疗药物的敏感性。而减弱HCC细胞中PFKFB3的表达是否可增强细胞对仑伐替尼的敏感性,继而进行了以下研究。
首先确定仑伐替尼作用于Hep3B细胞的IC50接近于10 μmol/L,选择这个浓度对Hep3B细胞进行处理。si-PFKFB3+仑伐替尼组细胞存活率为(6.2±1.4)%,显著低于si-PFKFB3组和仑伐替尼组。另外,凋亡实验显示,si-PFKFB3+仑伐替尼组凋亡率显著高于si-PFKFB3组和仑伐替尼组,提示降低Hep3B细胞中PFKFB3的表达,可增强Hep3B细胞对仑伐替尼的敏感性。HCC中的缺氧通过产生血管内皮生长因子(vascular endothelial growth factor,VEGF)的过程和激活缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)来驱动血管生成。因此,仑伐替尼因通过阻断HIF-1α/VEGF通路发挥抗血管生成作用。持续仑伐替尼治疗会抑制肿瘤的抗血管生成活性和随后的肿瘤内缺氧,有利于选择耐药细胞克隆以适应氧气和营养不足,从而限制了仑伐替尼的疗效[5]。MATSUKI等[24]研究报道,靶向肿瘤成纤维生长因子和抗血管生成活性是仑伐替尼抗HCC肿瘤活性的基础。因此,降低Hep3B细胞中PFKFB3的表达,增强对仑伐替尼的敏感性,是否跟成纤维生长因子或血管生成有关,可作为后续研究的方向。
综上所述,HCC组织和细胞中PFKFB3的表达水平增加,降低PFKFB3的表达可增强Hep3B细胞对仑伐替尼的敏感性。
