甘草次酸减轻放射性皮肤纤维化的作用机制
2022-09-10苏丽潘晓娴王彩虹洪金省王锃
苏丽,潘晓娴,王彩虹,洪金省,王锃
放射治疗是抗肿瘤治疗的主要手段之一。皮肤是放疗外照射的必经途径,因此放射性皮肤损伤不可避免。损伤的早期轻者表现为脱毛、可逆的急性皮炎,重者可出现软组织溃疡或坏死,后期可进一步发展为放射性纤维化。辐射引起的皮肤纤维化是永久性的、进行性的、不可逆的,对放疗的实施、器官功能和患者的生活质量均有严重影响[1-2]。目前尚无治疗放射性皮肤纤维化的特效药物[3]。
放射性纤维化的形成与发展是一个复杂的动态变化的过程,电离辐射诱导皮肤组织损伤后,启动了相关的免疫损伤修复。成纤维细胞(fibroblast,FB)激活并转化为肌纤维母细胞(myofibroblast,MFB),过多的 MFBs 分泌大量Ⅰ型胶原(type Ⅰ collagen,ColⅠ)[4],导致细胞外基质(extracellular matrix,ECM)过度沉积、基质硬化,表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等导致组织过度收缩、顺应性下降,最终导致纤维化。FB的活化在纤维化发展过程中发挥了关键性作用[5],抑制FB的活化是治疗放射性皮肤纤维化的重点。
18β-甘草次酸(18β-glycyrrhetinic acid,18β-GA)是甘草酸的生物活性代谢物,是由甘草酸水解脱去糖酸链而形成的功能性产物,具有抗炎、抗氧化、免疫调节和抗纤维化等多种药理作用[6]。课题组前期研究[7]发现,18β-GA可以抑制辐射诱导的细胞内活性氧(reactive oxygen species,ROS)升高,抑制皮肤急性损伤期许多致炎细胞因子和趋化因子升高,显示出抗炎和抗氧化能力,具有减轻急性放射性皮炎的作用。然而,18β-GA对放射性皮肤纤维化的作用仍有待进一步研究。因此,本研究通过构建放射性皮肤纤维化的细胞和动物模型,探讨18β-GA减轻放射性皮肤纤维化的作用及其机制,为临床上放射性皮肤损伤的防治提供新的治疗策略。
1 材料与方法
1.1 材料 直线加速器(Clinac 600C/D,美国Varian医疗系统公司),BCA 蛋白浓度测定试剂盒(P0012,中国碧云天生物技术有限公司),ColⅠ(C3867,美国Sigma-Aldrich公司),抗纤维连接蛋白(fibronectin,FN)抗体(A12932,武汉爱博泰克生物科技有限公司)、抗ColⅠ抗体(A1352,武汉爱博泰克生物科技有限公司)、抗-α-SMA抗体(A7248,武汉爱博泰克生物科技有限公司)、抗-β-actin抗体(AC026,武汉爱博泰克生物科技有限公司)、10% 新生牛血清(SH30413,美国HyClone公司)、RIPA裂解缓冲液(P0013C,中国碧云天生物技术有限公司)、TRITC标记山羊抗兔IgG(H&L)二抗(ab6792,英国Abcam公司)。小鼠胚胎成纤维细胞(NIH 3T3)[中国科学院细胞库(上海)]。
1.2 方法
1.2.1 动物分组及照射 8周龄SPF级雌性ICR小鼠,体质量25~30 g [上海斯莱克动物有限公司,许可证号:SCXK(沪)2007-0005]。将小鼠随机分为4组:正常对照组(Control),照射组(IR),IR+GA组,IR+生理盐水(NS)组。每组10只,每笼5只。其中,IR组、IR+GA组和IR+NS组小鼠背部皮肤接受6 MV X射线单次35 Gy照射,源皮距为 100 cm,剂量率为5 Gy/min,照射的区域和具体的方法参考文献[8]。IR+GA组小鼠在照射前接受18β-GA单次灌胃(25 mg/kg),照射后继续灌胃(25 mg/kg)处理,每周3次。IR+NS组小鼠照射后给予IR+GA组小鼠相同体积的生理盐水。假照射小鼠被放置在相同的房间同等时间,作为正常对照组。照射后第10周处死小鼠,取皮肤组织进行进一步分析。
1.2.2 苏木精-伊红(hematoxylin-eosin staining,H-E)染色及免疫组织化学染色 4%多聚甲醛溶液固定小鼠皮肤组织,石蜡包埋,连续0.4 μm切片,采用H-E染色和Masson三色染色法进行染色。免疫组织化学染色时,皮肤组织用抗α-SMA(1∶1 000)一抗室温孵育2 h,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤后,切片与辣根过氧化酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗在室温下孵育 30 min。用PBS洗涤 3 次后,滴加链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)室温孵育 30 min,PBS洗涤 3 次。将载玻片与二氨基联苯胺(diaminobenzidine,DAB)反应 3 min,苏木精复染 2 min后脱水、封片。
1.2.3 细胞培养、照射及分组 使用含10%新生牛血清的高糖DMEM培养基培养小鼠胚胎NIH 3T3细胞。根据不同处理将细胞分为4组:Control组,IR组,IR+GA组,IR+二甲基亚砜(dimethyl sulfoxide,DMSO)组。IR组、IR+GA组和IR+DMSO组均给予单次6 Gy的照射(6 MV X射线,射野角度180°,单野照射;剂量率,2 Gy/min;源皮距,100 cm),培养皿下方垫1 cm的组织补偿物。IR+GA组在照射前使用18β-GA(20 μmol/L)预处理24 h。IR+DMSO组作为溶剂对照组,在照射前使用与IR+GA组相同体积的DMSO预处理同等时间。
1.2.4 细胞免疫荧光染色 无菌条件下在12孔板内放置圆形直径20 mm的细胞爬片。细胞照射后继续培养72 h,用PBS短暂冲洗3次,4%多聚甲醛固定15 min,正常山羊血清37 ℃下封闭1 h,加入抗α-SMA抗体,4 ℃孵育过夜,采用TRITC标记的山羊抗兔IgG二抗孵育1.5 h,再使用PBS洗涤细胞,室温下4’,6-二脒基-2-苯基吲哚(4’,6-Diamidino-2’-phenylindole,DAPI)染色5 min。共聚焦荧光显微镜下观察免疫荧光结果。
1.2.5 Western-blot检测蛋白表达 用RIPA裂解缓冲液制备小鼠皮肤组织和细胞的蛋白质样品。使用BCA蛋白定量试剂盒测定蛋白浓度。严格按照Western-blot标准检测FN、ColⅠ、α-SMA蛋白表达。
1.2.6 胶原凝胶收缩活动 NIH 3T3细胞照射前使用18β-GA预处理24 h后,给予单次6 Gy X射线照射,将1×105mL-1细胞与ColⅠ混合,使ColⅠ 的终浓度为1 mg/mL,培养72 h后,采用ImmunoSpot 系统拍摄凝胶收缩图像,通过Image J软件进行凝胶收缩程度的定量分析。
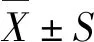
2 结 果
2.1 18β-GA对小鼠放射性皮肤纤维化的作用
2.1.1 小鼠背部皮肤组织的病理变化及 α-SMA 的表达 照射后第10周,小鼠背部皮肤出现明显的纤维化特征,皮肤组织结构紊乱,表皮增厚,真皮层厚度显著增加,胶原纤维增厚增多,纤维排列紧密,间隙缩小。真皮的毛囊结构明显被破坏或消失。皮脂腺、汗腺明显减少甚至消失,脂肪层变薄或消失。与IR组比较,IR+GA组小鼠病理改变明显改善,皮肤真皮层变薄,胶原纤维数量明显减少,炎症细胞浸润减少,毛囊、皮脂腺、汗腺受损情况减轻。Masson 染色显示,与正常组织比较,照射后小鼠皮肤胶原沉积显著,18β-GA可以减少真皮胶原沉积。免疫组织化学显示,照射后小鼠皮肤组织内α-SMA的表达增加,给予GA处理后辐射诱导的α-SMA的表达增加被抑制(图1)。
Control:正常对照;IR:照射;GA:18β-甘草次酸;NS:生理盐水;H-E染色:苏木精-伊红染色;Masson:马松染色;α-SMA:α-平滑肌肌动蛋白。图1 小鼠背部皮肤组织照射后第10周的病理变化( ×200)Fig.1 Pathological changes of dorsal skin tissue of mice at 10 weeks after irradiation ( ×200)
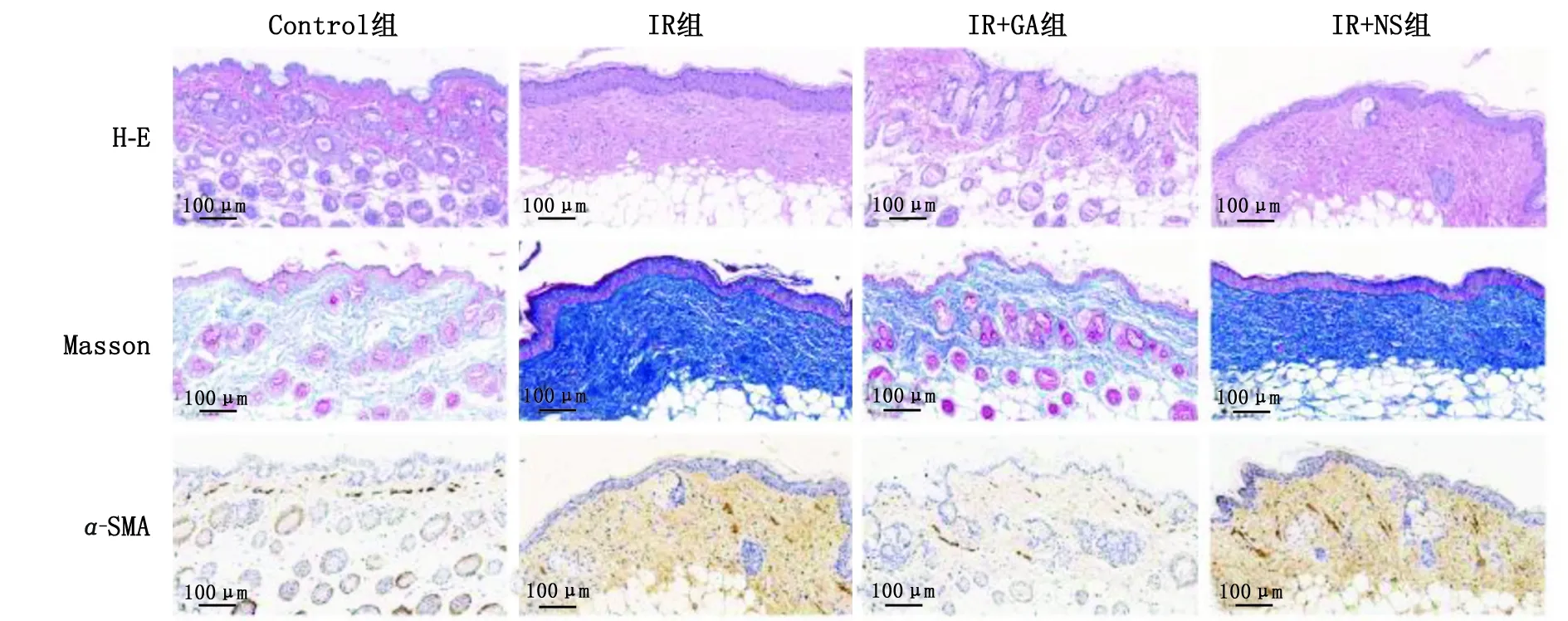
2.1.2 18β-GA对照射后小鼠皮肤组织中FN、ColⅠ和α-SMA蛋白表达的影响 X射线照射后,小鼠皮肤组织中FN、ColⅠ和α-SMA表达水平升高;18β-GA 处理后,X射线诱导的α-SMA、ColⅠ和FN的表达水平下降(图2)。

Control:正常对照;IR:照射;GA:18β-甘草次酸;NS:生理盐水;α-SMA:α-平滑肌肌动蛋白;Collagen Ⅰ:Ⅰ型胶原;Fibronectin:纤维连接蛋白。A:Western-blot检测各组小鼠皮肤组织中Fibronectin、Collagen Ⅰ和α-SMA的表达;B:Fibronectin蛋白相对表达量;C:Collagen Ⅰ蛋白相对表达量;D:α-SMA蛋白相对表达量。与Control组比较,#:P<0.05;与IR组比较,△:P<0.05。图2 各组小鼠皮肤组织中Fibronectin、Collagen Ⅰ和α-SMA蛋白的表达Fig.2 Fibronectin,Collagen Ⅰ and α-SMA protein expression in skin tissues of each groups of mice
2.2 IR诱导NIH 3T3活化 与未照射细胞(0 Gy)比较,4、6、8 Gy照射后,细胞内FN、ColⅠ和α-SMA 的表达均增加,差别有统计学意义(P<0.05,图3)。NIH 3T3细胞接受6 Gy X射线照射,分别于照射后24、36、48和72 h检测细胞内FN、ColⅠ和α-SMA 表达,结果显示:照射后72 h细胞内FN、ColⅠ和α-SMA的表达水平较未照射时明显升高,差别有统计学意义(P<0.05,图3)。

NIH 3T3:小鼠胚胎成纤维细胞;α-SMA:α-平滑肌肌动蛋白。A:Western-blot检测接受不同剂量 X 射线照射后的NIH 3T3细胞内Fibronectin、Collagen Ⅰ和α-SMA的表达;B:不同剂量 X 射线照射后的NIH 3T3细胞内Fibronectin蛋白相对表达量;C:不同剂量 X 射线照射后的NIH 3T3细胞内Collagen Ⅰ蛋白相对表达量;D:不同剂量X射线照射后的NIH 3T3细胞内α-SMA蛋白相对表达量;E:Western-blot检测6 Gy X射线照射后不同时间的NIH 3T3 细胞内Fibronectin、Collagen Ⅰ和α-SMA的表达;F:NIH 3T3细胞照射后不同时间Fibronectin蛋白相对表达量;G:NIH 3T3细胞照射后不同时间Collagen Ⅰ蛋白相对表达量;H:NIH 3T3 细胞照射后不同时间α-SMA 蛋白相对表达量。与对照组比较,#:P<0.05。图3 NIH 3T3细胞接受不同照射剂量和照射后不同时间Fibronectin、Collagen Ⅰ和α-SMA的表达Fig.3 Expression of Fibronectin,Collagen Ⅰ and α-SMA in NIH 3T3 cells exposed to different doses of irradiation and at different times after irradiation
2.3 18β-GA对IR诱导的NIH 3T3活化的影响
2.3.1 Western-blot检测细胞内α-SMA蛋白表达 照射后细胞内FN和α-SMA蛋白表达增加。与IR组比较,使用18β-GA(20 μmol/L)处理后,照射后NIH 3T3细胞内FN和α-SMA的表达下降,差别有统计学意义(P<0.05,图4)。
Control:正常对照;IR:照射;GA:18β-甘草次酸;DMSO:二甲基亚砜;α-SMA:α-平滑肌肌动蛋白;NIH 3T3:小鼠胚胎成纤维细胞。A:Western-blot检测各组细胞中Fibronectin和α-SMA 表达;B:Fibronectin蛋白相对表达量;C:α-SMA蛋白相对表达量。与Control组比较,#:P<0.05;与IR组比较,△:P<0.05。图4 各组NIH 3T3细胞Fibronectin和α-SMA的蛋白表达Fig.4 Protein expression of Fibronectin and α-SMA in each group of NIH 3T3 cells
2.3.2 免疫荧光检测细胞内α-SMA表达 免疫荧光结果显示,辐射可诱导 NIH 3T3细胞大量表达α-SMA。与IR组比较,IR+GA组的平均荧光强度低于IR组,即α-SMA的表达减少,差别有统计学意义(P<0.05,图5)。

Control:正常对照;IR:照射;GA:18β-甘草次酸;DMSO:二甲基亚砜;NIH 3T3:小鼠胚胎成纤维细胞;α-SMA:α-平滑肌肌动蛋白。A:各组NIH 3T3细胞的α-SMA免疫荧光染色(×200);B:各组细胞α-SMA的平均荧光强度比较。与Control组比较,#:P<0.05;与IR组比较,△:P<0.05。图5 各组NIH 3T3细胞α-SMA的免疫荧光染色及荧光强度比较Fig.5 Comparison of immunofluorescence staining and fluorescence intensity of α-SMA in each group of NIH 3T3 cells
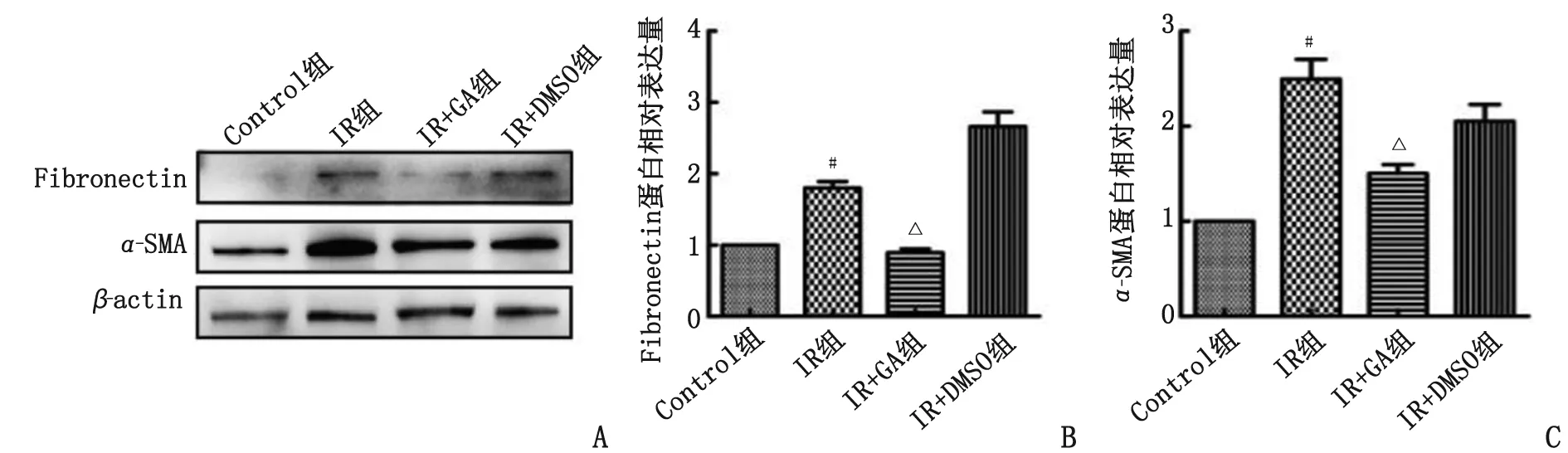
2.3.3 胶原凝胶收缩试验 与Control组比较,IR组的相对凝胶面积缩小;与IR组比较,IR+GA组的相对凝胶面积增大(P<0.05,图6)。
Control:正常对照;IR:照射;GA:18β-甘草次酸;DMSO:二甲基亚砜;NIH 3T3:小鼠胚胎成纤维细胞。A:凝胶收缩实验检测各组NIH 3T3细胞的收缩活性;B:各组NIH 3T3细胞相对凝胶面积百分比。与Control组比较,#:P<0.05;与IR组比较,△:P<0.05。图6 各组NIH 3T3细胞的收缩活性比较Fig.6 The contractile activity of NIH 3T3 cells in each group
3 讨 论
真皮纤维化是电离辐射导致皮肤损伤的最终形式,是进行性和不可逆的,目前仍没有特效药物治疗。因此,研究放射性皮肤纤维化的分子机制,寻找有效的治疗药物具有重要的意义。已有研究[9-11]证实,18β-GA除了具有抗氧化和抗炎作用外,还具有抗肝纤维化及肺纤维化的作用。课题组前期的研究[7]表明,18β-GA具有减轻急性放射性皮炎的作用,但其是否具有抗皮肤纤维化的作用尚不明确。
本研究使用照射小鼠背部皮肤的方式构建放射性皮肤纤维化模型[12],与照射小鼠腿部构建的方式[7]比较,这种方式具有以下优势:(1)构建模型方便,不需要对小鼠腿部进行拉扯和固定。(2)避免了对重要器官和内脏造成的放射损伤。由于在模型中使用的单次照射剂量较大(35 Gy),在腿部照射的方式中,照射野的微小偏移或小鼠的轻微挪动都有可能造成小鼠肠道组织接受大剂量射线照射,从而导致小鼠的意外死亡。(3)照射区域较大,方便观察放射损伤和后续分子实验取材。此外,为成功地开发一种损伤模型,模拟在治疗过程中发生在人体皮肤上的组织学和分子变化,必须确定不会造成严重急性皮肤损伤的辐射剂量。既往一些放射性皮肤纤维化的研究[13-14],采用40~50 Gy 照射,可能剂量过高。CHANG等[12]的研究通过比较15~50 Gy 照射后的小鼠皮肤组织学、分子变化(TGF-β、Wnt、β-catenin水平),发现40和50 Gy照射早在第 2 周就造成溃疡等比较严重的皮肤损伤,而较低的放射剂量可以诱导皮肤纤维化且减少不必要的严重急性皮肤损伤,可以更好地模拟发生在人类身上的慢性损伤模式。故本研究使用单次 35 Gy的剂量进行照射。
电离辐射诱导皮肤组织损伤后,启动了相关的免疫损伤修复。FB被激活后会转化为MFB,其标记物α-SMA能促进瘢痕收缩,导致放射性皮肤纤维化的发生,所以可用α-SMA的表达量来表征细胞纤维化程度[15-16]。FN是ECM和基底膜中的主要非胶原性糖蛋白。在纤维化过程中,FB及炎症细胞在FN的作用下不断被募集、分化、增生,大量生成胶原纤维,导致ECM过度沉积,加快纤维化进程,它可作为ECM合成的检测指标。ColⅠ是皮肤纤维化的物质基础,其合成贯穿于整个纤维化形成过程,是纤维化皮肤有别于正常皮肤的重要病理标志。本研究发现:NIH 3T3细胞接受6 Gy X射线照射后48 h内,FN、ColⅠ和α-SMA的表达水平未出现明显升高,部分指标(FN和α-SMA)的表达甚至出现下降的趋势,直到照射后72 h才出现明显升高,标志着FB的活化。本研究结果很好地印证了辐射诱导FB活化的理论,即在受到辐射的早期,FB出现放射损伤的特征,主要表现为细胞活性下降,凋亡比例升高,胞内ROS升高等[17];之后随着细胞分泌促修复的因子如TGF-β等,FB才开始表现出活化的特征,驱动纤维化[18]。所以,在辐射诱导的纤维化研究中,细胞模型在接受照射后,应该推迟取样或检测的时间点(≥72 h),这样更有利于观察辐射诱导的纤维化特征,而不是放射造成的细胞损伤。
既往研究[9-10]表明,GA 在纤维化疾病中起抑制作用。GA可抑制肝星状细胞α-SMA 表达和胶原纤维的合成,下调Ⅰ型和Ⅲ型前胶原的mRNA表达,减少Ⅰ型和Ⅲ型胶原蛋白的沉积而减轻肝纤维化[19]。GA衍生物可以降低TGF-β1刺激的A549细胞内ColⅠ和α-SMA的表达水平,改善小鼠肺部炎症和纤维化程度[20]。此外,GA可以抑制TGF-β1/Smads信号通路的激活,降低肺组织中TGF-β1、Smad2和Smad3的表达而减轻放射性肺损伤[21]。本研究也发现,18β-GA显著抑制辐射诱导小鼠皮肤纤维化的程度,维持皮肤组织结构,减少皮肤胶原沉积,抑制FN、ColⅠ和α-SMA的表达。此外,18β-GA可以抑制辐射诱导的NIH 3T3细胞内FN、ColⅠ和α-SMA的表达,减少细胞收缩。这说明18β-GA能够抑制电离辐射诱导的FB激活、抑制胶原合成、抑制ECM FN的合成分泌,从而发挥减轻放射性皮肤纤维化的作用。由于FB活化后向MFB转化主要受TGF-β信号通路调控[22],所以GA抑制FB活化的作用是否与抑制TGF-β信号通路有关,还需后续实验进一步探讨。
综上所述,18β-GA具有减轻小鼠放射性皮肤纤维化的作用,可能与抑制FB活化有关,但具体作用调节机制尚不清楚,有待更深入的研究,以期能为放射性皮肤纤维化的发生机制和干预措施提供新思路。
