乳腺乳头状肿瘤冰冻切片误诊和延迟诊断的回顾性分析
2022-09-10刘芸黄智勇邹宗楷
刘芸,黄智勇,邹宗楷
1891年,冰冻切片(冰冻)诊断被首次尝试用于乳腺肿瘤的术中定性[1],并随着技术的进步,逐渐成为可信赖的术中诊断方法。目前,国外由于乳腺细针穿刺活检和空芯针穿刺活检的广泛应用,术中送检乳腺病变组织要求定性的病例已明显减少;但国内乳腺病变的定性仍主要依靠术中冰冻。乳腺乳头状肿瘤是包括一系列从良性病变到恶性病变的疾病谱系,是业内公认的诊断难点,尤其在术中冰冻诊断时。本研究通过收集乳腺乳头状肿瘤的冰冻病例,统计其冰冻确诊符合率及延迟诊断率,并比较良恶性病变冰冻误诊及延迟诊断的差异,归纳其形态学特点,探讨冰冻误诊及延迟诊断的主要原因或诊断陷阱,总结诊断线索、提出应对措施,以期提高该类肿瘤冰冻确诊符合率,降低误诊率、延迟诊断率,为外科医生制定手术方案提供更精确的依据。
1 对象与方法
1.1 对象 收集2017年4月11日—2021年 1月8日漳州市医院病理科石蜡及冰冻均诊断为乳腺乳头状肿瘤、且冰冻以此为主要病变的病例273例,均为女性,年龄中位数47岁(22~83岁)。
1.2 方法 术中送检的乳腺组织均经过肉眼仔细观察并详细记录;根据病变大小酌情取材1~2块组织块,应用德国莱卡CM1950恒温冷冻切片机进行冰冻切片,而后进行苏木精-伊红(hematoxylin-eosin,H-E)染色。冰冻切片均由两位病理医师在收到组织后30 min内完成诊断。冰冻剩余组织和再取组织经10%中性福尔马林固定液固定,石蜡包埋、制片、H-E染色,并挑选合适蜡块,使用罗氏全自动免疫组织化学(组化)染色仪[BenchMark ULTRA/ISH Staining Module]进行免疫组化染色;显微镜下观察H-E切片的组织学形态及免疫组化染色表达情况。
1.3 判断标准 根据肿瘤国际分类编码,将导管内乳头状瘤、导管内乳头状瘤伴导管上皮普通型增生(usual ductal hyperplasia,UDH)、导管内乳头状瘤伴导管上皮不典型增生(atypical ductal hyperplasia,ADH)归入良性病变,将导管内乳头状瘤伴导管内癌(ductal carcinoma in situ,DCIS)、导管内乳头状癌(intraductal papillary carcinoma,IPC)、包裹性乳头状癌(encapsulated papillary carcinoma,EPC)、实性乳头状癌(solid papillary carcinoma,SPC)、原位癌伴微浸润、原位癌伴浸润性癌归入恶性病变。
查阅所有病历资料并重新阅读所有切片,根据冰冻诊断结果对手术方式的影响[2],以石蜡诊断作为金标准,将冰冻与石蜡诊断结果进行对照分析,评价指标如下。(1)确诊。冰冻与石蜡诊断完全符合或基本符合,完全符合指两种诊断方式在肿瘤性质、类型结果方面完全相同,基本符合指两种诊断方式的肿瘤性质结果相同,类型有所区别。确诊符合率=(真阳性例数+真阴性例数)/总例数。(2)误诊。包括假阴性与假阳性,假阴性指石蜡诊断为恶性病变而冰冻诊断为良性病变。假阳性指石蜡诊断为良性病变而冰冻诊断为恶性病变。(3)延迟诊断。冰冻未能明确诊断,需等待石蜡诊断结果。
假阴性率=n假阴性/(n假阴性+n真阳性)×100%
假阳性率=n假阳性/(n假阳性+n真阴性)×100%
延迟诊断率=n延迟诊断/n总×100%
1.4 统计学处理 采用SPSS 21.0软件进行数据分析,良恶性病变的确诊符合率及延迟诊断率的比较采用χ2检验。P<0.05为差别有统计学意义。
2 结 果
2.1 冰冻诊断结果的各项评价指标情况 273例中,冰冻确诊242例(88.6%),延迟诊断21例(7.7%);其中石蜡诊断良性病变226例,冰冻确诊221例(97.8%),假阳性1例(0.5%),延迟诊断4例(1.8%);石蜡诊断恶性病变47例,冰冻确诊21例(44.7%),假阴性9例(33.3%),延迟诊断17例(36.2%)。
2.2 良恶性病变冰冻的确诊符合率和延迟诊断率比较 恶性病变冰冻的确诊符合率(44.7%)明显低于良性病变(97.8%),前者的延迟诊断率(36.2%)明显高于后者(1.8%),两者比较,差别有统计学意义(P<0.05)。
2.3 冰冻误诊及延迟诊断病例的分布情况 石蜡诊断为导管内乳头状瘤伴低级别DCIS病例中,1例冰冻误诊为导管内乳头状瘤伴UDH,3例延迟诊断。导管内乳头状瘤伴中级别DCIS病例中,2例冰冻误诊为导管内乳头状瘤伴UDH,3例延迟诊断。IPC病例中,3例冰冻误诊为导管内乳头状瘤伴UDH或伴ADH,2例延迟诊断。EPC病例中,1例冰冻误诊为导管内乳头状瘤伴UDH,2例延迟诊断。原位SPC病例中,6例延迟诊断。SPC伴浸润病例中,2例冰冻误诊为导管内乳头状瘤伴ADH,1例延迟诊断。导管内乳头状瘤伴ADH或伴UDH病例中,1例冰冻误诊为导管内乳头状肿瘤,灶性间质浸润,4例冰冻延迟诊断,其中1例延迟诊断病例怀疑间质浸润。
2.4 冰冻误诊及延迟诊断病例的形态学特点
2.4.1 恶性病变 导管内乳头状瘤伴DCIS以及IPC、EPC共有6例冰冻低诊断为导管内乳头状瘤伴UDH或伴ADH。其中1例石蜡诊断导管内乳头状瘤伴中级别DCIS,冰冻中见较多典型的菊形团样结构、僵硬的拱桥结构,细胞核仁较明显,可见少量小瘤巨细胞(图1A)。共有10例冰冻延迟诊断,1例石蜡诊断IPC,冰冻诊断为未除IPC,冰冻中见分枝状乳头结构,乳头宽窄不一,但间质疏松、没有明显胶原化,乳头轴心周围细胞呈假复层或复层化排列,细胞具有单一性(图1B)。1例石蜡诊断EPC,冰冻诊断为未除EPC,冰冻中见大量菊形团样结构,细胞单一,有厚纤维包囊。其余8例冰冻均诊断为导管内乳头状瘤伴ADH,未除更重病变。除上述3例外,其余病例冰冻中部分可见典型ADH区域,但病灶小或分散(图1C);部分病例在ADH区域仍可见较多量纤维血管轴心;部分病例ADH区域不典型,缺乏典型结构或细胞特点,4例在周围普通导管内出现ADH或DCIS。原位SPC共有6例冰冻诊断为未除SPC,冰冻中均见结节轮廓圆滑,结节内细胞以实性增生为主,纤维血管轴心周围细胞呈栅栏状排列,实性区域出现数量不等的菊形团样结构,4例细胞核偏位、呈浆细胞样,1例纤维血管轴心间质内见大量黏液,1例局灶可见细胞呈流水样排列,细胞核长椭圆形(图1D、E)。共有3例SPC伴浸润冰冻低诊断或延迟诊断,冰冻中均见结节内细胞以实性增生为主,结节内有细胞外黏液,细胞核偏位、呈浆细胞样,部分区域结节轮廓不规则,呈地图样、锯齿状,2例可见细胞内黏液,1例可见小灶黏液癌成分(图1F、G)。
2.4.2 良性病变 2例导管内乳头状瘤伴UDH,冰冻中见导管周围胶原间质及乳头轴心胶原间质中,导管上皮细胞呈腺样、簇状、条索状排列(图1H),1例腺体周围肌上皮在H-E染色下看不清,冰冻误诊为肿瘤浸润周围间质,1例部分腺体周围隐约可见一层不完整的扁平肌上皮,冰冻怀疑间质浸润,请上级医师会诊后,诊断为未除间质浸润。此2例石蜡经免疫组化染色证实为假浸润现象。导管内乳头状瘤伴ADH或伴UDH有3例冰冻诊断为导管内乳头状瘤伴ADH,未除更重病变。前者冰冻中见大量胶原化纤维血管轴心,轴心之间可见少量典型ADH区域;后者冰冻中未见典型ADH区域,可见多少不等大汗腺化生。
3 讨 论
乳腺乳头状肿瘤是包括一系列从良性病变到恶性病变的疾病谱系,WHO对于该类肿瘤各个类型的诊断主要依赖于H-E染色切片中的组织学形态及免疫组化染色结果。而冰冻诊断时往往缺乏免疫组化染色,主要根据在H-E染色下对组织学形态的观察与判断。
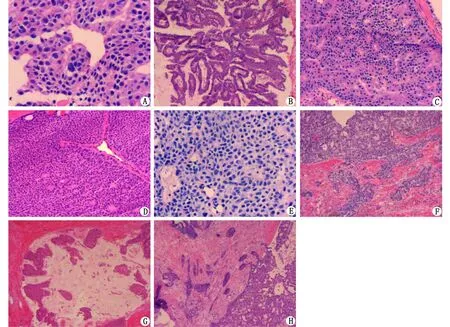
A:中高级别细胞核( ×200);B:分枝状乳头结构,间质疏松,上皮细胞假复层排列( ×40);C:菊形团样结构( ×100);D:实性、菊形团样结构( ×100);E:细胞核偏位,呈浆细胞样( ×200);F:结节轮廓不规则,呈地图样、锯齿状( ×40);G:黏液癌区域( ×40);H:假浸润腺体与右侧的良性病变相延续( ×40)。图1 乳腺乳头状肿瘤冰冻切片中的形态学特点(H-E染色)Fig.1 Morphology characteristic of papillary breast tumors on frozen section tissues (H-E staining)
本研究发现,乳腺恶性乳头状肿瘤较良性乳头状肿瘤更易出现误诊或延迟诊断,与国内报道[3-4]相似。
目前,导管内乳头状瘤伴ADH和伴低级别DCIS以3 mm作为分界线[5-6],以防将很小的低级别病变诊断为DCIS,并且避免这些微小的病变被过度治疗[7-8]。本研究中,导管内乳头状瘤伴DCIS以及IPC、EPC病例误诊或延迟诊断,部分是由于典型ADH区域小或分散,或ADH区域可见较多纤维血管轴心,或ADH区域结构或细胞不典型。日常工作中掌握ADH的典型形态特点是正确识别ADH及测量其范围的前提条件;当ADH区域纤维血管轴心没有明显减少,H-E染色下不易判断轴心内肌上皮存在与否及多寡的情况下,不轻易诊断为导管内乳头状瘤伴低级别DCIS;当典型ADH病灶分散,连续病灶最大径位于临界值附近时,直接诊断导管内乳头状瘤伴低级别DCIS存在一定风险,建议延迟诊断。当ADH形态不典型,不可勉强诊断,待石蜡进行免疫组化染色进一步证实。
本研究中,4例导管内乳头状瘤伴DCIS在周围导管内出现ADH/DCIS,其中3例病变穿插生长,但连续的ADH区域均大致为3 mm,为避免判断偏差导致过度治疗,选择延迟诊断。1例乳头状病变延迟诊断,但周围导管诊断了DCIS,使得该患者避免了二次手术。AGOUMI等[9]指出,导管内乳头状瘤伴ADH/DCIS可能是一种“碰撞”肿瘤,即终末导管小叶单位发生的ADH/DCIS延伸到导管内乳头状瘤中。笔者认为,导管内乳头状瘤内外同时出现ADH/DCIS,如果两者穿插生长,可以合并测量及诊断,如果截然分开,则分开测量并分别诊断。有研究[6,10]表明,导管内乳头状瘤外的ADH/DCIS与继发癌症风险及局部复发风险关系更加密切。所以,周围导管的病变需要诊断,并且在冰冻诊断时,一定程度上可以协助诊断。
导管内乳头状瘤伴中高级别DCIS,DCIS区域没有大小或范围的限制,只要核级达到,即可诊断[11-12]。因此,识别出中高级别细胞核很重要。高级别核异型明显,相对容易识别;中级别核介于高、低之间,形态存在一定交叉,鉴别存在一定主观性,可重复性差。笔者认为,如果细胞核级偏向高级别,冰冻诊断时无需区分中或高级别,因为不影响良恶性的诊断。本研究中1例误诊病例未能识别出核级别偏高及典型DCIS结构,导致低诊断。如果细胞核级偏向低级别,为避免主观偏差,按照导管内乳头状瘤伴低级别DCIS的标准进行诊断可能更稳妥。
本研究中,1例IPC冰冻诊断为未除IPC,形态学属于Ⅰ型IPC。根据定义,要求90%以上乳头轴心完全缺乏肌上皮层[13],但在H-E染色下对肌上皮的判断不甚可靠。国内外学者[14-16]总结了IPC和导管内乳头状瘤在形态上的区别,关于乳头轴的宽度尚存在争议。所以,不能仅仅根据乳头轴的宽度区别二者。Ⅰ型IPC在低倍镜下常呈“蓝色”,细胞形态一致,而导管内乳头状瘤在低倍镜下常呈“粉红色”,细胞较不一致,常伴有大汗腺化生[15]。本研究中的病例在低倍镜下病灶呈“蓝色”,乳头轴的宽度并非均为纤细,但都没有明显的胶原化,细胞具有单一性,这些特点可能具有一定的提示意义。Ⅱ型IPC如果部分区域ADH的形态不够典型,容易被诊断为导管内乳头状瘤伴ADH/低级别DCIS[13]。本研究中,共有8例IPC以Ⅱ型为主,4例冰冻诊断为原位癌病变,其中仅1例为IPC。笔者认为,冰冻诊断时病变的良恶性判断最重要。同为原位癌病变,目前临床处理基本相同,类型判断有所偏差尚可接受。
EPC周围常有厚薄不一的纤维包囊,囊内的乳头状病变可以出现IPC的任何形态,细胞往往为低中核级[17]。本研究中,7例EPC均为低中核级,纤维包囊厚薄不一(4例厚而明显),4例冰冻诊断为原位癌病变,仅有1例怀疑EPC但延迟诊断。EPC的提出是基于结节内外肌上皮的基本消失[18-19],而H-E染色下不能准确判断肌上皮,加上纤维包囊厚薄不一,故冰冻诊断时直接诊断EPC存在困难。目前,EPC被认为可能介于原位癌与浸润性癌之间,但是建议外科仍按照原位癌处理[18-19]。当细胞呈现高核级,才建议按照浸润性癌处理[20]。所以,除非出现高核级,EPC在冰冻诊断时只要诊断为原位癌病变即可。
原位SPC结节轮廓圆滑,结节内细胞以实性排列为主,细胞往往为低级别核,有时细胞呈梭形、流水样排列[17],容易与导管内乳头状瘤伴旺炽性UDH混淆。本研究发现,仅有原位SPC成分时,出现较多延迟诊断。纤维血管轴心周围细胞呈栅栏状排列,实性区出现菊形团样结构,细胞形态单一,细胞核偏位,呈浆细胞样、印戒细胞样,出现细胞内外黏液,对诊断原位SPC有提示意义。而导管内乳头状瘤伴旺炽性UDH常伴有大汗腺化生[15],基本不出现细胞内外黏液。SPC结节轮廓不圆滑、呈地图样、锯齿状[17],对诊断浸润性SPC有提示意义。当SPC呈浸润性生长模式或出现浸润性癌成分时,冰冻确诊符合率较高,但仍存在低诊断病例。3例误诊或延迟诊断病例,虽然病变中黏液丰富,导致组织较破碎,影响观察,但细胞外出现较多黏液,具有提示诊断意义。
冰冻诊断时最严重的情况莫过于假阳性病例导致外科过度治疗,而导管内乳头状瘤最容易出现假阳性的情况莫过于假浸润现象。导管内乳头状瘤经常伴发导管周围间质或纤维血管轴心间质硬化性改变,挤压内陷的腺体,导致这些腺体排列紊乱,呈条索状、簇状排列,肌上皮被挤压,在H-E染色下有时不容易识别。缺乏冰冻诊断经验的医生易将其误诊为浸润性癌。本研究中有2例冰冻时诊断误判。如何避免误判?首先,这些假浸润腺体伴随的导管内乳头状病变多为良性,这些腺体常与主病灶存在一定的延续,两者细胞形态相似,缺乏不典型性或异型性。其次,周围的间质多为胶原组织,罕见浸润引起的促纤维结缔组织。再次,高倍镜下仔细寻找腺体周围肌上皮,有时可见不连续的扁平肌上皮。日常冰冻诊断中,当进一步诊断存在疑点,都应该退一步诊断,避免过诊。
乳腺乳头状病变中UDH和ADH的鉴别不仅关系到其本身的鉴别,还关系到多种恶性乳头状肿瘤的诊断。平时需加强对冰冻中ADH形态的甄别。建议可将冰冻剩余组织进行免疫组化染色,评估对ADH的判断是否准确。倘若在术中冰冻诊断时引入快速免疫组化染色,一方面通过CK5/6、P63等标记肌上皮,另一方面通过CK5/6标记腺上皮协助判断ADH的范围,应该能够改善冰冻确诊符合率。宋欣等[3]通过比较常规冰冻诊断及结合快速免疫组化再次给出术中诊断发现,后者的术中诊断准确率显著高于前者,假阴性率和延迟诊断率显著低于前者;并且快速免疫组化染色流程耗时约 10 min,符合诊断时限要求。
综上所述,冰冻中乳腺恶性乳头状肿瘤的确诊符合率明显低于良性乳头状肿瘤,前者的延迟诊断率明显高于后者。导管内乳头状瘤可以出现假浸润现象,冰冻诊断时需提高警惕,并注意与真性浸润进行鉴别。导管内乳头状瘤伴DCIS以及IPC、EPC的低诊断,主要是因为对ADH形态的识别及范围的评估出现偏差,需加强对冰冻中ADH形态的识别能力。当ADH范围较小(略超过3 mm时)建议暂时保守诊断,待石蜡切片进行免疫组化染色进一步明确其范围。诊断乳腺乳头状肿瘤时需注意识别病变中的中高级别细胞核,因为中高级别DCIS的诊断没有范围限制。对乳腺乳头状肿瘤各个类型形态学特征的掌握,可以在冰冻诊断时提供更多的诊断思路;按原位癌处理的多种乳头状肿瘤类型,在冰冻诊断时能够识别出原位癌病变即可,不必强求精准诊断。乳头状肿瘤良恶性的判断出现偏差,还有部分原因是H-E染色下对肌上皮的判断不够可靠以及ADH形态不够典型,引入快速免疫组化染色可能有助于更好地识别腺上皮的不典型性及肌上皮的存在与否及多寡。在缺乏免疫组化染色的情况下,当进一步诊断存在疑点,应当退一步诊断,以免过诊。
