七氟烷对大鼠脊髓缺血再灌注损伤及Wnt/βcatenin信号通路的影响*
2022-09-01康文越邢丹丹吴多志
张 敏,康文越,邢丹丹,吴多志,林 慧
(海南省人民医院,海南海口 570311)
脊髓缺血再灌注(spinal cord ischemia-reperfusion,SCIR)是胸腹主动脉和脊柱手术的严重并发症,可能导致瘫痪和截瘫[1]。因此,寻找减少SCIR 损伤的策略很有必要。首先脊髓缺血造成其中的细胞缺血缺氧,随后的再灌注导致细胞内钙超载、炎症反应及氧自由基爆发,最终引起神经细胞凋亡、脊髓组织损伤及功能障碍[2]。七氟烷(sevoflurane,SEVO)为常用的麻醉诱导和维持药剂[3]。近年研究显示,SEVO 可通过抗凋亡、抑制自噬、抑制氧化应激和抗炎等对肝[4]、大脑[5]、肺[6]及脊髓[7]等产生保护作用。目前,SEVO 对脊髓等中枢组织缺血性损伤的改善效果已被多项研究证实[5,8-9],然而其机制主要集中于对凋亡、炎症和氧化应激等抑制的的探讨,对脊髓中受损轴突的自我修复和再生的探讨较少,而后者是神经损伤后功能恢复的生理基础[10]。Wnt/β-catenin 通路是进化保守的经典信号通路,负责调节细胞存活、生长、分化等过程,其活化可促进视神经[11]及脊髓[10]损伤后的轴突再生,实现对神经损伤的缓解。然而SEVO 对SCIR 损伤后轴突再生的作用并不清楚,本研究拟采用胸主动脉阻断法建立SCIR 大鼠模型,观察吸入SEVO 对SCIR 大鼠轴突再生和Wnt/β-catenin通路的影响,以探讨其机制。
材料和方法
1 动物
40 只雄性SPF 级SD 大鼠,6 周龄,体重180~200 g,购自北京维通利华实验动物技术有限公司[SCXK(京)-2016-0011]。在湿度为(40±5)%、温度为(23.0±0.5)℃、光/暗循环为12 h/12 h 动物房中饲养1周以适应环境。
2 主要试剂
SEVO(吸入用)购自上海恒瑞医药有限公司;βcatenin 抑制剂XAV939(XAV)购自MCE;β-catenin、生长相关蛋白43(growth-associated protein 43,GAP43)和硫酸软骨素蛋白聚糖NG2(chondroitin sulfate proteoglycan NG2,NG2)抗体购自Abcam;微管相关蛋白2(microtubule-associated protein 2,MAP2)抗体购自Invitrogen;神经丝H(neurofilament-H,NFH)、髓磷脂碱性蛋白(myelin basic protein,MBP)、GAPDH 和lamin B 抗体,以及羊抗兔(Alexa Fluor®488、HRP)或小鼠(Alexa Fluor®594)IgG 购自Cell Signaling Technology;PVDF 膜和ECL 试剂购自Millipore;HE 试剂、TUNEL 凋亡试剂盒、Nissl 染色液、总及核蛋白提取试剂购自生工生物工程(上海)股份有限公司。小动物生理记录仪为iWorx产品。
3 主要方法
3.1 SCIR 模型建立[12]术前大鼠均禁食12 h,经腹腔注射2%戊巴比妥钠(2 mL/kg),麻醉后仰卧固定,切开左颈肌肉暴露总动脉,置入24G 套管针并连接肝素处理的小动物生理记录仪和储血装置,将24 G套管针刺入尾动脉并连接小动物生理记录仪,检测远端动脉压。全身肝素化后,切开腹部肌肉暴露左髂总动脉,置入球囊套管推至胸主动脉开口,往套管中注入0.05 mL 生理盐水,使球囊鼓起以阻断主动脉。远端动脉压<10 mmHg 则表明阻断成功。随后立即拨动三通阀,将约6 mL 血液流入储血装置,控制体循环平均动脉压为40 mmHg,实现脊髓缺血并维持9 min后,恢复主动脉血流,实现脊髓再灌注。
3.2 动物分组及给药 随机数字法将SCIR 大鼠分为SCIR 组、SEVO 组、SEVO+XAV 组,每组10 只,另外选取假手术(sham)组10 只。SEVO 组造模前吸入3 h 2.4% SEVO[8];SEVO+XAV 组在吸入SEVO 前先鞘内注射10µL 0.5 mmol XAV[13];sham 组和SCIR 组同步吸入空气并鞘内注射生理盐水。再灌注96 h后对所有大鼠进行BBB评分[14]。
3.3 样本采集 评分后,各组大鼠随机取5 只,麻醉后断头取L4~L6 段脊髓,-80 ℃保存;余下5 只收集L4~L6 段脊髓,浸没在包埋剂OCT 中速冻后,用恒温冰冻切片机制备脊髓冰冻切片(每片10 µm),加入丙酮固定10 min。
3.4 HE、Nissl 和TUNEL 染色 取3.3 的脊髓冰冻切片,经PBS冲洗后,分别加入HE染色试剂、Nissl染色试剂和TUNEL 试剂孵育,之后洗片、封片,光镜下观察脊髓组织形态及细胞凋亡、坏死情况。
3.5 免疫组化染色 取3.3 的脊髓冰冻切片,经PBS 冲洗、羊血清封闭后,滴加Ⅰ抗(兔抗大鼠NF-H或MBP,稀释比1∶500)4 ℃孵育过夜,滴加Ⅱ抗(稀释比1∶2 000)孵育1 h,滴加二氨基联苯胺(DAB)显色、苏木素复染后封片,光镜下拍照并计数。
3.6 免疫荧光染色 取3.3 的脊髓冰冻切片,经PBS 冲洗、羊血清封闭后,滴加Ⅰ抗(兔抗大鼠GAP43 或MBP 和小鼠抗大鼠β-catenin,稀释比1∶50)孵育3 h,滴加Ⅱ抗(羊抗兔Alexa Fluor®488 或羊抗小鼠Alexa Fluor®594 IgG,稀释比1∶1 000)避光孵育1 h,回收Ⅱ抗,滴加抗荧光淬灭封闭液封片,荧光显微镜下拍照并计数。
3.7 Western blot 检测 采用试剂盒提取脊髓组织(-80 ℃)中总蛋白和细胞质、核蛋白。定量后,各组取20µg蛋白沸水浴变性,加样,电泳完成后,将胶中蛋白电转印到聚偏二氟乙烯膜上,将膜依次与封闭液(5%脱脂奶粉溶液)孵育1 h、Ⅰ抗(GAPDH、lamin B、GAP43、NF-H、MAP2、NG2、MBP 和β-catenin,稀释比1∶1 000)4 ℃孵育过夜、Ⅱ抗(稀释比1∶3 000)孵育1 h、化学发光液作用5 min 后,放在蛋白凝胶成像仪中拍照,分析各条带灰度值。
4 统计学处理
采用GraphPad Prism 8.0 进行数据分析。用均数±标准差(mean±SD)描述各项数据。单因素方差分析行多组间比较,SNK-q检验行两两比较。以P<0.05为差异有统计学意义。
结果
1 SEVO对后肢功能评分的影响
sham 组各大 鼠BBB 评分均 为21.00;SCIR 组BBB 评分较sham 组显著降低(P<0.01);SEVO 组BBB 评分较SCIR 组显著升高(P<0.01);SEVO+XAV组BBB评分较SEVO组显著降低(P<0.01),见图1。

Figure 1.The BBB score of the rats in each group.Mean±SD.n=10.**P<0.01 vs sham group;△△P<0.01 vs SCIR group;##P<0.01 vs SEVO group.图1 各组大鼠的BBB评分
2 SEVO对脊髓组织损伤的影响
sham 组脊髓组织中神经纤维排列规则,未见肿胀或核固缩神经细胞,凋亡细胞较少,尼氏小体较多;SCIR组脊髓组织有空洞,可见较多肿胀或核固缩的坏死或凋亡细胞,尼氏小体较少;SEVO 组脊髓组织损伤有所减轻,凋亡细胞减少,尼氏小体增多;SEVO+XAV 组脊髓组织损伤相比于SEVO 组加重,可见较多肿胀或核固缩的坏死或凋亡细胞,尼氏小体较少,见图2。
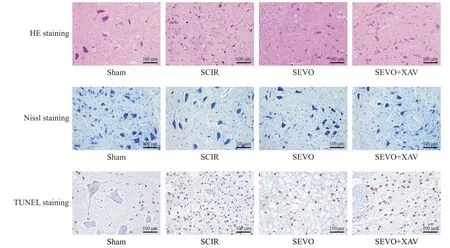
Figure 2.HE staining,Nissl staining and TUNEL staining to observe the morphological changes of the spinal cord.The scale bar=100µm.图2 HE染色、Nissl染色和TUNEL染色观察脊髓组织形态
3 SEVO对脊髓轴突再生及髓鞘形成的影响
SCIR 组NF-H+和MBP+细胞数量显著低于sham组(P<0.01);SEVO 组NF-H+和MBP+细胞数量显著高于SCIR 组(P<0.01);SEVO+XAV 组NF-H+和MBP+细胞数量显著低于SEVO组(P<0.01),见图3。

Figure 3.Immunohistochemical staining of spinal cord tissues.The scale bar=100 µm.A:NF-H staining(brown represents NF-H+cells);B:MBP staining(brown represents MBP+ cells).Mean±SD. n=10.**P<0.01 vs sham group;△△P<0.01 vs SCIR group;##P<0.01 vs SEVO group.图3 免疫组化法观察脊髓组织再生情况
4 SEVO对轴突再生及髓鞘形成相关蛋白的影响
SCIR 组NF-H、MAP2 及MBP 蛋白水平显著低于sham 组(P<0.01),GAP43 和NG2 蛋白水平显著高于sham 组(P<0.01);SEVO 组NF-H、MAP2、GAP43、NG2 及MBP 蛋白水平显著高于SCIR 组(P<0.01);SEVO+XAV 组NF-H、MAP2、GAP43、NG2 及MBP 蛋白水平显著低于SEVO组(P<0.01),见图4。
5 SEVO 调节Wnt/β-catenin 信号通路促进SCIR大鼠轴突再生
免疫荧光结果显示,β-catenin 和GAP43 基本共表达在同一细胞中,β-catenin 和MBP 也基本共表达于同一细胞。与sham 组相比,SCIR 组β-catenin+GAP43+细胞和β-catenin+MBP+细胞数量显著减少,胞质、胞核和总β-catenin 水平及胞核/胞质β-catenin比例显著降低(P<0.01);与SCIR组相比,SEVO组βcatenin+GAP43+细胞和β-catenin+MBP+细胞数量显著增多,胞核和总β-catenin 水平及胞核/胞质βcatenin 比例显著升高(P<0.01);与SEVO 组相比,SEVO+XAV 组β-catenin+GAP43+细胞和β-catenin+MBP+细胞数量显著减少,胞核和总β-catenin 水平及胞核/胞质β-catenin 比例显著降低(P<0.01),见图5、6。
讨 论

Figure 4.Detection of protein levels of NF-H,MAP2,GAP43,NG2 and MBP by Western blot.Mean±SD. n=10.**P<0.01 vs sham group;△△P<0.01 vs SCIR group;##P<0.01 vs SEVO group.图4 Western blot检测NF-H、MAP2、GAP43、NG2和MBP蛋白水平
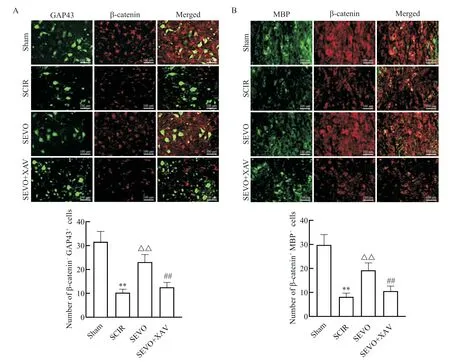
Figure 5.Immunofluorescence staining of GAP43/MBP and β-catenin.A:immunofluorescence staining to observe the co-localization of GAP43 and β-catenin(green represents GAP43+ cells,while red represents β-catenin+ cells);B:immunofluorescence staining to observe the co-localization of MBP and β-catenin(green represents MBP+ cells,while red represents β-catenin+cells).Mean±SD. n=10.**P<0.01 vs sham group;△△P<0.01 vs SCIR group;##P<0.01 vs SEVO group.图5 GAP43、MBP及β-catenin免疫荧光染色
尽管SCIR 损伤的发生频率较低,但会导致较高死亡率和致残率,并降低生活质量,因此也应重视其防治。SCIR 时神经元受到冲击出现变性或坏死,伴随组织损伤,表现为细胞肿胀或核固缩变性坏死、尼氏体减少等[12]。尼氏体具有较强代谢功能,为神经元功能的标志物,当神经元受损时,尼氏体会减少或消失[15]。动物实验显示,SCIR 造成的神经损伤还可引起后肢行为障碍[8]。本研究中,SCIR 大鼠脊髓神经细胞出现肿胀、核固缩变性坏死或凋亡,尼氏体减少等情况,且BBB 评分降低,表明成功构建SCIR 模型。研究显示,2.4%SEVO 预处理能有效改善SCIR大鼠神经损伤[8]。本研究亦证实,2.4% SEVO 可显著减轻SCIR 大鼠脊髓组织病变,提高BBB 评分,表明SEVO对SCIR神经损伤有缓解作用。

Figure 6.Detection of protein levels of β-catenin by Western blot.Mean±SD. n=10.**P<0.01 vs sham group;△P<0.05,△△P<0.01 vs SCIR group;#P<0.05,##P<0.01 vs SEVO group.图6 Western blot检测β-catenin蛋白水平
SCIR可破坏脊髓神经元轴突,影响神经传导,且可对邻近组织造成级联的继发性伤害,进一步导致伤害加重[15]。而促进轴突生长、伸长和髓鞘再生,不仅有利于神经元轴突的自我修复与再生,而且可重构神经传导,恢复神经功能[16]。Sachdeva 等[17]研究表明,增加生长相关蛋白GAP43的表达,可诱导轴突出芽、伸长,促进轴突分支的生长,并引导新生轴突向损伤区域生长,重建损伤区轴突结构和功能。在急性脊髓损伤中的研究显示,NF-H 表达与髓轴突计数同步降低[18],推测NF-H 可作为中枢神经系统神经元轴突的标志物,在轴突径向生长中发挥作用。MAP2则特异性表达在轴突微管中,参与轴突伸长与分支[19]。另外,缺血等损伤后,少突胶质祖细胞迅速增殖、分化为少突胶质细胞,向缺血损伤处迁移,包绕在新生轴突外缘形成髓鞘,对轴突具有支持和绝缘作用,有利于轴突连接的重建[20]。NG2 为少突胶质祖细胞的标志物,可反映髓鞘的再生程度,MBP为髓鞘的重要结构蛋白,可反映髓鞘厚度。本研究中,SCIR 大鼠脊髓NF-H、MAP2 及MBP 蛋白水平降低,GAP43 和NG2 蛋白水平增高,提示SCIR 可造成大鼠脊髓神经元轴突减少和髓鞘损伤,进而减弱或消除神经元之间的信号传递,导致后肢运动障碍,且轴突具有一定自我修复能力,但作用有限,不足以抵抗SCIR 损伤。而SEVO 干预可进一步提高脊髓GAP43和NG2 蛋白水平,同时提高NF-H、MAP2、及MBP 蛋白水平,提示SEVO还可能通过促进轴突和髓鞘的再生,实现对SCIR大鼠神经功能的保护。
经典Wnt/β-catenin 通路的活化通过β-catenin 核易位介导,β-catenin 在细胞中积累并转移入核,可活化启动靶基因表达,提高神经系统轴突分支、生长和重塑能力,是中枢神经损伤后的自我修复机制[21]。研究[11]显示,激活Wnt/β-catenin 通路可促进小鼠视神经的轴突再生和神经节细胞存活,促进神经恢复。Seo 等[22]在脊髓损伤中也观察到Wnt/β-catenin 通路的这种神经保护作用[22]。本研究中,SCIR 组βcatenin 和GAP43 基本共表达在同一细胞,β-catenin和MBP 也基本共表达于同一细胞,部分β-catenin+细胞未见GAP43或MBP表达,可能与SCIR造成神经细胞轴突损伤,轴突标记蛋白GAP43 或MBP 无法成功染色有关。且与sham 组相比,SCIR 组β-catenin+GAP43+细胞和β-catenin+MBP+细胞数量减少,胞质、胞核及总β-catenin 水平降低,胞核/胞质β-catenin 比例也降低,表明Wnt/β-catenin 通路活化程度较低,不能抵抗SCIR 造成的神经细胞轴突损伤。药物干预可激活Wnt/β-catenin 信号通路,促进轴突再生,保护SCIR 损伤后的神经传导[23-24]。本研究观察到SEVO具有类似作用,表现为增加β-catenin+GAP43+细胞和β-catenin+MBP+细胞数量,升高胞质、胞核及总βcatenin 水平,胞核/胞质β-catenin 比例也增高,且βcatenin 抑制剂XAV 可减弱SEVO 促轴突和髓鞘再生的作用及其对SCIR 后受损神经的保护作用,提示激活Wnt/β-catenin 通路可能是SEVO 减轻SCIR 损伤的作用机制,有待更严谨的证明。
综上所述,SEVO 可促进轴突和髓鞘再生,缓解大鼠SCIR 神经损伤,其机制可能与激活Wnt/βcatenin通路有关。
