雷帕霉素通过AKT/mTOR途径抑制川崎病冠状动脉内皮细胞炎症因子的表达*
2022-09-01李洁滢杨艳娟
李洁滢,胡 琳,杨艳娟,周 忠,田 正,焦 蓉
(湖北医药学院附属襄阳市第一人民医院儿科,湖北襄阳 441000)
川崎病(Kawasaki disease,KD)又称皮肤黏膜淋巴结综合征,是一种病因不明的急性发热出疹性疾病,常见于5 岁以下婴幼儿,病理变化为全身中、小血管炎,可累及冠状动脉,导致冠状动脉损伤(coronary artery lesion,CAL)[1]。目前大剂量静脉使用丙种球蛋白(intravenous immunnoglobulin,IVIG)联合阿司匹林口服是治疗KD的标准方案,可使CAL发生率下降至3%~5%。然而,约10%~20%的KD 患儿对IVIG 无反应,主要表现为首次剂量IVIG 后36~48 h 仍持续发热且临床症状无改善。对于无反应型病例,糖皮质激素、血浆置换、乌司他丁、英夫利昔单抗、免疫抑制剂等治疗有其重要的应用前景[2-3]。
目前的研究指出,KD 冠脉血管内皮损伤及功能紊乱可能与血管炎的发生、发展有关。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是全身炎症反应中重要的炎症因子,也是KD 急性期最主要的促炎因子之一,不仅可以直接损伤血管内皮细胞,破坏内皮细胞的屏障功能,还能进一步诱导内皮细胞表达黏附分子、趋化因子等。在KD 急性期炎症反应的严重程度判断方面,TNF-α 的表达水平可作为一个有价值的参考指标[4]。在KD 动物模型中,TNF-α 也是诱导冠状动脉炎症和动脉瘤形成所必需的[5]。Ma等[6]及Huang 等[7]研究者们常用TNF-α 诱导的人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAEC)作为KD 冠脉损害的细胞模型,因此在本研究中我们延用了这一造模方法。
雷帕霉素(rapamycin,Rapa)又称西罗莫司,是一种新型高效的脂溶性免疫抑制剂,能够特异性抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)。mTOR 是一种丝氨酸-苏氨酸激酶,在调控细胞内环境及细胞生长的信号通路中发挥至关重要的作用[8]。Rapa 能够抑制mTOR 信号通路进而诱导自噬的发生,但目前mTOR 信号通路是否参与KD冠状动脉内皮细胞的炎症损伤,以及Rapa能否诱导KD冠状动脉内皮细胞发生自噬及其调控机制的研究较少。本研究用Rapa处理KD冠状动脉内皮细胞,检测细胞活力、自噬及炎症损伤的相关指标,旨在初步探讨Rapa对冠状动脉内皮细胞的自噬诱导效应及抗炎作用可能的机制。
材料和方法
1 实验材料及主要试剂
HCAEC 购自Otwo Biotech;DMEM 高糖培养液底液购自Gibco;TNF-α 和细胞自噬染色检测试剂盒购自Solarbio;胎牛血清购自Sigma;Rapa 购自Selleck;CCK-8 试剂盒购自Biosharp;TB Green®Premix Ex Taq™(Tli RNase H Plus)购自TaKaRa;兔抗人蛋白激酶B(protein kinase B,PKB/AKT)抗体、鼠抗人磷酸化AKT(phosphorylated AKT,p-AKT)抗体、兔抗人微管相关蛋白1 轻链3(mitotubule-associated protein 1 light chain 3,LC3)抗体和兔抗人beclin-1 抗体均购自Poteintech;兔抗人mTOR 和磷酸化mTOR(phosphorylated mTOR,p-mTOR)抗体均购自Cell Signaling Technology;鼠抗人核因子κB(nuclear factor-κB,NF-κB)抗体购自Santa Cruz;兔抗人磷酸化NF-κB p65(phosphorylated p65,p-p65)抗体购自Wanleibio;兔抗人p62、白细胞介素6(interleukin-6,IL-6)和IL-1β抗体均购自Absin。
2 实验仪器
CO2恒温细胞培养箱(Thermo);7500型实时荧光定量PCR 仪(Thermo Fisher);化学发光成像仪(Bio-Rad);荧光显微镜及分子病理分型系统(Olympus);SpectraMax 多功能酶标仪(Molecular Devices);4 ℃低温高速离心机(Beckman)。
3 细胞培养及分组
HCAEC 在37 ℃、5% CO2加湿的 气氛下,用DMEM 高糖培养液,附加10%胎牛血清、1%青霉素(100 U/mL)和1%链霉素(100 mg/L)进行培养,2~3 d传代1 次,选择对数期生长良好的细胞进行实验。根据处理条件的不同将HCAEC 分为对照组、TNF-α刺激组(TNF-α 刺激4 h)、TNF-α+50 nmol/L Rapa 组(50 nmol/L Rapa 预保护24 h 后再用TNF-α 刺激4 h)和TNF-α+100 nmol/L Rapa 组(100 nmol/L Rapa 预保护24 h后再用TNF-α刺激4 h)。
4 方法
4.1 CCK-8 法检测细胞活力 按CCK-8 试剂说明书检测TNF-α 及Rapa 对HCAEC 的细胞毒作用。将对数生长期的HCAEC 接种于96 孔板,每孔4 000 个细胞。我们首先参考Fan 等[9]及Wang 等[4]的研究,筛选出Rapa 及TNF-α 作用的大致浓度范围及作用时间,即用不同浓度(200、100、50、25 和12.5 nmol/L)的Rapa 作用24 h,或不同浓度(100、50、25、12.5和6.25µg/L)的TNF-α 作用4 h 后每孔加入10µL 的CCK-8 试剂,避光保存置于培养箱2 h 后用酶标仪检测450 nm 处的吸光度(A),实验重复3次。根据下列公式计算:抑制率(%)=(1-实验组A值/阴性对照A值)×100%。
4.2 RT-qPCR 检测HCAEC 中AKT、mTOR、IL-1β、IL-6 和IL-8 的mRNA 表达水平 将细胞按照上述分组处理铺于6 孔板中培养,用Trizol 法提取各组细胞总RNA,以提取的总RNA 为模板,逆转录为cDNA,反应体系为70 ℃保温10 min后迅速在冰上冷却。使用TB Green®Premix Ex Taq™(Tli RNase H Plus)进行扩增,扩增40个循环周期,每个标本3个复孔。引物序列见表1。

表1 引物序列Table 1.Sequences of the primers
4.3 Western blot 检测AKT、mTOR、IL-1β、IL-6、NFκB、LC3、beclin-1 和p62 蛋白的表达水平 将孵育后的HCAEC 裂解,使用BCA 蛋白测定试剂盒测定蛋白质浓度。吸取处理好的蛋白样品进行聚丙烯酰胺凝胶电泳,之后用聚偏二氟乙烯膜进行转膜(250 mA,150 min)。抗体孵育前将膜放置在5%脱脂奶粉中封闭2 h,滴加Ⅰ抗(1∶1 000)后4℃孵育过夜。在TBST 洗涤后加入辣根过氧化物酶标记的羊抗鼠或抗兔IgG Ⅱ抗(1∶3 000)孵育2 h,使用高灵敏度化学发光呈像系统显影定影后得到各组蛋白质印迹结果,重复做3 次。使用Image Lab 软件进行积分吸光度分析,比较各组蛋白水平差异。
4.4 单丹磺酰尸胺(monodansylcadaverine,MDC)染色 MDC 可被细胞吸收并选择性聚集于自噬泡中,在荧光显微镜下可观察到染上MDC 荧光的自噬泡呈绿色点状。选择生长良好的HCAEC 接种于24 孔板,按上述分组处理培养后弃去原培养液,用300~400 µL 的洗涤液清洗细胞2 遍,每孔加入20 µL 的MDC,室温避光染色15~45 min(染色时间根据染色结果进行调整,可适当延长),再用洗涤液清洗2 遍后置于荧光显微镜下观察(激发滤光片波长355 nm,阻断滤光片波长512 nm),计数并拍照。
5 统计学方法
使用GraphPad Prism 8 软件进行统计分析并绘制统计图。计量资料以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结果
1 Rapa和TNF-α对HCAEC活力的影响
将Rapa 溶解于有机溶剂二甲亚砜(dimethyl sulfoxide,DMSO)中,用不同浓度(12.5、25、50、100和200 nmol/L)的Rapa 处理冠脉内皮细胞24 h 后,如图1A 所示,除200 nmol/L 组细胞活力被显著抑制外(P<0.01),其余各组细胞的活力无显著差异(P>0.05)。因此,可忽略因DMSO 毒性作用所致的细胞生长抑制,我们用50 和100 nmol/L 作为后续实验预保护的Rapa 浓度。用不同浓度(6.25、12.5、25、50和100 µg/L)的TNF-α 处理冠脉内皮细胞4 h 后,如图1B 所示,6.25、12.5 和25µg/L 组细胞活力无显著差异(P>0.05),当TNF-α 浓度高于50µg/L 后细胞活力显著下降(P<0.01)。因此,我们后续选用50µg/L的TNF-α刺激HCAEC。
2 Rapa促进TNF-α刺激的HCAEC自噬发生
Western blot 结果显示,与对照组相比,TNF-α 刺激组自噬相关蛋白beclin-1 表达水平和LC3-II/LC3-I比值显著下降(P<0.05),p62 表达水平显著升高(P<0.05);用50 和100 nmol/L Rapa 预保护处理后,beclin-1 表达水平和LC3-II/LC3-I 比值显著升高(P<0.01),p62表达水平显著下降(P<0.05),见图2。
MDC 染色结果显示,TNF-α 处理后,细胞自噬泡较正常组明显减少;经50 和100 nmol/L Rapa 处理后HCAEC自噬泡数量明显增加,见图3。
3 Rapa抑制TNF-α诱导的HCAEC炎症因子表达
RT-qPCR 结果表明,与对照组相比,HCAEC 经TNF-α 刺激后炎症因子IL-6、IL-1β 和IL-8 的mRNA表达水平显著升高(P<0.01);50 和100 nmol/L Rapa预保护24 h 后IL-6(P<0.05)、IL-1β(P<0.05)和IL-8(P<0.01)的mRNA 表达被抑制,见图4。Western blot 结果亦显示,与对照组相比,TNF-α 刺激后IL-6和IL-1β 的蛋白表达被激活(P<0.01);Rapa 显著抑制IL-6和IL-1β蛋白的表达(P<0.01),见图5。

Figure 1.The cytotoxicity of rapamycin(Rapa;A)and TNF-α(B)on HCAEC.Mean±SD. n=3.**P<0.01 vs 0 nmol/L Rapa or 0µg/L TNF-α group.图1 Rapa及TNF-α对HCAEC的细胞毒性作用

Figure 2.Rapamycin(Rapa)up-regulated the expression of beclin-1 and the ratio of LC3-II/LC3-I in HCAEC,but inhibited the expression of p62 protein.Mean±SD. n=3.#P<0.05 vs control(Con)group;*P<0.05,**P<0.01 vs TNF-α group.图2 Western blot检测HCAEC中beclin-1、p62和LC3的蛋白水平
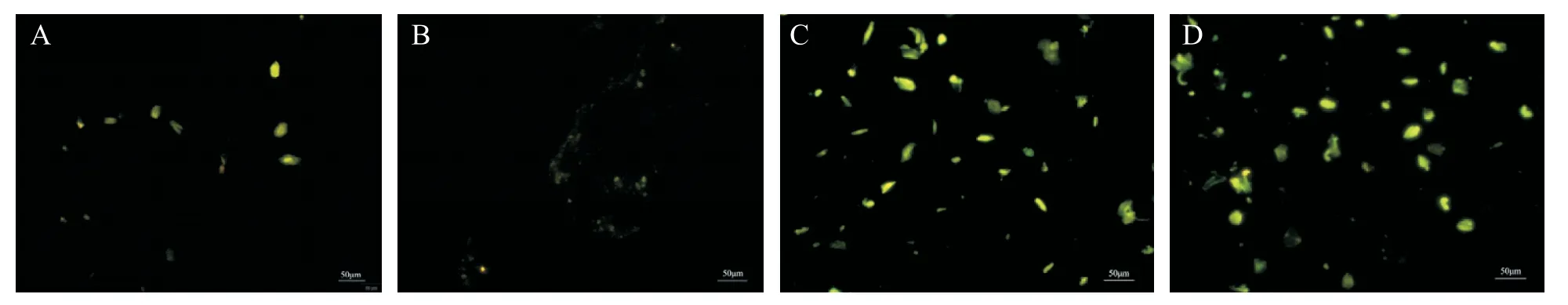
Figure 3.After rapamycin(Rapa)treatment,the number of autophagic vesicles in HCAEC increased(scale bar=50µm).A:control group;B:TNF-α group;C:TNF-α+50 nmol/L Rapa group;D:TNF-α+100 nmol/L Rapa group.图3 MDC染色检测TNF-α和Rapa作用后HCAEC自噬泡的变化
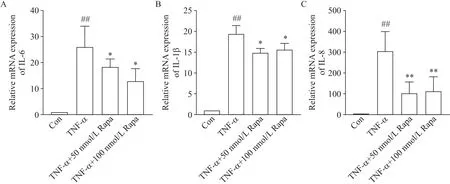
Figure 4.Rapamycin(Rapa)significantly inhibited the mRNA expression of IL-6(A),IL-1β(B)and IL-8(C)in HCAEC.Mean±SD. n=3.##P<0.01 vs control(Con)group;*P<0.05,**P<0.01 vs TNF-α group.图4 RT-qPCR检测各组HCAEC中IL-6、IL-1β和IL-8的mRNA表达水平
4 Rapa 可能通过AKT/mTOR/NF-κB 信号通路来诱导自噬并发挥抗炎作用
为了探究Rapa 促进自噬发生及减少炎症因子表达的作用机制,我们检测了mTOR 及其上游AKT、下游NF-κB 的表达。与对照组相比,TNF-α 作用4 h后,HCAEC 中p-p65蛋白水平显著升高(P<0.01),同时AKT 和mTOR 的mRNA 表达水平及p-AKT 和pmTOR 蛋白水平也显著升高(P<0.05);Rapa 预保护24 h 后上述mRNA 及蛋白水平均显著降低(P<0.05或P<0.01),见图5~7。
讨 论
KD 是一种以动脉内皮细胞活化为特征的系统性脉管炎,逐渐成为儿童获得性心脏病的主要原因之一。KD 的发病机制尚不明确,可能涉及免疫活化、炎症因子、NF-κB、基质金属蛋白酶、血管内皮损伤等诸多因素[10-11]。组织病理学研究也发现,KD 患者冠状动脉血管壁发生明显破坏,内皮细胞脱落、大量炎性细胞侵润[12]。因此本研究主要采用体外培养的HCAEC 来探索早期KD 血管炎的发病机制,我们用KD 急性期最主要的促炎因子TNF-α 刺激HCAEC,观察到内皮细胞被激活,大量炎症因子如IL-6、IL-1β 等表达,这提示我们成功构建了KD 血管损伤的细胞模型。
AKT/mTOR 信号通路在人体各系统疾病尤其是心血管疾病发展进程中发挥关键的调节作用[13-14]。现有的文献表明,Rapa 可能通过影响AKT/mTOR 信号通路,改善心脏结构和功能,减轻心力衰竭或减缓心肌肥厚的进展等[15]。但关于AKT/mTOR 信号通路是否参与KD的发生与发展目前尚无定论。从我们的研究结果中可以推测mTOR通路与KD冠脉内皮细胞损伤有一定的相关性,并对AKT 进行反馈调节,mTOR通路的激活会加速AKT 的磷酸化,用Rapa 阻断mTOR通路后,AKT的磷酸化就相应减少。有研究指出,Rapa最初为一种免疫抑制剂,在单核细胞中可抑制NF-κB 依赖性前炎症细胞因子IL-12 生成,增加信号传导及转录激活因子3依赖性抗炎因子IL-10的产生[16]。同样,在TNF-α诱导的HCAEC 中,mTOR 的阻断抑制了NF-κB 信号通路的活化并减少相关炎症因子的表达,这提示mTOR 通路可能参与了KD 冠脉内皮细胞的炎症反应。但mTOR 蛋白包括mTOR 复合物1(mTOR complex 1,mTORC1)和mTORC2。这两种形式的mTOR 复合物在对Rapa 的敏感性、相关蛋白成分、上游信号、底物特异性以及它们控制的细胞功能方面各不相同[17],在KD冠状动脉内皮细胞中Rapa作用于何种复合物仍需进一步的探索。另外,疑惑的是,陈芳[18]等关于mTOR基因rs1883965 位点多态性与KD的关联性研究中显示,KD患儿mTOR基因型分布与健康儿童相比差异无统计学意义,表明mTOR基因可能并未参与KD及其冠脉损伤的发生。但该研究仅从基因水平进行分析且样本量较小,故仍需进行大样本、多中心的研究。

Figure 5.Rapamycin(Rapa)significantly decreased the protein levels of IL-6,IL-1β and p-p65 in HCAEC.Mean±SD. n=3.##P<0.01 vs control group;**P<0.01 vs TNF-α group.图5 Western blot检测HCAEC中IL-6、IL-1β和p-p65的蛋白水平
自噬可以降解多余蛋白质及损伤细胞器,在急性病理损伤的情况下,自噬激活被认为是保护性的[15]。自噬通过内皮细胞、巨噬细胞、成纤维细胞等参与多种血管性疾病及炎性疾病,而以血管非特异性炎症为主要病理改变的KD,其炎症反应及冠状动脉内皮细胞的损害过程中是否存在自噬的发生,目前报道不多。Huang 等[19]的研究表明,缺乏自噬可能有助于KD 患者外周血中性粒细胞的持续活动,进而导致内皮细胞的损伤,IVIG 可增强中性粒细胞的自噬和中性粒细胞的死亡,但其确切的机制仍有待阐明。然而Qin等[20]的研究推测,KD患者外周血单核细胞分泌的趋化因子和炎症因子可诱导内皮细胞过度自噬,并导致HCAEC 的炎症损伤,这表明外周血单核细胞和中性粒细胞在KD 中发挥不同的作用,内皮细胞的自噬在不同的生化因素诱导下可能会导致不同的结果[21]。而本研究直接检测了冠状动脉内皮细胞的自噬水平,我们观察到在TNF-α 诱导的KD 冠脉损害的细胞模型中自噬功能受损,Rapa可以显著提高HCAEC的自噬水平,且进一步证明了这一作用可能是通过AKT/mTOR 及NF-κB 信号通路来实现的。除了AKT/mTOR 信号通路外,Marek-Iannucci 等[22]提出AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)途径可能也参与了KD 内皮细胞自噬的发生。在干酪乳杆菌细胞壁提取物诱导的小鼠KD 心血管损伤中,促进自噬的AMPK途径相关蛋白表达减少,自噬和线粒体清除功能障碍,并导致血管平滑肌细胞Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)炎症小体失控激活和IL-1β的产生。
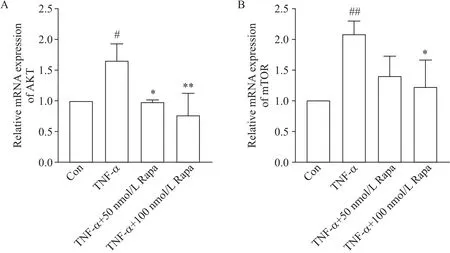
Figure 6.Rapamycin(Rapa)significantly inhibited the mRNA expression of AKT(A)and mTOR(B)in HCAEC.Mean±SD. n=3.#P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs TNF-α group.图6 RT-qPCR检测HCAEC中AKT和mTOR的mRNA表达水平
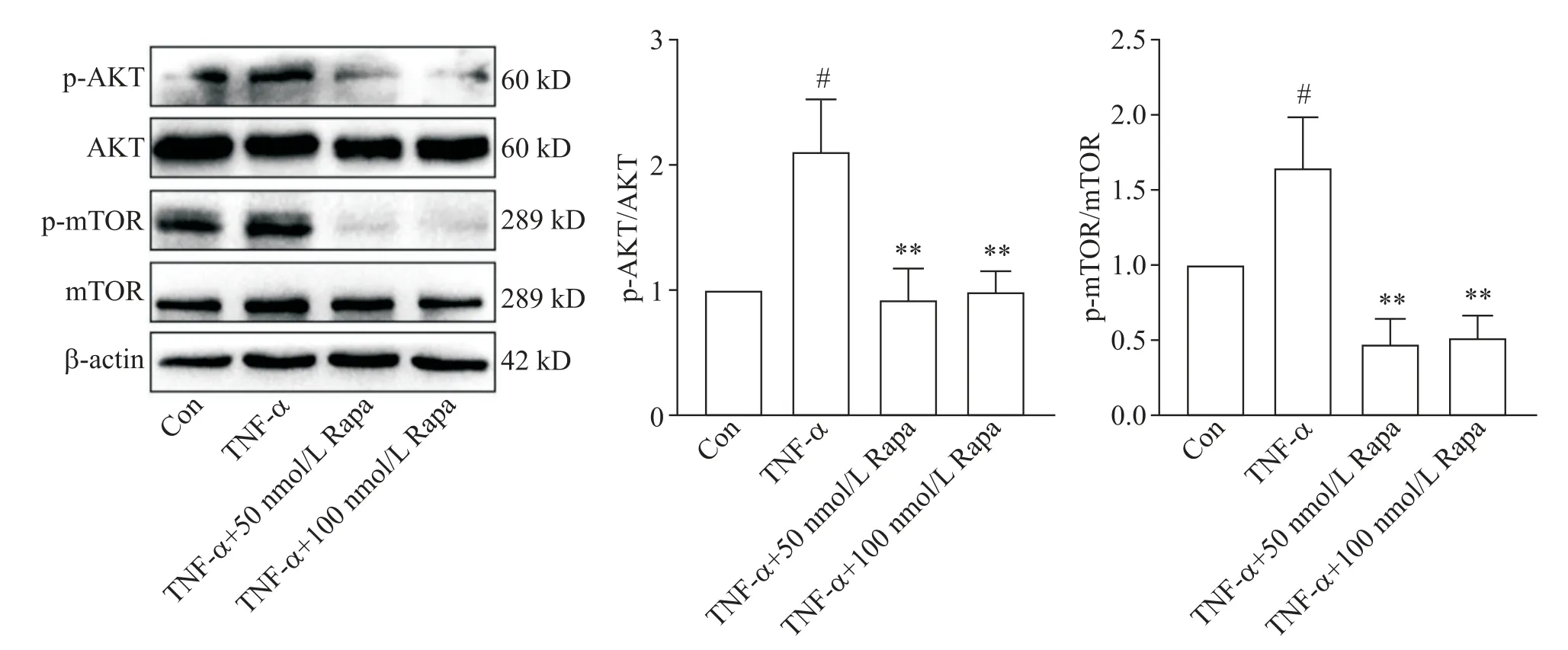
Figure 7.Rapamycin(Rapa)significantly decreased the protein levels of p-AKT and p-mTOR in HCAEC.Mean±SD. n=3.#P<0.05 vs control group;**P<0.01 vs TNF-α group.图7 Western blot检测HCAEC中p-AKT和p-mTOR的蛋白水平
总的来说,我们的研究首次证明了在KD 冠脉损害的细胞模型中,自噬水平下降,炎症因子大量表达;Rapa 可以通过自噬依赖的机制减轻内皮细胞炎症,且AKT/mTOR 及NF-κB 信号通路在这一过程中起重要作用。这些结果可能为KD 的病理生理学研究提供重要见解。但本研究仅涉及细胞实验,后续本课题组还将进一步完善体内实验以深入探索自噬调节在KD 中的作用,以期为KD 的治疗提供参考资料。
